高中化学物质颜色总结
高中化学物质颜色总结
1、红色世界
(1)基态:Fe2O3 (红褐色)、Fe (OH)3 (红 棕色)、[Fe (SCN)]2+ (血红色)、Cu (紫红色)、Cu2O (砖红色)、NO2 (红棕色)、P(红磷、暗红色)、Br2 (深红棕色)、红色石蕊试纸、 品红溶液。
(2)激发态:充氦气的灯光呈粉红色,充氖气的灯光呈红色,钙元素的焰色呈砖红色。
(3)化学变化:
①紫色石蕊在酸性溶液(pH<5.0)中变红,
②润湿的蓝色石蕊试纸遇酸性(CO2、SO2 、H2S 、HCl)变红,
③酚酞在碱性溶液中呈浅红色(8.2<pH<10.0)或红色(pH>10),
④甲基橙在酸性溶液(pH<3.1)中呈红色,
⑤甲基红在酸性溶液(pH<4.4)中呈红色,
⑥pH试纸(黄色)遇酸性溶液(pH<2)变红,
⑦已经被二氧化硫褪色的品红溶液在加热时会出现红色,
⑧C(NaHSO4)>0.001mol/L时遇甲基橙变红。
2、橙色世界
(1)基态:浓溴水 、甲基橙试剂、Br2 (CCl4)呈橙红色。
(2)化学变化:甲基橙在酸性溶液(3.1<pH< 4.4)中呈橙色,甲基红在酸性溶液(4.4<pH< 6.0)中呈橙色。
3、黄色世界
(1)基态:工业盐酸(含有 Fe3+)、Au 、 S8 、N
(2)激发态:钠元素焰色呈黄色
(3)化学变化:
①甲基橙在(pH>4.4)溶液中呈黄色,②久置的浓硝酸因溶有自身分解产生的二氧化氮而变黄
4、绿色世界A
(1)基态:F2 (浅黄绿色)、Cl2 (黄绿色)、Cu 2(OH)2CO3 (绿色)CuCl2(浓溶液呈绿色)、FeSO4(浅绿色)
(2)激发态:铜元素的焰色呈绿色
(3)化学变化:Fe (OH)2 (白色)—— 灰绿色——Fe (OH)3(红棕色)
5、青色世界
(1)基态:铁粉、银粉及大多数金属粉末、石墨、CuO 、 CuS 、Cu2S FeO 、 Fe3O4 、 MnO2
(2)化学变化:
①蔗糖遇浓硫酸被炭化变黑,
②润湿的白色醋酸铅试纸遇H2S变黑,
③硫磺粉与白色的水银反应生成黑红色的HgS,
④H2S通入Pb(NO3)2 、 AgNO3 、 CuSO4溶液产生不溶于水也不溶于稀盐酸和稀硫酸的黑色沉淀。
6、蓝色世界
(1)基态:CuSO4 (溶液)、 CuSO4 ?5H2O (晶体)、液氧、臭氧 a2O2 (淡黄色)、AgBr(淡黄色)、AgI、 Ag3PO4 (2)化学变化:
①紫色石蕊在碱性溶液(pH>8)中变蓝,
②润湿的红色石蕊试纸遇碱性气体变蓝,
③无水 CuSO4 (白色粉末)遇水变蓝,
④H2、H2S 、 CH4 、C2H5OH 燃烧火焰呈淡兰色,CO燃烧火焰呈蓝色,
⑤S8在空气中燃烧呈淡蓝色火焰,在纯氧中燃烧呈现明亮的蓝紫色火焰,
⑥淀粉遇 I2 (aq)变蓝,
⑦Cl2 、 Br2 、 NO2 、O3遇湿润的淀粉碘化钾试纸变蓝
7、紫色世界 ioqasdla吧SL;JD
(1)基态:KMnO4 (H+)、紫色石蕊、碘单质呈紫黑色
(2)激发态:充氩气的灯光呈紫蓝色,钾元素的焰色呈紫色(透过蓝色钴玻璃观察)
(3)化学变化:
①I2 升华生紫烟, ②NH4I受热生紫烟,
③紫色石蕊在(5.0<pH<8.0)溶液中呈紫色,
④锌粉与碘的混合物中滴入水会生紫烟(反应放热使碘升华)
8、白色世界
(1)基态:Pb(蓝白色)、Hg、铝粉、大多数块状金属、 PbSO4 、BaSO4 、AgCl 、BaCO3 、 Ba3(PO4)2 、BaSO3 、CaCO3 、 Fe (OH)2 (不稳定)、 Mg (OH)2 、 Al (OH)3 、 ZnS
(2)化学变化:
①H2在Cl2中燃烧呈现苍白色火焰, ②NH3遇 HCl 产生白烟,
③Mg 、 Al在氧气中燃烧发出耀眼的白光 ④红磷在氯气中燃烧时产生白色烟雾,
⑤红磷在氧气中燃烧时产生白烟。
高中化学元素知识点
(1)金属及其化合物
一、金属的通性
1.金属的物理性质:有金属光泽、有延展性、导电、导热。但不同金属在密度、硬度、熔沸点等方面差别较大。这也是金属单质的一大特点。
2.金属的化学性质:还原性,可表示为M – ne-→Mn+,金属的还原性主要表现在金属能与非金属、水、酸、某些盐发生反应。
4Na + O2 == 2Na2O 2Na + O2 Na2O2
2Na + Cl2 == 2NaCl
二、知识点归纳
(一)钠的化合物
⑴钠的重要化合物

NaHCO3:俗名小苏打,不稳定,加热易分解,在水中溶解度小于Na2CO3,饱和Na2CO3溶液中通入CO2可见沉淀析出
Na2CO3:俗名苏打,纯碱,稳定,加热难分解,晶体Na2CO3?10H2O易风化
NaCl(食盐):存在于海水中
盐类
NaOH:白色固体,易潮解,俗名苛性钠,烧碱
碱
2Na2O2 + 2H2O == 4NaOH + O2↑(漂白剂)
2Na2O2 + 2CO2 == 2Na2CO3 + O2 (供氧剂)
Na2O2:淡黄色固体
Na2O:白色固体,溶于水生成NaOH,不稳定,继续跟O2反应生成淡黄色的Na2O2
氧化物
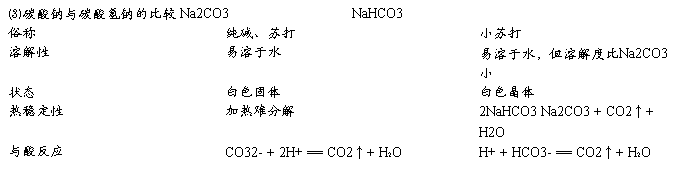
钠的重要化合物
第二篇:高中化学物质颜色总结
高中化学物质颜色总结
(一)红色:Fe(SCN)3(红色);Cu2O(砖红色);Fe2O3(红棕色);红磷(红棕色);液溴(深红棕色);Fe(OH)3(红褐色);Cu(紫红色);溴蒸气、NO2(红棕色);品红溶液(红色);在空气中久置的苯酚(粉红);石蕊在酸性溶液中(红色);酚酞在碱性溶液中(红色)。
(二)棕色;FeCl3固体(棕黄色);CuCl2固体(棕色)。
(三)紫色:石蕊在中性溶液中(紫色);Fe3+与苯酚反应产物(紫色);I2(紫黑色);KMnO4固体(紫黑色);MnO4(紫红色);固态O3(紫黑色);钾的焰色反应(紫色);I2蒸气、I2在非极性溶剂中(紫色)。
(四)蓝色:Cu(OH)2、CuSO4·5H2O、Cu在水溶液中(蓝色);石蕊在碱性溶液中(蓝色);硫、氢气、甲烷、乙醇在空气中燃烧(火焰淡蓝色);一氧化碳在空气中燃烧(蓝色火焰);淀粉遇I2变蓝色;Co2O3(蓝色);O2(液态——淡蓝色);*Cu(OH)2溶于多羟基化合物(如甘油、葡萄糖等)对水溶液中(绛蓝色);O3(气态——淡蓝色;液态——深蓝色;固体——紫黑色)。
(五)橙色:溴水;黄色:Agl(黄色);AgBr(淡黄色);Ag3PO4(黄色);Na2O2(淡
3+黄色);S(黄色);FeS2(黄色);工业浓盐酸(黄色)(含有Fe);FeCl3固体
(棕黄色);Fe3+的水溶液(黄色);硝基苯(黄色)(溶有NO2);Na的焰色反应(黄色);TNT(淡黄色针状);I2的水溶液(黄色);久置的KI溶液(黄色)(被氧化为I2);碘酒(黄褐色);久置的浓硝酸(黄色)(溶有分解生成的NO2);浓硝酸粘到皮肤上(天然蛋白质)(显黄色)
北大清华状元笔记(衡水毕业生)高考手写笔记20xx年x月上旬正式登场,适合20xx年高考生使用,敬请期待!如果你想了解最新高考动态,敬请关注“高考直通车认证空间”腾讯微博@gaokaoge、微信号80796072,每日为您推送最新高考资讯。
(六)黑色:FeO;Fe3O4;FeS;CuO;CuS;Cu2S;MnO2;C粉;Ag2S;Ag2O;PbS。AgCl,AgBr,Agl,AgNO3光照分解变黑。
(七)白色:绝大多数固体物质为白色,AgCl;Ag2CO3;Ag2SO3;BaSO4;BaCO3;Ba3(PO4)2;BaHPO4;CaO;Ca(OH)2;CaCO3;MgO;Mg(OH)2;MgCO3;Fe(OH)2;AgOH;PCl5;三溴苯酚;无水CuSO4;铵盐(白色固体或无色晶体);Fe(OH)2沉淀在空气中的现象;白色→(迅速)灰绿色→(最终)红褐色;pH试纸;干燥时呈黄色;中性时呈淡绿色;酸性时呈红色,酸性越强,红色越深;碱性时呈蓝色,碱性越强,蓝色越深。
2+
-
高中化学物质颜色总结
高中化学物质颜色总结1红色世界1基态Fe2O3红褐色FeOH3红棕色FeSCN2血红色Cu紫红色Cu2O砖红色NO2红棕色P红磷暗…
-
高中化学物质颜色总结
高中化学物质颜色总结20xx-02-1612:15太多了,我都看不下,先弄到空间里先。1、黑色固体:石墨、炭粉、铁粉、FeS、Cu…
-
高中化学常见物质颜色归纳
中学化学常见物质颜色归纳一.常见的物质颜色1.红色部分含三价铁的化合物:Fe(OH)3红褐色(胶体或沉淀),Fe(SCN)n3?n…
-
高中化学物质颜色总结
初中化学常见物质的颜色一固体的颜色1红色固体铜氧化铁2绿色固体碱式碳酸铜3蓝色固体氢氧化铜硫酸铜晶体4紫黑色固体高锰酸钾5淡黄色固…
-
高中化学物质颜色总结
高中化学物质颜色总结1、红色世界(1)基态:Fe2O3(红褐色)、Fe(OH)3(红棕色)、[Fe(SCN)]2+(血红色)、Cu…
-
20xx.3高中化学基础知识专题总结——物质的颜色
20xx.4.26高中化学物质的颜色(每年高考都考)1.红色:Fe(SCN)3(红色溶液)Cu2O(红色固体)Fe2O3(红棕色固…
-
高中化学物质颜色总结
高中化学物质颜色总结20xx-02-1612:15太多了,我都看不下,先弄到空间里先。1、黑色固体:石墨、炭粉、铁粉、FeS、Cu…
-
高中化学常见物质性质小结之颜色篇
常见物质性质小结之颜色篇写在前面曾经有一位学弟朋友问我:“你都高考结束了,还写这些高中的学习资料做什么?”我当时回答他说:“我只不…
-
高中化学物质的颜色总结
化学物质颜色总结1.红色:Fe(SCN)]2+(血红色);Cu2O(砖红色);Fe2O3(红棕色)红磷(红棕色);液溴(深红棕色)…
-
高中化学物质颜色总结
高中化学物质颜色总结(一)红色:Fe(SCN)3(红色);Cu2O(砖红色);Fe2O3(红棕色);红磷(红棕色);液溴(深红棕色…
-
高中化学实验汇总与总结
化学实验中的先与后22例1.加热试管时,应先均匀加热后局部加热。2.用排水法收集气体时,先拿出导管后撤酒精灯。3.制取气体时,先检…