篇三 :产品检验报告要求
产品检验报告要求
产品检验报告没有格式方面的要求。
企业可以提交全性能委托检验报告。 企业也可以提交全性能自测报告,如企业提交的是全性能自检报告,则产品检验报告内容以及资料保存方面的要求如下:
1、 应为产品全性能自检报告。
2、 检验的产品应当具有典型性。
3、 在产品检验报告中逐一列明产品技术要求中的性能指标(标出在
产品技术要求中的序列号,性能指标项目)。
4、 检验结果应记录原始测试数据,并明确检验结论。
5、 应有检验人员的签字。
6、 企业留存所有的原始测试数据备查。
企业提交产品检验报告(包括自测和委托检验)时作如下承诺: 本公司承诺:按如下要求提交了此次申请备案的 (产品名称) 中具典型性的产品的全性能自测报告(全性能委托检验报告)。
国家食品药品监督管理总局《关于第一类医疗器械备案有关事项的公告》(20xx年第26号公告)中,关于“产品检验报告”的相关要求。
…… …… 余下全文
篇六 :包装验证报告
包装确认报告
1 验证目的
本公司生产产品为无菌产品,需要进行灭菌。
双管部分初包装使用三边热封袋。其由杜邦特卫强Tywek1073B热封纸和透明PE/PET复合膜组成。
通过采用目检、微生物检测等方法,证明最终灭菌医疗器械包装的可行性和可靠性,有效地保证产品质量,防止污染。
2 适用范围
本次验证的范围针对双管热封操作人员资格确认、初包装设备确认,产品初包装所用原材料的确认以及初包装工艺的确认。
3 执行文件
3.1 产品标准
3.2设备工装模具和工位器具管理制度
3.3 双管热封工艺
3.4 各项过程记录
a)900型封口机使用记录
b)900型封口机维护保养记录
c)留样观察记录
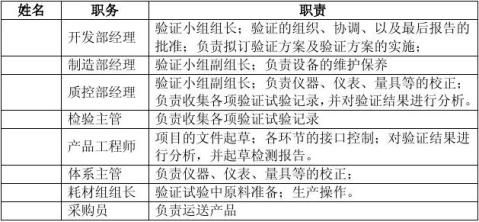
4 验证小组组成及职责
4.1 验证小组人员
表1 验证小组人员组成
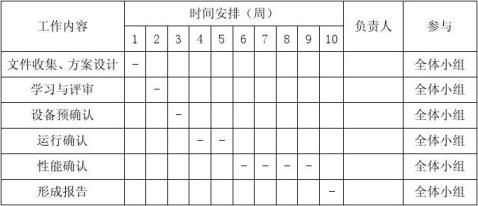
4.2 验证时间安排:
表2 验证时间安排
4.3 人员培训
验证小组通过文件收集、方案设计、学习与评审等活动确定验证方案,并完成技能培训。 5 预确认内容
双管初包装使用三边热封袋,其由杜邦特卫强Tywek1073B热封纸和透明PE/PET复合膜组成。
双管组件公司生产多年,包装经过多年的验证,安全可靠,能够满足临床使用要求。
…… …… 余下全文