篇一 :高中化学方程式总结(免费下载)
高中化学方程式
一、非金属单质(F2,Cl2,O2,S,N2,P,C,Si,H)
1、氧化性:
F2+H2===2HF (阴暗处爆炸)
F2+Xe(过量)==XeF2
2F2(过量)+Xe==XeF4 (XeF4是强氧化剂,能将Mn2+氧化为MnO4–)
nF2+2M===2MFn(M表示大部分金属)
2F2+2H2O===4HF+O2 (水是还原剂)
2F2+2NaOH===2NaF+OF2+H2O
F2+2NaCl===2NaF+Cl2
…… …… 余下全文
篇二 :高中化学方程式总结_高考必备
氯元素
一:氯气的化学性质
1.氯气和金属单质反应(K、Ca、Na、Mg、
Al、Zn、Fe、Cu……)生成高价金属氯化物
 2Fe+3Cl2 2FeCl3
2Fe+3Cl2 2FeCl3
 Cu+Cl2 CuCl2
Cu+Cl2 CuCl2
 2Na+Cl2 2NaCl
2Na+Cl2 2NaCl
2.氯气与非金属单质反应
 H2+Cl2 2HCl
H2+Cl2 2HCl
3.氯气与水反应
 Cl2+H2O HCl+HClO
Cl2+H2O HCl+HClO
…… …… 余下全文
篇三 :(完美版)高中有机化学方程式总结
高中有机化学方程式总结
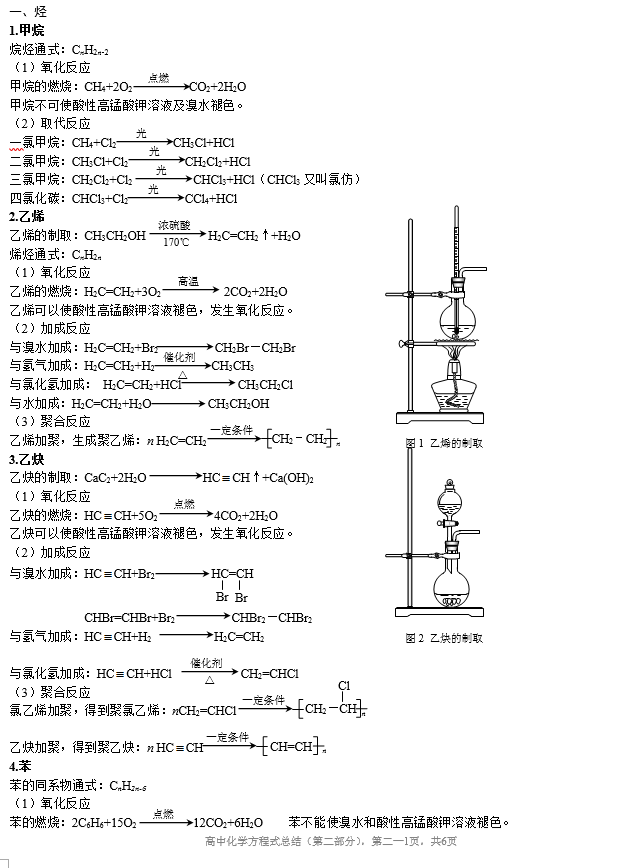
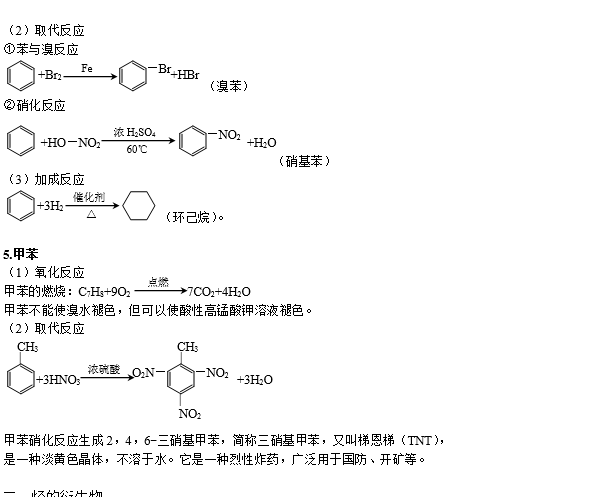
二、烃的衍生物
烃的衍生物的重要类别和主要化学性质:

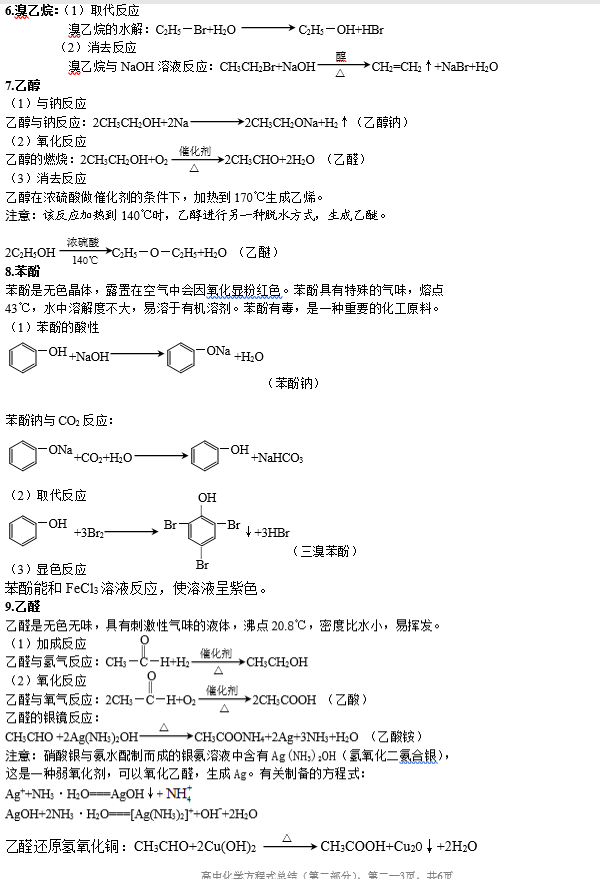
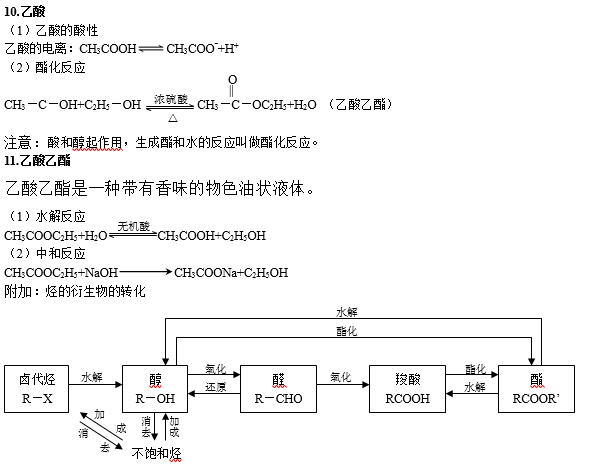
高中有机化学知识点总结
1.需水浴加热的反应有: (1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解 (5)、酚醛树脂的制取(6)固体溶解度的测定 凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
2.需用温度计的实验有: (1)、实验室制乙烯(170℃) (2)、蒸馏 (3)、固体溶解度的测定 (4)、乙酸乙酯的水解(70-80℃) (5)、中和热的测定 (6)制硝基苯(50-60℃) 〔说明〕:(1)凡需要准确控制温度者均需用温度计。(2)注意温度计水银球的位置。
3.能与Na反应的有机物有: 醇、酚、羧酸等——凡含羟基的化合物。
4.能发生银镜反应的物质有: 醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖——凡含醛基的物质。
…… …… 余下全文
篇四 :高中化学方程式总结
高一化学方程式总结
一、碱金属:
1. 新切的钠有银白色光泽,但很快发暗;方程式:4Na+O2=2Na2O;该产物不稳定。
钠在空气中燃烧时,发出黄色的火焰;同时生成淡黄色的固体,
方程式:2Na+O2点燃==== Na2O2。
锂燃烧方程式:4Li+O2点燃==== 2Li2O;
钾燃烧方程式:K+O2点燃==== KO2。
2. 钠与氧气在不点火时平稳反应,硫的化学性质不如氧气活泼,将钠粒与硫粉混合时爆炸,方程式:2Na+S=Na2S
3. 钠与水剧烈反应后滴有酚酞的水变成红色,方程式:2Na+2H2O=2NaOH+H2↑;钾与水反应更剧烈,甚至爆炸,为了安全,常在小烧杯上盖一块小玻璃片。
4. 过氧化钠粉末用脱脂棉包住,
①滴几滴水,脱脂棉燃烧;方程式:2Na2O2+2H2O=4NaOH+O2↑;
②用玻璃管吹气,脱脂棉也燃烧;有关的方程式:2Na2O2+2CO2=2Na2CO3+O2↑;
这两个反应都是放热反应,使脱脂棉达到着火点。在过氧化钠与水或CO2反应生成O2的两个反应中,为生成1mol O2,需要的Na2O2的物质的量都为2mol,同时需要的H2O或CO2的物质的量都为2mol。
…… …… 余下全文
篇五 :高中化学方程式总结 邱威严
高中化学方程式总结
邱威严
注:由于反应条件不方便打出,因此在后面括号标出(未标表示没有条件)
第一部分 无机方程式
1、钠与空气常温下反应
4Na+O2==2Na2O
2、钠再空气中加热(过氧化钠为黄色固体)
2Na+O2==Na2O2(加热或点燃)
3、钠与水反应(现象浮、游、熔、响、红)
2Na+2H2O==2NaOH+H2↑
4、铁与水蒸气反应
3Fe+4H2O(g)==Fe3O4+4H2(加热)
5、铝与氢氧化钠溶液反应
2Al+2NaOH+2H2O==2NaAlO2+3H2↑
2Al+2OH-+2H2O==2AlO-+3H2↑
6、氧化钠与水反应
Na2O+H2O==2NaOH
…… …… 余下全文
篇六 :高中化学反应方程式总结(附解释)
高中化学反应方程式总结(附解释)
化合反应
1、镁在空气中燃烧:2Mg + O2 点燃 2MgO
2、铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
3、铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
4、氢气在空气中燃烧:2H2 + O2 点燃 2H2O
5、红磷在空气中燃烧:4P + 5O2 点燃 2P2O5
6、硫粉在空气中燃烧: S + O2 点燃 SO2
7、碳在氧气中充分燃烧:C + O2 点燃 CO2
8、碳在氧气中不充分燃烧:2C + O2 点燃 2CO
9、二氧化碳通过灼热碳层: C + CO2 高温 2CO
10、一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2
11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO3
12、生石灰溶于水:CaO + H2O === Ca(OH)2
13、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O
14、钠在氯气中燃烧:2Na + Cl2点燃 2NaCl
分解反应
15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑
…… …… 余下全文
篇七 :高中化学必修二方程式总结
高中化学(人教版)必修二相关化学方程式汇总
第一章 物质结构 元素周期律
1、Li与O2反应(点燃): 4Li + O2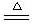 2Li2 O
2Li2 O
Na与O2反应(点燃): 2Na+O2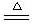 Na2O2
Na2O2
2、卤素单质F2 、Cl2 、Br2 、I2与氢气反应:
F2 + H2 === 2HF Cl2 + H2=== 2HCl
Br2 + H2=== 2Br I2 + H2=== 2HI
3、卤素单质间的置换反应:
(1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:
① Cl2+2NaBr===Br2+2NaCl
② Cl2+2NaI===I2+2NaCl
(2)溴水与碘化钠溶液反应:Br2+2NaI===I2+2NaBr
4、Mg与H2O反应:Mg+2H2O === Mg(OH)2+H2↑
…… …… 余下全文
篇八 :高中化学必修1化学方程式总结
高中化学必修1化学方程式总结
一、钠及其化合物的转化关系
1.钠在空气中燃烧:2Na+O2 Na2O2
Na2O2
2.钠在氧气中燃烧:4Na+O2 2Na2O
2Na2O
3.钠与水反应:2Na+2H2O=2NaOH+H2↑
4.氧化钠与水反应:Na2O+H2O=2NaOH
5.过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑
6.氧化钠与盐酸反应:Na2O+2HCl=2NaCl+H2O
7.钠与盐酸反应:2Na+2HCl=2NaCl+H2↑
8.氧化钠与二氧化碳反应:Na2O+CO2=Na2CO3
…… …… 余下全文