篇一 :产品质量风险评估报告
复方氨酚那敏颗粒
质量风险评估报告
报告起草: 年 月 日
报告审核: 年 月 日
报告批准: 年 月 日
有限公司
二〇##年八月
目 录
1.复方氨酚那敏颗粒注册相关信息…………………………………………1
…… …… 余下全文
篇二 :质量风险评估报告
同仁堂
L-QA-7015-0 第 1 页 共 7 页
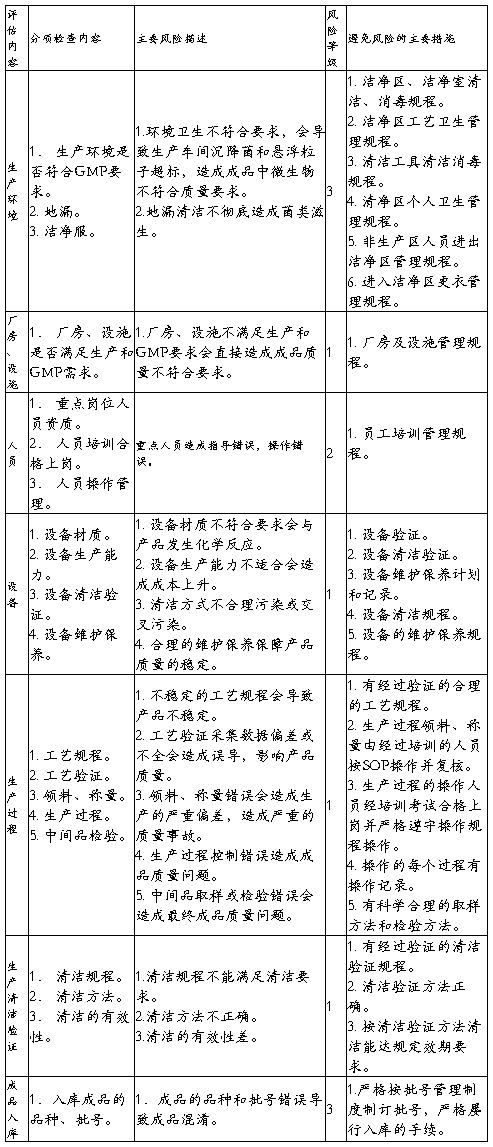
生产质量管理文件
同仁堂
L-QA-7015-0 第 2 页 共 7 页
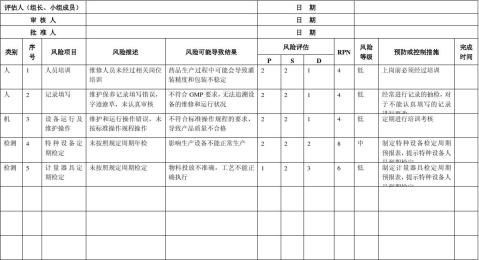
生产质量管理文件
同仁堂
L-QA-7015-0 第 3 页 共 7 页
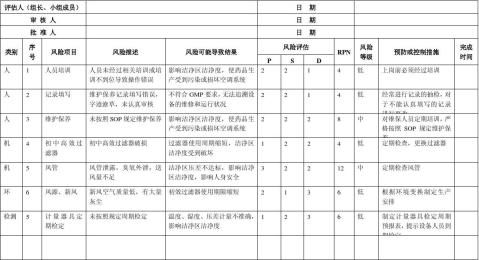
生产质量管理文件
同仁堂
L-QA-7015-0 第 4 页 共 7 页
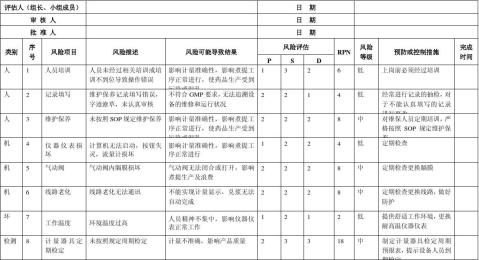
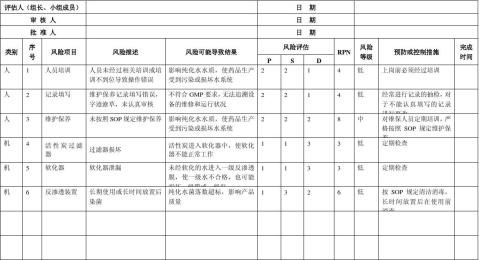
生产质量管理文件
同仁堂
L-QA-7015-0 第 5 页 共 7 页
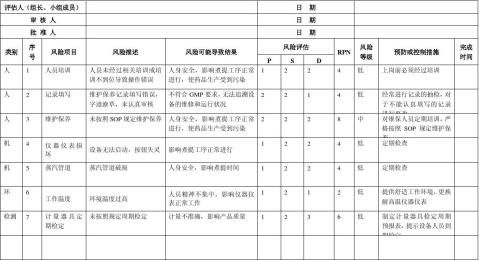
生产质量管理文件
同仁堂
L-QA-7015-0 第 6 页 共 7 页
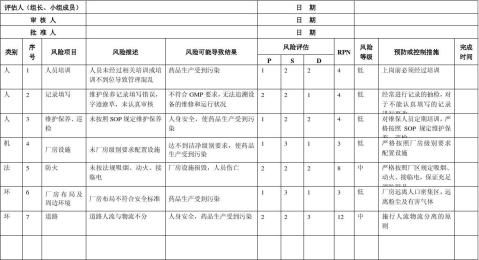
生产质量管理文件
同仁堂
L-QA-7015-0 第 7 页 共 7 页

生产质量管理文件
…… …… 余下全文
篇三 :产品风险评估报告一览表
Department Involved: R&D Department (开发工程)/ Production Department (生产工程)、
Material Control Department (物料部)、Purchasing Department (采购部) 、Quality Department (品管部)
 Prepared by (组织人员) :
Prepared by (组织人员) :
Responsible Engineer (工程师) :
 Date (日期) :
Date (日期) :

Item Name and No. (产品名称/编号) :

 Customer (客户) :
Customer (客户) :
 Age Grade (适应年龄) :
Age Grade (适应年龄) :
 Sale Region (销售地区) :
Sale Region (销售地区) :
(A) Mechanical (物理和机械性)
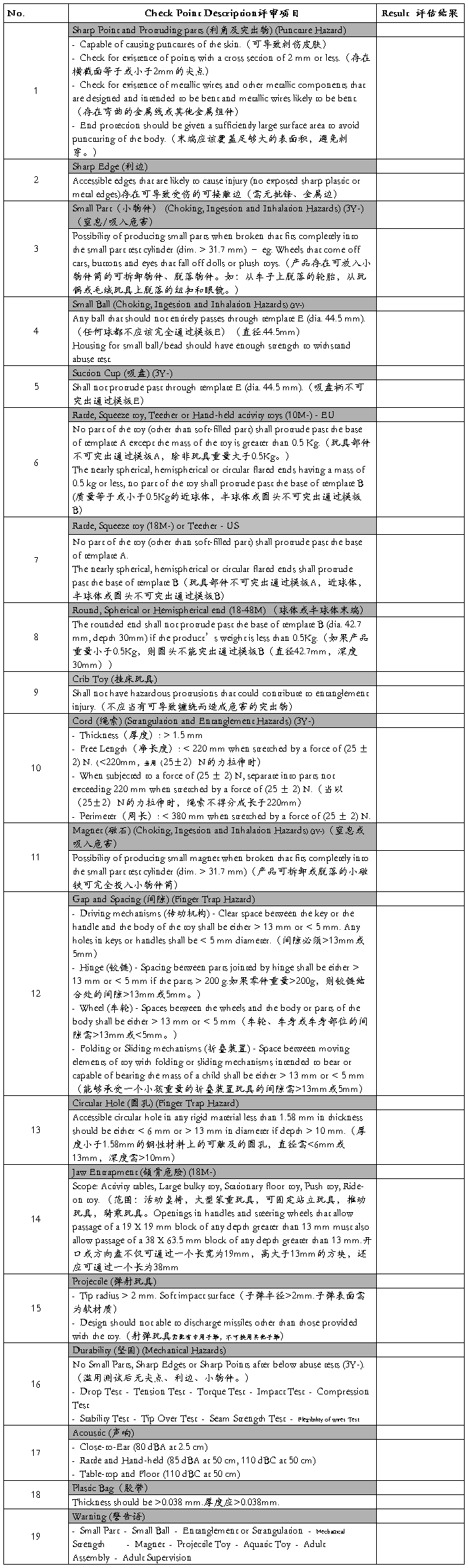
(B) Flammability (易燃性)

(C) Chemical (化学性)
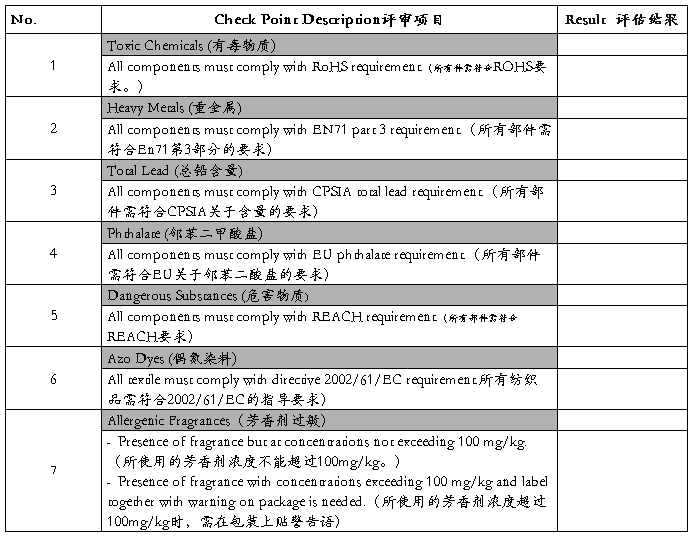
(D) Electric Shock (电气性能)

(E) Radiation (放射性)

(F) hygiene (卫生性)
…… …… 余下全文
篇六 :药品经营企业质量风险评估报告
XXXX医药有限公司
20##年一季度质量风险管理评估报告
报告编制部门:质管部
编制:20##年3月30日
目 录
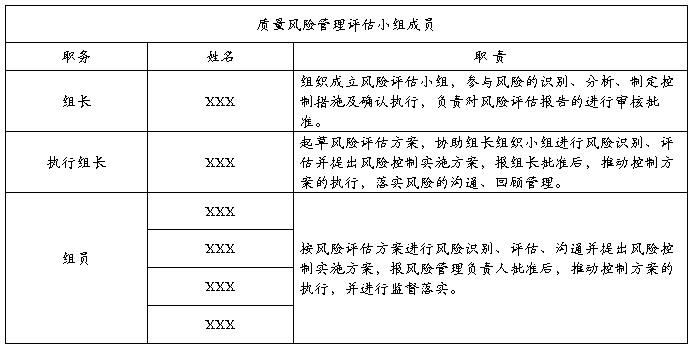
1.风险评估小组成员:
2.概述
2.1公司基本经营情况简介
2.2评估原则
2.3本次风险评估的目的
2.4本次风险评估的范围
3.内容
3.1风险的评价
3.2风险的控制
3.3风险的分析评价结果
4. 做好整改、控制风险
5.风险回顾
6.评估总结与建议
1.风险评估小组成员:
2、概述:
2.1公司基本经营情况简介
公司经营范围包括中药材、中药饮片、中成药、化学原料药、化学药制剂、抗生素制剂、生物制品(除疫苗)、蛋白同化制剂、肽类激素、医疗器械及保健品等6870个品种,20##年销售总额12098万元。
公司秉承“质量缔造品牌 品牌提升效益”的质量方针,依据质量方针,制定年度质量目标并按部门按岗位逐级展开,实行季度考核与年度评比相结合的方式,将质量目标层层落实到各基层岗位。公司董事长(法定代表人)本科学历,从事药品经营管理工作24年;公司质量负责人本科学历,从事药品经营管理工作12年,熟悉药品经营相关法律法规,能够保证质量管理部门有效履行职责;具备丰富的药品质量管理工作经验,能独立履行质量管理职责。
…… …… 余下全文
篇七 :国内著名公司的质量风险评估报告
脂肪乳氨基酸(17)葡萄糖(11%)注射液
无菌保证与细菌内毒素质量风险评估报告
作者:xxx
职务:质量管理与研发高级总监
日期:20xx-7-15
1.简介
脂肪乳氨基酸(17)葡萄糖(11%)注射液,商品名卡文,系由费森尤斯卡比集团公司研制,自2004年起由XX公司进口销售。经费卡董事会批准XX公司接受费卡公司就该产品的技术转移,在XX公司无锡生产基地建造生产线,产品供应中国市场并出口至亚太地区市场。项目分为生产线建设和产品注册两个相互影响的部分。由于国内药品生产注册申请受理前要求必须具备实际的生产线并经验证生产出注册报批样品,在等待审批过程中必然存在生产设备投资的闲置问题。由于生产设施中自动化制袋/灌装/装外袋的设备投资很大,为求得产品注册进展,项目费用、生产能力和市场需求的最优平衡,决定分两个阶段建设生产设施:
第一阶段,2008年实现投资较低的进口成品空袋、半自动灌装,每小时灌装200袋的生产能力,以达到年产100万袋的产能,产品可满足国内市场需求。但其中配制、灭菌、灯检、装箱等设备和公用工程应能为第二阶段每小时900袋的生产能力配套。
…… …… 余下全文