篇一 :化学反应速率 化学平衡实验
实验二十二 化学反应速率 化学平衡
实验日期:__年__月__日 星期:___
[实验用品]
1. 试管、试管架、胶头滴管、NO2平衡仪,
2. 0.01 mol/L KMnO4溶液、0.1 mol/L H2C2O4溶液、0.2 mol/L H2C2O4溶液、3 mol/L H2SO4溶液、0.1 mol/L Na2S2O3溶液、0.1 mol/L H2SO4溶液、3%的H2O2溶液、家用洗涤剂、MnO2粉末、0.1 mol/L K2Cr2O7溶液、浓H2SO4溶液、6 mol/L NaOH溶液、冰水、热水。
[实验操作]
1. 影响化学反应速率的因素
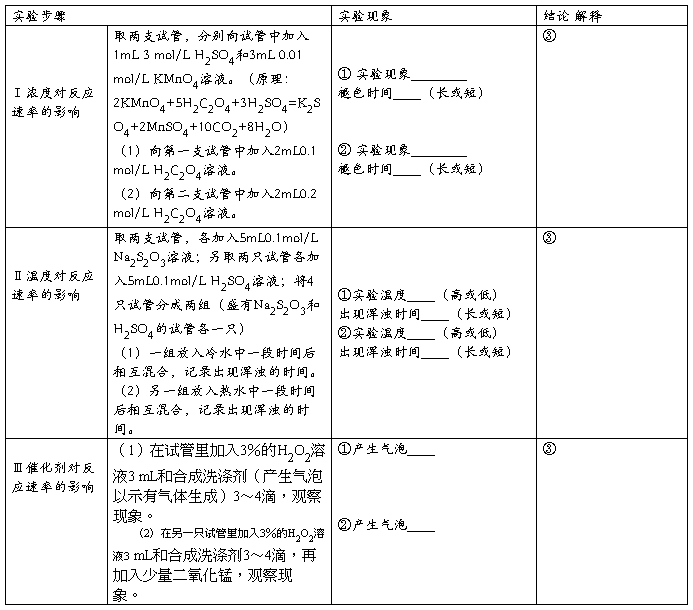
2. 化学平衡的移动

[实验习题]
1.影响化学反应速率的内部因素是____,外部因素有____、____、____、____以及光辐照,放射线辐照,超声波,电弧,强磁场,高速研磨等等。
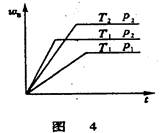 2. 已知某可逆反应aA(气)+bB(气)
2. 已知某可逆反应aA(气)+bB(气) cC(气)+Q在密闭容器中进行,在不同温度(T1和T2)及压强(p1和p2)下,混合气中B的质量分数(wB)与反应时间(t)的关系如图4所示。下列判断正确的是( )。
cC(气)+Q在密闭容器中进行,在不同温度(T1和T2)及压强(p1和p2)下,混合气中B的质量分数(wB)与反应时间(t)的关系如图4所示。下列判断正确的是( )。
…… …… 余下全文
篇二 :酸碱中和滴定、化学反应速率和化学平衡实验报告
酸碱中和滴定实验报告(一)
一:实验目的:用已知浓度溶液(标准溶液)【本实验盐酸为标准溶液】测定未知溶液(待测
溶液) 浓度【本实验氢氧化钠为待测溶液】
二:实验仪器:酸式滴定管、碱式滴定管、锥形瓶、铁架台(含滴定管夹)。
实验药品: 0.1000mol/L盐酸(标准溶液)、未知浓度的NaOH溶液(待测溶液)、
酸碱指示剂:酚酞(变色范围8~10)或者甲基橙(3.1~4.4)
三:实验原理: c(标)×V(标) = c(待)×V(待)【假设反应计量数之比为1:1】
【本实验具体为:c(H+)×V(酸) = c(OH-)×V(碱)】
四:实验过程:
(一)滴定前的准备阶段
1、检漏:检查滴定管是否漏水(具体方法: 酸式滴定管,将滴定管加水,关闭活塞。静止放置5min,看看是否有水漏出。有漏必须在活塞上涂抹凡士林,注意不要涂太多,以免堵住活塞口。 碱式滴定管检漏方法是将滴定管加水,关闭活塞。静止放置5min,看看是否有水漏出。如果有漏,必须更换橡皮管。)
…… …… 余下全文
篇三 :2-实验-化学反应速率和化学平衡
化学20(杭州学军中学陈进前编制)
实验 化学反应速率和化学平衡
[教学目标]
1.知识目标
(1)巩固浓度、温度和催化剂对化学反应速率的影响等基本知识,加深浓度、温度对化学平衡影响等基础知识的理解。
(2)通过实验,体会用定量方法研究化学反应速率、化学平衡规律基本程序,掌握相关的实验操作规范。
(3)掌握“Na2S2O3+H2SO4=Na2SO4+S+H2O、FeCl3+3KSCN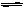 Fe(SCN)3+3KCl”等反应,体会用化学实验研究某个化学反应的一般程序。
Fe(SCN)3+3KCl”等反应,体会用化学实验研究某个化学反应的一般程序。
2.能力和方法目标
(1)定量实验中数据采集、记录和处理方法。
(2)通过从实验现象、实验数据推测理论规律,提高推理分析能力。
3.情感和价值观目标
本实验中的实验现象生动有趣、实验操作简便、推理和分析过程引人入胜,所以可以通过本实验来提高学生学习化学的兴趣,引发学生探究规律、研究自然现象的乐趣。
[实验内容和实验要点]
本学生实验共包含浓度对化学反应速率的影响、温度对化学反应速率的影响、催化剂对化学反应速率的影响、浓度对化学平衡的影响、温度对化学平衡的影响等5个内容,实验过程中既有定性研究要求、又有定量研究要求,要求学生用定性和定量两方面的综合思维来分析和研究。实验中应要求带着研究的观点、在探究的层面上去思考。本实验的各个内容中所涉及的实验技能、实验注意事项等列表如下:
…… …… 余下全文
篇四 :实验报告:影响化学反应速率和化学平衡的因素研究
实验报告:影响化学反应速率和化学平衡的因素的探究
班级: 姓名:
编号1 实验目的:___________________________________________________
实验原理:___________________________________________________

编号2 实验目的:___________________________________________________
实验原理:___________________________________________________

编号3 实验目的:___________________________________________________
实验原理:___________________________________________________
…… …… 余下全文
篇五 :化学反应速率和化学平衡试题综合训练
化学反应速率和化学平衡试题综合训练
1.某一反应在一定条件下的平衡转化率为25.3%,当使用了催化剂时,其转化率为( )
A.大于25.3% B.小于25.3% C.等于25.3% D.约等于25.3%
2.在一定温度下,密闭容器中可逆反应A(g)+3B(g) 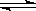 2C(g)达到
2C(g)达到 平衡的标志是( )
平衡的标志是( )
A.C的生成速率与B的反应速率相等
B.单位时间内生成n molA,同时生成3n molB
C.A、B、C的浓度不再变化
D.A、B、C的浓度之 比为1:3:2
比为1:3:2
3.一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图的是( )
A.CO2(g) + 2NH3(g)  CO(NH2)2(s) + H2O(g) △H<0
CO(NH2)2(s) + H2O(g) △H<0
…… …… 余下全文
篇六 :化学反应速率、化学平衡知识点总结及练习
化学反应速率和平化学衡
【命题规律】
化学反应速率和化学平衡是高考的必考内容,其主要命题内容有:①化学反应速率影响因素及计算;②化学平衡状态的判断及影响因素;③应用平衡原理判断反应进行的方向;④化学反应速率和化学平衡的图象分析;⑤转化率、平衡常数的含义及简单计算。
将化学反应速率和化学平衡移动的原理与化工生产、生活实际相结合的题目是最近几年的高考命题的热点。特别是化学平衡常数的影响因素及其计算是新教材增加的内容,应引起同学们的关注 。
【知识网络】




【重点知识梳理】
一 物质状态和浓度对反应速率的影响
1.对于有固体参加的化学反应而言,由于在一定条件下,固体的浓度是固定的,所以固体物质在化学反应中浓度不改变,因此在表示化学反应速率时,不能用固体物质。但因为固体物质的反应是在其表面进行的,故与其表面积有关,当固体颗粒变小时,会增大表面积,加快反应速率。
2.对于有气体参加的反应而言,改变压强,对化学反应速率产生影响的根本原因是引起浓度改变所致。所以,在讨论压强对反应速率的影响时,应区分引起压强改变的原因,这种改变对反应体系的浓度产生何种影响,由此判断出对反应速率产生何种影响。
…… …… 余下全文
篇七 :化学反应速率与化学平衡-学业水平测试
化学反应速率与化学平衡
1、下列做法的目的与反应速率有关的是 ( )
A.用冰箱冷藏食物 B.在糖果制作过程中添加着色剂
C.向食盐中添加碘酸钾 D.在化学反应中加入合适的催化剂
2、在日常生活中,与化学反应速率有关的做法是 ( )
A.用热水溶解蔗糖以加速溶解 B.把块状煤碾成粉状再燃烧
C.真空包装食品以延长保质期 D.低温冷藏使食品延缓变质
…… …… 余下全文
篇八 :化学反应速率和化学平衡阶段质量检测答案
化学反应速率和化学平衡
一、选择题(本题包括16个小题,每小题3分,共48分)
1.解析:在化学反应中加入催化剂能同等程度地改变正、逆反应速率,是因为改变了反应的活化能,使反应速率改变,但不能改变反应的反应热和转化率。
答案:D
2.解析:A、B、D选项都是混乱度增大、熵值增大的过程,ΔS>0。
答案:C
3.解析:四个选项中,只有选项A在任意时刻都会v(正)=v(逆),即反应处于平衡状态。答案:A
4.解析:根据速率比等于化学计量数之比可知:
v(C)=2v(A)=2 mol/(L·min)。
答案:C
5.解析:降温,反应速率降低,平衡左移,A的浓度增加。
答案:D
6.解析:镁在氯气中的燃烧是放热反应,反之则为吸热反应,MgCl2的分解是熵值增大的反应,ΔS>0,A正确;有些吸热反应也可以自发进行,如2N2O5(g)===4NO2(g)+O2(g) ΔH>0,B错误;水在常温常压下电解才能发生分解,即环境对它做功,才能使它发生反应,所以是非自发反应,C错误;MnO2对H2O2的分解起催化剂作用、升高温度也能使反应速率加快,D正确。
…… …… 余下全文