篇一 :氧化还原反应实验报告
实验十二 氧化还原反应
一、实验目的
1. 理解电极电势与氧化还原反应的关系和介质、浓度对氧化还原反应的影响。
2.加深理解氧化态或还原态物质浓度变化对电极电势的影响。
3.进一步理解原电池、电解及电化学腐蚀等基本知识。
[教学重点]
电极电势和氧化还原反应的关系。
[教学难点]
原电池、电解及电化学腐蚀等知识。
[实验用品]
仪器:低压电源、盐桥、伏特计
药品:0.5 mol·L-1Pb(NO3)2、(0.5、1 mol·L-1)CuSO4、0.5 mol·L-1 ZnSO4、
0.1 mol·L-1KI、0.1 mol·L-1FeCl3、0.1 mol.L-1KBr、0.1 mol·L-1FeSO4、(1、3 mol·L-1) H2SO4、6 mol·L-1HAc、(2 mol·L-1、浓)HNO3、(0.01、0.1 mol·L-1)KMnO4、6 mol·L-1NaOH、0.1 mol·L-1K2Cr2O7、饱和KCl、浓NH3·H2O、饱和氯水、I2水、Br2水、CCl4、酚酞溶液、Na2S2O3、红石蕊试纸
…… …… 余下全文
篇二 :氧化还原滴定法和配位滴定法实验自修报告 2
氧化还原滴定法
一、概述
氧化还原滴定法是以氧化还原反应为基础的滴定分析方法。
氧化还原滴定法在药物分析中应用广泛,用于测定具有氧化性和还原性的物质,对不具有氧化性或还原性的物质,可进行间接测定。
氧化还原反应较复杂,常伴有各种副反应,反应速度较慢,因此,氧化还原滴定法要注意选择合适条件使反应能定量、迅速、完全进行.
反应条件:
1. 滴定反应必须按一定的化学反应式定量反应,且反应完全,无副反应。
2. 反应速度必须足够快。
3. 必须有适当的方法确定化学计量点
氧化还原滴定法终点的判断
(一)自身指示剂
如 KMnO4 滴定H2C2O4时, KMnO4 既是标准溶液又是指示剂。
(二)特殊指示剂
如用于碘量法中的淀粉溶液,本身不参与氧化还原反应,但它能与氧化剂作用产生特殊的颜色,因而可指示终点。
(三)氧化还原指示剂
二、高锰酸钾法
(一)基本原理和条件
高锰酸钾法是以具有强氧化能力的高锰酸钾做标准溶液,利用其氧化还原滴定原理来测定其他物质的滴定分析方法。强酸性溶液中:
MnO4- + 8H + + 5e- → Mn2- + 4H2O
…… …… 余下全文
篇三 :氧化还原反应实验报告
氧化还原反应
实验目的:
通过实验掌握氧化还原反应的基本原理,熟悉几种常见的氧化还原反应。
实验原理:
· 物质的氧化还原能力的强弱与物质的本性有关, 氧化还原能力通常根据电对的电极电势的高低来判定。
· 氧化还原反应进行的方向、次序、程度, 可以根据氧化剂和还原剂所对应的电对电极电势的相对大小来判定。
?E = E氧化剂电对电势 - E还原剂电对电势 > 0 反应能自发进行
?E = E氧化剂电对电势 - E还原剂电对电势 = 0 反应处于平衡状态
?E = E氧化剂电对电势 - E还原剂电对电势 < 0 反应不能自发进行
· 氧化还原反应总是优先在电极电势差值最大的两个电对所对应的氧化剂和还原剂之间进行。
· 电极电势差值较小的两个电对所对应的氧化剂和还原剂之间能否进行氧化还原反应,应考虑浓度的影响。
…… …… 余下全文
篇四 :课题_氧化还原反应实验报告
氧化还原反应实验报告
一、实验目的
1.理解电极电势与氧化还原反应的关系和介质、浓度对氧化还原反应的影响。2.加深理解氧化态或还原态物质浓度变化对电极电势的影响。3.进一步理解原电池、电解及电化学腐蚀等基本知识。
[教学重点]电极电势和氧化还原反应的关系。
[教学难点]
原电池、电解及电化学腐蚀等知识。
[实验用品]
仪器:低压电源、盐桥、伏特计
药品:0.5 mol·L-1Pb(NO3)2、(0.5、1mol·L-1)CuSO4、0.5mol·L-1 ZnSO4、
0.1 mol·L-1KI、0.1 mol·L-1FeCl3、0.1 mol.L-1KBr、0.1 mol·L-1FeSO4、(1、3 mol·L-1) H2SO4、6 mol·L-1HAc、(2 mol·L-1、浓)HNO3、(0.01、0.1 mol·L-1)KMnO4、6 mol·L-1NaOH、0.1 mol·L-1K2Cr2O7、饱和KCl、浓NH3·H2O、饱和氯水、I2水、Br2水、CCl4、酚酞溶液、Na2S2O3、红石蕊试纸
…… …… 余下全文
篇五 :氧化还原与电化学实验报告
氧化还原与电化学实验报告

一、实验目的
二、实验原理
三、预习思考题
1.为什么KMnO4能氧化盐酸中的Cl-,而不能氧化氯化钠溶液中的Cl-?
2. 为什么H2O2既具有氧化性,又具有还原性?试从电极电势予以说明。
3. 若用适量氯水分别与溴化钾、碘化钾溶液反应并加入CCl4,估计CCl4层的颜色。
四、实验内容

五、实验心得和建议
…… …… 余下全文
篇六 :南京市雨花台中学氧化还原反应实验报告
实验十二 氧化还原反应
.一、实验目的
1. .理解电极电势与氧化还.原反应的关系和介质、浓度对氧化还原反应的影响。2.加深理解氧化态或还原态物质浓度变化对电.极电势的影响。 3.进一步理解原.电池、电解及电化学腐蚀等基本知识。
.[教学重点]
电极电势和氧化还原反应的关系。
.[教学难点]
.原电池、电.解及电化.学腐蚀等知识。
.[实验用品]
.仪器:低压电源、盐桥、伏特计
.药品:0.5 mol·L-1Pb(NO3)2、(0.5、1 mol·L-1)CuSO4、0.5 mol·L-1 ZnSO4、
0.1 mol·L-1KI、0.1 mol·.L-1FeCl3、0.1 mol.L-1KBr、0..1 mol·L-1FeSO4、(1、3 mol·L-1) H2SO4、6 .mol·L-1HAc、(2. mol·L-1、浓)HNO3、(0.01、0.1 mol·L-1)KMnO4、6 mol·L-1NaOH、0.1 mol·L-1K2.Cr2O7、饱和KCl、浓NH3·H2O、饱和氯水、I2水、Br2水、CCl4、酚酞溶液、Na2S2O3、红石蕊试纸
材料:导线、砂纸、电极(铁钉、铜片、锌片、碳棒)
…… …… 余下全文
篇七 :【实验】一氧化碳还原氧化铁实验
【实验】一氧化碳还原氧化铁实验
实验原理:
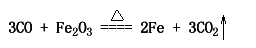
仪器试剂:

实验操作:
1、按下图组装仪器,并检查其密性
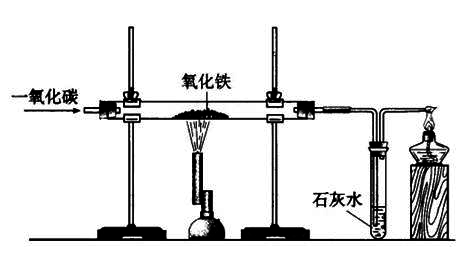
2、把少量研细的氧化铁粉末装进硬质玻管中,轻轻转动,使氧化铁粉末均匀地附在玻璃管内壁上
3、把硬质玻管接入装置系统中,现通入一氧化碳气体排气;待排尽后,点燃出气口处的酒精灯及酒精喷灯,并观察装置中所发生的变化
4、当红棕色粉末已转变成黑色后,停止加热,再通一会儿一氧化碳,直至玻璃管冷却
实验现象:
红棕色的氧化铁粉末逐渐变成黑色,同时澄清的石灰水逐渐变浑浊
注意问题:
1、一氧化碳还原氧化铁是在封闭的硬质玻管中进行的,先通一氧化碳,可以把管内的空气排出,防止一氧化碳与空气混合受热爆炸
2、一氧化碳应预先制备好,放在贮气瓶内,也可以球胆代替贮气瓶
实验改进:
可将上述装置除尾气的部分,改成用气球收集,这样收集得到的未燃一氧化碳气体可重复利用
…… …… 余下全文
