初中化学方程式默写(总结)
初中化学方程式总汇
一.物质与氧气的反应:
(1)单质与氧气的反应:
1. 镁在空气中燃烧: )
2. 铁在氧气中燃烧:( )
3. 铜在空气中受热:( )
4. 氢气中空气中燃烧:( )
6. 红磷在空气中燃烧:( )
7. 硫粉在空气中燃烧:
8. 碳在氧气中充分燃烧:
9.
(2)化合物与氧气的反应:
10. 一氧化碳在氧气中燃烧:11. 甲烷在空气中燃烧:12. 酒精在空气中燃烧:13. 葡萄糖缓慢氧化:二.几个分解反应:
14. 电解水:15. 氯酸钾制氧气:16. 加热高锰酸钾:17. 碳酸不稳定而分解:18. 高温煅烧石灰石:三.几个氧化还原反应:
19. 氢气还原氧化铜:20. 木炭还原氧化铜:21. 焦炭还原氧化铁:22. 一氧化碳还原氧化铜:23. 一氧化碳还原氧化铁:
四.单质、氧化物、酸、碱、盐的相互关系
(1)金属单质 + 酸 -------- 盐 + 氢气 (置换反应)
24. 锌和稀硫酸:25. 铁和稀硫酸:26. 镁和稀硫酸:
27. 铝和稀硫酸:
28. 锌和稀盐酸:29. 铁和稀盐酸:30. 镁和稀盐酸:
31. 铝和稀盐酸:
(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐
32. 铁和硫酸铜溶液反应:33. 铝和硫酸铜溶液反应:
34. 铜和硝酸银溶液反应:
(3)金属氧化物 +酸 -------- 盐 + 水 ) ) )
35. 氧化铁和稀盐酸反应:
36. 氧化铁和稀硫酸反应:
37. 氧化铜和稀盐酸反应:38. 氧化铜和稀硫酸反应:39. 氧化镁和稀硫酸反应:40. 氧化钙和稀盐酸反应:(4)非金属氧化物 +碱 -------- 盐 + 水
41.苛性钠暴露在空气中变质:42.苛性钠吸收二氧化硫气体:43.苛性钠吸收三氧化硫气体:44.消石灰放在空气中变质:(5)酸 + 碱 -------- 盐 + 水
45.盐酸和烧碱起反应:
46.盐酸和氢氧化铜反应:47. 盐酸和氢氧化钙反应:48. 盐酸和氢氧化铁反应:49. 氢氧化铝药物治疗胃酸过多:50. 硫酸和烧碱反应:51. 硫酸和氢氧化钾反应:
52. 硫酸和氢氧化铜反应:53. 硫酸和氢氧化铁反应:54. 硝酸和烧碱反应:
(6)酸 + 盐 -------- 另一种酸 + 另一种盐
55.大理石与稀盐酸反应:56.碳酸钠与稀盐酸反应:
57.盐酸和硝酸银溶液反应:58. 硫酸和碳酸钠反应:
59. 硫酸和氯化钡溶液反应:
(7)碱 + 盐 -------- 另一种碱 + 另一种盐
60.氢氧化钠与硫酸铜:
61.氢氧化钠与氯化铁:62.氢氧化钠与氯化镁:63. 氢氧化钠与氯化铜:
64. 氢氧化钙与碳酸钠:
65.熟石灰和氯化铵反应:
(8)盐 + 盐 ----- 两种新盐
66.氯化钠溶液和硝酸银溶液:67.硫酸钠和氯化钡:五.其它反应:
68.二氧化碳溶解于水:69.生石灰溶于水:70. 光合作用:
第二篇:初中化学方程式(上册总结)
一.初中化学方程式(上册)注:按照教材上出现的顺序编写
1.碳酸氢铵受热分解: 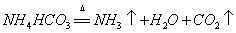
2.二氧化硫使高锰酸钾溶液褪色: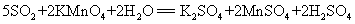
3.石蜡在氧气中燃烧: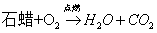
现象:(1)火焰明亮发出白光(2)放出热量(3)烧杯壁出现水雾(4)生成一种能使澄清石灰水变浑浊的气体
4.碳在氧气中燃烧: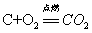
现象:(1)发出白光(2)放出热量(3)生成一种能使澄清石灰水变浑浊的气体
5.氯化氢气体和氨气混合(浓盐酸和浓氨水反应): 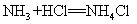
6.碘化钾与硝酸银反应: 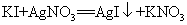
7.铜绿(碱式碳酸铜)与盐酸反应: 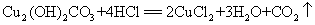
现象:(1)绿色粉末逐渐溶解(2)有气泡产生(3)溶解后液体呈蓝绿色
8.铜绿(碱式碳酸铜)受热分解: 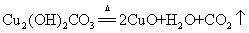
现象:(1)绿色粉末变成黑色(2)试管内壁有水珠生成(3)澄清石灰水变浑浊
9.镁带在空气氧气中燃烧: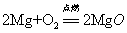
现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末
10.铜丝加热: 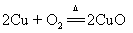
11.红磷白磷在氧气中燃烧(研究空气组成的实验):
现象:(1)发出白光(2)放出热量(3)生成大量白烟
12.硫在空气氧气中燃烧:
现象:A、在纯的氧气中燃烧 (1)发出明亮的蓝紫火焰(2)放出热量(3)生成一种有刺激性气味的气体
B、在空气中燃烧 (1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体
13.铁丝在氧气中燃烧: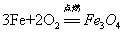
现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体
14.加热高锰酸钾(实验室制氧气原理1):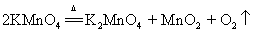
15.过氧化氢在二氧化锰作催化剂条件下分解(实验室制氧气原理2):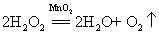
16.植物的光合作用文字表达式: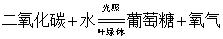
17.二氧化碳与水反应: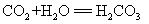
18.碳酸不稳定分解: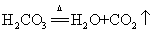
19.大理石和稀盐酸(实验室制二氧化碳原理):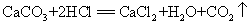
20. 二氧化碳使澄清石灰水变浑浊(鉴别二氧化碳气体):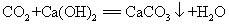
21. 生石灰和水反应: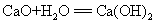
22. 电解水实验(研究水的组成实验):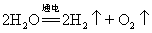
23.氢气和氧气点燃: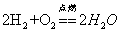
现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁出现水雾
24.甲烷在空气中燃烧: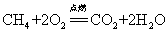
25.乙炔在空气中燃烧: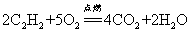
26.碳与氧气反应: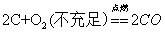
27.一氧化碳点燃:
现象:(1)发出蓝色的火焰(2)放热(3)澄清石灰水变浑浊
28.硫酸铜与氢氧化钠反应: 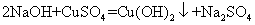
29.玻义耳研究空气的成分实验:氧化汞分解 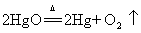 汞加热
汞加热 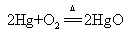
30.铝在空气中形成氧化膜: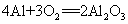
31.锌与盐酸反应: 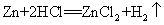
32.氯酸钾用二氧化锰做催化剂分解制氧气(实验室制氧气原理):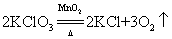
33.氯化铁与氢氧化钠反应: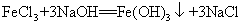
34.电解氯化镁: 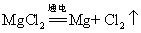
35.锌与稀硫酸反应: 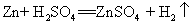
36.石灰石浆吸收废气中的二氧化硫: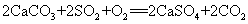
37.乙醇(酒精)在空气中燃烧: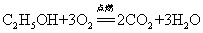
38.氢气还原氧化铜: 
39.镁在二氧化碳中燃烧: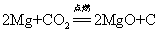
40.高温煅烧石灰石(工业制取二氧化碳原理):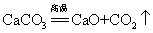
41.碳酸钠和稀盐酸反应(灭火器原理):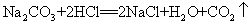
42.铁和盐酸反应: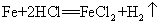
43.铁和稀硫酸反应: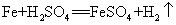
44.铝和盐酸反应: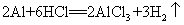
45.铝和稀硫酸: 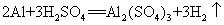
46.锌和盐酸的反应: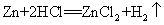
47.锌和稀硫酸反应(实验室制氢气原理)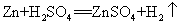
48.铁和硫酸铜溶液反应(湿法炼铜原理):
现象:(1)铁表面覆盖一层红色的物质(2)溶液由蓝色变成浅绿色
49.一氧化碳还原氧化铁: (高炉炼铁原理):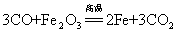
现象:(1)红色粉未变成黑色(2)澄清石灰水变浑浊
50.电解铝: 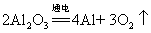
51.碳还原二氧化碳: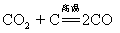
52.锌和硫酸铜溶液反应: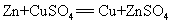
53.氧化铜与稀硫酸反应: 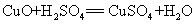
54.焦炭还原氧化铁: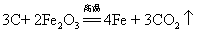
55.用盐酸除去铁锈: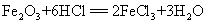
二.常见元素的化合价口诀:
一价氢氯钾钠银, 二价氧钙镁钡锌, 三铝四硅五价磷; 二三铁, 二四碳,
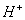


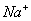
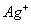

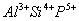
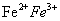
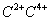
二四六硫, 三五氮; 铜汞二价最常见(一五七氯常常见) 单质零价永不变。
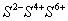
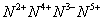
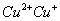
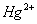
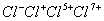
负一硝酸氢氧根 负二硫酸碳酸根 负三记住磷酸根 正一价的是铵根
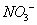
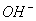
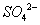
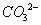
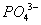

三.常见物质的颜色、气味等:
红色:红P、Cu、Fe2O3
红褐色:Fe(OH)3
浅绿色:Fe2+盐的溶液
黄色:S、Fe3+盐的溶液
绿色:Cu2(OH)2CO3
紫黑色:KMnO4晶体
蓝色:Cu(OH)2、CuCO3、CuSO4·5H2O、Cu2+盐的溶液
紫红色:KMnO4溶液
黑色:C、Fe粉、CuO、MnO2、Fe3O4
白色:BaSO4、AgCl、MgO、P2O5、CaO、NaOH、Ca(OH)2、CaCO3、
KClO3、KCl、NaCl、BaCO3、CuSO4、Na2CO3
无色气体:空气、O2、H2、CO2、CO、CH4、N2、SO2
刺激性气味气体:SO2、HCl、HNO3等
无色透明:金刚石、干冰以及大部分酸、碱、盐的溶液和酒精、乙酸的溶液
四.金属活动性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
───────────────────────→
金属活动性由强逐渐减弱
小结:1、只有排在H前面的金属才能置换出酸里的氢
2、只有排在前面的金属才能将排在后面的金属从它的盐溶液中置换出来
五.物质的化学名称、俗名和化学式
汞(水银)Hg 硫(硫磺)S 氧化钙(生石灰)CaO
氯化钠(食盐)NaCl 固体二氧化碳(干冰) 氧化铁(铁锈的主要成分)
氧化铁(铁锈的主要成分)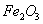
碳酸钙(大理石、石灰石、方解石)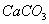 碱式碳酸铜(铜绿、孔雀石)
碱式碳酸铜(铜绿、孔雀石)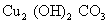
甲烷(沼气)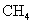 乙醇(酒精)
乙醇(酒精)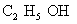 乙酸(醋酸)
乙酸(醋酸)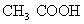
碳酸钠(纯碱) 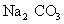 硫酸铜晶体(蓝矾、胆矾)
硫酸铜晶体(蓝矾、胆矾)
氢氧化钠(烧碱、火碱、苛性钠)NaOH 氢氧化钙(熟石灰、消石灰)
水煤气:氢气和一氧化碳的混合物 爆鸣气:氢气和氧气的混合物
碳酸钠 (苏打、纯碱) 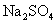 碳酸氢钠 (小苏打、重碱 )
碳酸氢钠 (小苏打、重碱 ) 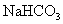
硫代硫酸钠 (大苏打、海波) 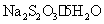 硫酸铝钾 (明矾)
硫酸铝钾 (明矾) 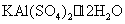
重铬酸钾 (红矾) 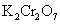 碳酸钾 (钾碱、草碱、草木灰)
碳酸钾 (钾碱、草碱、草木灰) 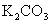
硫酸钙 (生石膏、石膏 )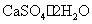 硫酸钙 (熟石膏、烧石膏)
硫酸钙 (熟石膏、烧石膏) 
-
申报技师、高级技师编写总结、论文的要求
申报技师、高级技师编写技术总结、论文的要求1.总结、论文的题目和内容应与所申报的工种有关。如申报的是“钻探灌浆工”就不能写防渗墙方…
-
关于如何写总结的总结
20xx-07-03改变自己#周日每周多做点总结#彭萦邀请了一个神秘嘉宾来讲写工作总结的高深学问...他口述彭萦笔录的。(是有多大…
-
如何写总结和调查报告
ZTE(H.K)LIMITEDETHIOPIANBRANCH6/F,SevitaBuilding,BoleRoad,AddisAb…
-
如何写总结材料
撰写总结材料经验交流会发言提纲一、开场语寒暄,客套话。二、需要清楚的几个概念(一)什么是总结:人们对某一阶段或某项工作的回顾、分析…
-
怎么写总结
一、总结概论总结是对已经做过的工作进行理性的思考。它要回顾的是过去做了些什么,如何做的,做得怎么样。总结与计划是相辅相成的,要以计…
-
怎么写总结
一、总结概论总结是对已经做过的工作进行理性的思考。它要回顾的是过去做了些什么,如何做的,做得怎么样。总结与计划是相辅相成的,要以计…
-
如何写总结材料
撰写总结材料经验交流会发言提纲一、开场语寒暄,客套话。二、需要清楚的几个概念(一)什么是总结:人们对某一阶段或某项工作的回顾、分析…
-
如何写总结和调查报告
ZTE(H.K)LIMITEDETHIOPIANBRANCH6/F,SevitaBuilding,BoleRoad,AddisAb…
-
关于如何写总结的总结
20xx-07-03改变自己#周日每周多做点总结#彭萦邀请了一个神秘嘉宾来讲写工作总结的高深学问...他口述彭萦笔录的。(是有多大…
-
申报技师、高级技师编写总结、论文的要求
申报技师、高级技师编写技术总结、论文的要求1.总结、论文的题目和内容应与所申报的工种有关。如申报的是“钻探灌浆工”就不能写防渗墙方…
-
扶贫开发工作总结
xxx县二00四年扶贫开发工作总结20xx年,我县的扶贫开发工作在县委、县政府的正确领导下,在省、市扶贫部门的大力支持下,认真贯彻…