河南实验高一化学必修二期中考试总结.doc
化学练习
2013.05.16
一、选择题:在下列四个选项中,只有一个选项符合题意(每题3分共54分)
1.下列关于化学反应限度的说法正确的是 ( )
A.改变外界条件不能改变化学反应的限度
B.当某反应在一定条件下达到反应限度时即达到了化学平衡状态
C.当某反应达到限度时,反应物的浓度和生成物的浓度一定相等
D.对于吸热反应,升高温度能增大正反应速率,降低逆反应速率
2、19世纪中叶,门捷列夫的突出贡献是 ( )
A.提出原子学 B.提出分子学说 C.发明元素周期表 D.提出电离学说
3、下列各组物质中,互为同位素的是 ( )
A.12C和14C B.O2和O3 C.NO和NO2 D.16O2和18O2
4、在元素周期表中金属元素与非金属元素的分界线附近的一些元素能用于制取 ( )
A.合金 B.半导体 C.催化剂 D.农药
5、下列说法错误的是 ( )
A 元素的种类由核内质子数决定 B 原子的种类由核内质子数和中子数共同决定
C 分子的种类由分子的组成决定 D 原子的质量主要由原子核中质子和中子决定
6、下列有关阳离子的说法中错误的是 ( )
①阳离子都是由金属原子失去电子而形成的②非金属原子也能形成阳离子
③含阳离子的物质一定含有阴离子 ④阳离子都是稳定结构,不会再失去电子
A ①②④ B ②③④ C ①②③ D ①③④
7、对于A2 + 3B2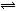 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是 ( )
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是 ( )
A、v(B2) =0.8mol/(L?s); B、v(A2) =0.4mol/(L?s);
C、v(C) =0.6mol/(L?s); D、v(B2) =4.2mol/(L?min)。
8、元素性质呈周期性变化的根本原因是 ( )
A 核外电子排布呈周期性变化 B 元素的相对原子质量逐渐增大
C 核电荷数逐渐增大 D 元素化合价呈周期性变化
9、下列粒子的结构示意图中,表示硫离子的是 ( )

10、下列物质中,只含有共价键的化合物是 ( )
A.NH4Cl B.N2 C.CO2 D.MgCl2
11.化学反应进行的快慢常用“化学反应速率”这一物理量来描述,关于化学反应速率的理解正确的是
A.化学反应速率指反应物浓度的减少值
B.化学反应速率指生成物浓度的增加值
C.化学反应速率指反应物浓度的减少值或生成物浓度的增加值
 D.化学反应速率指单位时间内反应物或生成物浓度的变化值
D.化学反应速率指单位时间内反应物或生成物浓度的变化值
12.对于可逆反应M + 3N 2Q 达到平衡时,下列说法正确的是 ( )
A.M、N、Q三种物质的浓度一定相等 B.M、N全部变成了Q
C.反应混合物各组分的浓度不再变化 D.反应已经停止
13、下列各组物质的性质比较,正确的是 ( )
A.酸性:HClO4>H3PO4>H2SO4 B.氢化物稳定性:H2S>HF>H2O
C.碱性:Al(OH)3 >Mg(OH)2>NaOH D.氧化性:F2 > Cl2 > Br2 > I2
14、若用X代表F、Cl、Br、I四种卤族元素,下列属于它们共性反应的是 ( )
A X2+H2=2HX B X2+H2O=HX+HXO
C 2Fe+3X2=2FeX3 D X2+2NaOH=NaX+NaXO+H2O
15、有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极 ②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D ③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡 ④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为 ( )
A.A>B>C>D B.C>A>B>D C.A>C>D>B D.B>D>C>A
16.在N2 + 3H2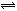 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6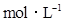 ,在此时间内用NH3表示的反应速率为0.3
,在此时间内用NH3表示的反应速率为0.3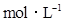 ·S-1。则此一段时间是: ( )
·S-1。则此一段时间是: ( )
A.1秒 B.2秒 C.0.44秒 D.1.33秒
17、下列说法正确的是 ( )
A.需要加热才能发生的反应一定是吸热反应
B.在甲烷燃烧反应中,化学能只转化为热能
C.旧化学键断裂吸收的能量与新化学键形成所释放的能量的相对大小决定了反应是放热还是吸热
D.吸热反应在常温下不能发生
18、下列各个装置中能组成原电池的是 ( )
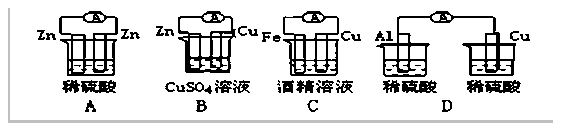
二、非选择题(五大题,共46分)
19、(16分)根据你的观察和积累的知识,试填写:
(1)、下列反应中属于放热反应的是 属于吸热反应的是 。(4分)
①煅烧石灰石 ②木炭燃烧 ③炸药爆炸 ④酸碱中和 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)、下列物质中①Ar ②CO2 ③SiO2 ④NaOH ⑤K2S ,只存在共价键的是 ;只存在离子键的是 ;既存在共价键又存在离子键的是 ;不存在化学键的是 。(4分)
(3)、写出下列物质的电子式:(4分)
Na2O2 : CO2 :
(4)用电子式写出下列物质的形成过程:(4分)
HCl:
 CaBr
2:
CaBr
2:
 20.(1)(4分) 对于反应2SO
2 +O
2
20.(1)(4分) 对于反应2SO
2 +O
2
 2SO
3 其它条件不变,只改变一个反应条件,将生成SO
3的反应速率的变化填入表中空格里 。(填字母 A.增大 B.减小 C.不变)
2SO
3 其它条件不变,只改变一个反应条件,将生成SO
3的反应速率的变化填入表中空格里 。(填字母 A.增大 B.减小 C.不变)

21、(10分)(1)A元素原子M电子层上有6个电子,B元素与A元素的原子核外电子层数相同,B元素的原子最外层电子数为1。
①A元素在周期表中的位置 ,B元素在周期表中的位置
②A元素的氢化物与其同主族上一周期C元素的氢化物相比较熔点高的是 (用化学式表示);原因是:
(2)An+、B(n+1)+、Cn-、D(n+1)-四种离子,具有相同的电子层结构,这四种离子按离子半径从大到小的排列顺序是 ;这四种元素的中性原子按原子半径从大到小的排列顺序是 。
22、(9分)下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:

(1)11种元素中,化学性质最不活泼的是________。
(2)①②⑤中,最高价氧化物对应的水化物碱性最强的是________。
(3) 元素⑦的氢化物分子式为________,该氢化物常温下和元素②的单质反应的离子方程式是__________________________________________________,
(4)①和⑨两元素形成化合物的化学式为___,该化合物灼烧时焰色为________,
(5)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为 。
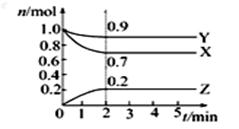 23. (7分)某温度时,在一个2 L的密闭容器中,X、Y、Z三种
23. (7分)某温度时,在一个2 L的密闭容器中,X、Y、Z三种
气体物质的物质的量随时间的变化曲线如图所示。根据图中
数据,试填写下列空白:
(1)该反应第 ______ 分钟到达平衡状态,X所占的体积分数为 _______ 。
(2)该反应的化学方程式为 ________ 。
(3)反应开始至2 min,气体X的平均反应速率为 _______。
第二篇:高一数学期中考试总结
高一数学期中考试总结与反思
期中考试已结束,回顾这次考试,总体感觉还凑合,下面就这一次考试对教与学作一下总结与反思。
一、 工作中的亮点:
我们工作中的亮点如果说有的话那应该是:学案、习题的编写:俗话说人多力量大,集体的力量总是很强大的,本学期的学案、限时练、综合题我们都进行了统一的分配,充分发挥集体的力量,让每一个老师都参与编写,编写后的学案、习题再由我们强大的后盾支撑孙光明老师审核定稿,然后把定好的稿打印出来每人一份,我们老师再集体做,对学案或习题中存在的问题我们再商讨最终定稿,一份我们认为比较好的学案或习题才算完成。
二、存在的主要问题:
1、 对学生还不够严格要求,学生的行为和学习习惯有待提高。班中总有那些学习数
学主动性不大的学生,作为教师在这方面抓得还不够。
2、 教师上课讲得太多,学生练得太少。虽然有时想让学生多动手,课堂上以学生为
主,但有时由于学生的基础较差,有时为了赶进度等等一些原因使得很多时候仍然采用老的教学模式,课堂效率不够好。
3、 教师课后反思不够。我们常有这样的困惑:有些习题不仅是讲了,而且是讲了多
遍,可是学生的解题能力就是得不到提高!也常听见学生这样的埋怨:巩固题做了好多遍,成绩却迟迟得不到提高!这应该引起我们的反思了。诚然,出现上述情况涉及方方面面,然而很多时候给学生思考的空间太小,教师包办的太多 。
4、 学生基本功不够扎实,学习困难学生较多,信心不足。教师在对学习困难学生的
个别辅导上还做得不够,以至于这次的普通生的差距会那么大。
三、改进措施:
(一)、对学生严格要求,培养良好的学习习惯和学习方法。
有些学生有不好的学习习惯,例如作业字迹潦草,不写解答过程;不课堂上不喜欢主动回答问题;不会总结规律;对学习马虎大意,过分自信等。作为任科教师指导他们预习和复习,强调总结的重要性,并有一些具体的做法,如整理错题集,总结做题规律等。使学生慢慢地建立起好的学习方法和认真的学习态度。
(二)、加强教师自身和学生的反思。古人云:“亲其师,才能信其道”。增加自己课堂的魅力,吸引孩子主动参与。做到精讲少讲,充分的相信学生,让学生真正为自己在学,真正地参与到数学的学习中来。
(三)、加强学生基础知识的训练,做到“小步子、快反馈”,把握好重难点,对每一节的重点和基础知识要反复训练,加强课堂练习和反馈,重视试卷的评析和订正。加强对学习困难学生的辅导工作,多让困难学生提问、板演,给予他们更多的关心,让他们体验到成功的喜悦。加强对尖子学生的综合能力的训练,多给他们准备一些综合习题,开阔他们的视野,提高他们的应变能力。
-
高二化学期中考试工作总结
高二化学期中考试工作总结一试题分析高二化学考试内容为选修四第一章第二章内容主要考查了化学反应与能量变化热化学方程式的书写盖斯定律的…
-
高二化学下期期中考试总结
高二下学期期中考试试卷分析及考试总结高二化学考试过去了,每个人在这次考试中都有所收获,有成功的经验也有失败的教训,重要的是我们从中…
-
高二化学期中考试总结
一、指导思想:本次月考考试出题基于反映高二化学新课程教学的执行实际情况,为高二年级指导新课程教学提供参考依据;指导教师和学生在实践…
-
高二化学组期中考试试卷分析
高二化学组期中考试试卷分析高二化学组一试卷出题范围本卷主要考查有机化学基础中第一章有机化合物的结构与性质烃第二章有机化学反应类型和…
-
高二化学期中考试复习提纲
高二化学期中考试复习提纲一请写出下列化学反应方程式1氰酸铵转化为尿素2乙烯与溴水反应3乙烯与溴化氢反应4丙烯与溴水反应5丙烯与溴化…
-
高一化学期中考质量分析
高一年段化学学科质量分析【试卷特点】这次期中考试,范围是苏教版必修1的专题一《化学家眼中的物质世界》。题型是单项选择题30题,每题…
-
高一化学备课组前半学期工作总结及期中考试试卷分析20xx
高一化学备课组前半学期工作总结及期中考试试卷分析20xx.11.18一、期中考试总结本次期中考试范围为《化学》必修一第一章、第二章…
-
高一化学期中考试知识点总结
一二章知识点总结考点一:钠及其化合物1.物理性质:例1:将一小块钠投入到盛有煤油和水的试管中(煤油和水均足量多),试推测可以观察到…
-
高一化学必修1上学期期中知识点总结
三、离子检验离子所加试剂现象离子方程式Cl-AgNO3、稀HNO3产生白色沉淀Cl-+Ag+=AgCl↓SO42-稀HCl、BaC…
-
高二化学期中考试工作总结
高二化学期中考试工作总结一试题分析高二化学考试内容为选修四第一章第二章内容主要考查了化学反应与能量变化热化学方程式的书写盖斯定律的…
-
南雄市第一小学主管教学副校长在期中考试总结表彰会上的讲话zjx
渭阳九年制学校主管教学副校长在开学典礼总结表彰会上的讲话主讲:张有雄时间:20xx年x月729日星期五尊敬的各位老师,同学们,大家…