离子方程式的书写总结
常见离子方程式总结
1.Na+ H2O: 2Na+ 2H2O= 2Na++2OH-+H2↑
2.Cl2+ H2O: Cl2+ H2O= H+ +Cl- +HClO
3.Na2O2+ H2O: 2Na2O2+ 2H2O=4Na++4OH-+ O2↑
4.MnO2+HCl: MnO2+4 H++2Cl-=Mn2++ Cl2↑+ 2H2O
+5. Cu+HNO3(稀): 3Cu+8H+2NO3-=3Cu2+2NO↑+4 H2O
++-6. FeCl3+SO2+H2O: 2Fe3+ SO2+2H2O=2Fe2+ SO42+4H+
7.KIO3+KI+CH3COOH: IO3-+5I-+6CH3COOH=I2+6CH3COO-+3 H2O
+8. FeCl3+沸水: Fe3+3 H2O(沸水)= Fe(OH)3(胶体)+3 H+
9.C6H5ONa+ CO2: C6H5O-+ H2O +CO2= C6H5OH+HCO3-
+10. Fe+HNO3(稀,不足): 3Fe+8H++2NO3-=3 Fe 2+2NO↑+4 H2O
+11. Fe+HNO3(稀,过量): Fe+4H++NO3-= Fe 3+NO↑+2 H2O
+-+-12. FeBr2+Cl2(过量): 2Fe 2+4Br+3Cl2 = 2Fe 3+2Br2+ 6Cl
++-13. FeBr2+Cl2(不足): 2Fe 2+Cl2=2Fe 3+ 2Cl
--14.Ca(ClO)2+ SO2+H2O: ClO+ SO2+H2O= HClO+ SO42+H+
15.Mg(HCO3)2+ Ca(OH)2: Mg2++2HCO3-+ 2Ca2++4OH-= Mg(OH)2↓+ CaCO3↓+2 H2O
--16. NH4HCO3+ NaOH(过量): NH4++ HCO3+2OH-=NH3·H2O+ CO32+H2O
17. AlCl3+过量氨水: Al3+ +3NH3·H2O=Al(OH)3↓+3NH4+
18.NaHCO3+ Ca(OH)2(不足): 2 HCO3-+ Ca 2++2OH-= CaCO3↓+2 H2O+ CO32- NaHCO3+ Ca(OH)2(过量): HCO3-+ Ca 2++OH-= CaCO3↓+ H2O
19.NaHSO4+ Ba(OH)2(呈中性): 2 H++2 OH-+ SO42-+ Ba2+= BaSO4↓+2 H2O NaHSO4+ Ba(OH)2(恰好沉淀): H++ OH-+ SO42-+ Ba2+= BaSO4↓+ H2O
20.NH4HSO4+ Ba(OH)2(等物质的量): NH4++ H++ SO42-+ Ba2++2 OH-= BaSO4↓+2 H2O NH4HSO4+ Ba(OH)2(物质的量之比2:1):2 H++ SO42-+ Ba2++2 OH-= BaSO4↓+2 H2O
21.Ca(OH)2+ CO2(不足): Ca 2++ 2 OH- +CO2= CaCO3↓+ H2O Ca(OH)2+ CO2(过量) OH- +CO2= HCO3-
22. NaOH+ CO2(不足): 2 OH- +CO2= CO32-+ H2O NaOH+ CO2(过量): OH- +CO2= HCO3-
23. AlCl3+ NaOH(不足): Al3++3 OH- = Al(OH)3↓ AlCl3+ NaOH(过量): Al3++4 OH-= AlO2-+2 H2O
24. NaAlO2+ HCl (不足): AlO2-+H+ + H2O= Al(OH)3↓ NaAlO2+ HCl (过量): AlO2-+4H+= 4 Al3++2 H2O
25. Na2CO3+ HCl(不足): CO32-+H+= HCO3-
Na2CO3+ HCl(过量): CO32-+2H+= CO2+ H2O
26. Ca(ClO)2+ CO2(不足)+H2O Ca 2++2 ClO-+ CO2+ H2O= CaCO3↓+2HClO Ca(ClO)2+ CO2(过量)+H2O ClO-+ 2CO2+ 2H2O= 2HCO3-+2H ClO
27. Ca(ClO)2+ SO2+H2O Ca 2++2 ClO-+ SO2+ H2O= CaSO4↓+HClO+H ++Cl-
28. KAl(SO4)2+ Ba(OH)2(沉淀的物质的量最大):
2 Al3++3 SO42-+3 Ba2++6 OH-=3 BaSO4↓+2 Al(OH)3↓ KAl(SO4)2+ Ba(OH)2(沉淀的质量最大):
Al3++2 SO42-+2 Ba2++4OH-=2BaSO4↓+AlO2-+2 H2O
29. Ca(HCO3)2+ NaOH(不足): Ca 2++ HCO3-+ OH-= CaCO3↓+ H2O Ca(HCO3)2+ NaOH(过量): Ca 2++ 2HCO3-+ 2OH-= CaCO3↓+ 2H2O+ CO32-
第二篇:离子反应方程式的总结
离子反应和离子方程式
(一)离子反应
1、离子反应的概念
在反应中有离子参加或有离子生成的反应称为离子反应。在中学阶段仅限于在溶液中进行的反应,可以说离子反应是指在水溶液中有电解质参加的一类反应。因为电解质在水溶液里发生的反应,其实质是该电解质电离出的离子在水溶液中的反应。
2、离子反应的特点
离子反应的反应速率快,相应离子间的反应不受其它离子的干扰。
3、离子反应的类型
(1)离子互换反应 在溶液中酸、碱、盐之间互相交换离子的反应,一般为非氧化还原反应。
(2)离子互换反应发生的条件
①生成难溶的物质。如生成BaSO4、AgCl、CaCO3等。
②生成难电离的物质。如生成CH3COOH、H2O、NH3·H2O、HClO等。
③生成挥发性物质。如生成CO2、SO2、H2S等。
只要具备上述三个条件中的一个,离子互换反应即可发生。这是由于溶液中离子间相互作用生成难溶物质、难电离物质、易挥发物质时,都可使溶液中某几种、自由移动离子浓度减小的缘故。若不能使某几种自由移动离子浓度减小时,则该离子反应不能发生。如KNO3溶液与NaCl溶液混合后,因无难溶物质、难电离物质、易挥发物质生成,Na+、 Cl-、K+、NO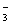 浓度都不减少,四种离子共存于溶液中,故不能发生离子反应。
浓度都不减少,四种离子共存于溶液中,故不能发生离子反应。
(3)有离子参加的氧化还原反应
①置换反应的离子反应 金属单质与金属阳离子之间的置换反应,如Fe与CuSO4溶液的反应,实际上是Fe与Cu2+之间的置换反应。非金属单质与非金属阴离子之间的置换反应,如Cl2与NaBr溶液的反应,实际上是Cl2与Br-之间的置换反应。
②其它一些有离子参加的氧化还原反应 如MnO2与浓HCl反应制取Cl2;Cu与FeCl3溶液反应生成FeCl2、CuCl2;Cl2与NaOH溶液反应生成NaCl、NaClO和水等。
这些离子反应发生的条件是:比较强的氧化剂和较强的还原剂反应,生成氧化性较弱的氧化产物和还原性较弱的还原产物。因此掌握一些常见离子的氧化性或还原性的相对强弱,是判断这一类离子反应能否发生的重要依据。
(二)离子方程式
1、离子方程式的概念
用实际参加反应的离子符号来表示离子反应的式子叫做离子方程式。
2、离子方程式的特点
离子方程式不仅表示一定物质间的某个反应,而且还表示所有同一类型的离子反应。如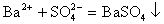 ,不仅表示BaCl2溶液与Na2SO4溶液之间的反应,还表示所有可溶性钡盐与可溶性硫酸盐溶液的反应。
,不仅表示BaCl2溶液与Na2SO4溶液之间的反应,还表示所有可溶性钡盐与可溶性硫酸盐溶液的反应。
3、书写离子方程式的四个步骤
(1)写——根据客观事实,写出正确的化学方程式。
(2)拆——把易溶于水且易电离的物质写成离子形式,把难溶于水的物质或难电离的物质以及气体、单质、氧化物仍用分子式表示。对于难溶于水但易溶于酸的物质,如CaCO3、FeS、Cu(OH)2、Mg(OH)2等仍写成分子式。
(3)消——对方程式的两边都有的相同离子,把其中不参加反应的离子,应“按数”消掉。
(4)查——检查写出的离子方程式是否符合前三项的要求,并检查是否符合质量守恒、是否符合电荷守恒。
4、书写离子方程式时应注意的几个问题
(1)注意哪些物质是难溶于水的物质,哪些物质是易溶于水的,哪些物质是微溶于水的。
在写离子方程式时难溶于水的物质必须用分子式表示,不能写成离子形式。
对于微溶物的处理,有以下三种情况:
①在生成物中有微溶物析出时,应用分子式表示。如Na2SO4浓溶液与CaCl2浓溶液反应时,其离子方程式为:
②当反应物中有微溶物并且处于澄清状态时,应将微溶物写成离子形式。如在澄清的石灰水中通入适量CO2,其离子方程式为:
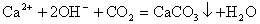
③当反应物中有微溶物,且处于悬浊液或固态时,应将微溶物写成分子式。如在石灰乳中加入Na2CO3浓溶液,其离子方程式为:
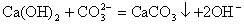
(2)注意哪些物质是强电解质,在溶液中是易电离的;哪些物质是弱电解质,在溶液中是难电离的。
常见的弱电解质有:HF、HClO、H2S、CH3COOH等弱酸;H2SO3、H2PO4等中强酸;NH3·H2O等弱碱;还有水也是弱电解质。
在写离子方程式时,难电离的物质应写成分子式。如醋酸与NaOH溶液反应的离子方程式为: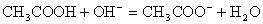 。
。
氢硫酸与硫酸铜溶液反应的离子方程式为: 。
。
(3)注意反应是否在溶液中进行。
离子方程式只能用来表示电解质在溶液中进行的反应,不是在溶液中进行的反应,一般不用离子方程式表示。如氯化铵固体与熟石灰固体之间经加热生成氨气的反应,就不能用离子方程式表示,只能用化学方程式表示:
2NH4Cl+Ca(OH)2 CaCl2+2NH3
CaCl2+2NH3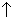 +2H2O
+2H2O
而NH4Cl溶液与NaOH溶液混合加热的反应,就可以用离子方程式表示:
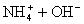

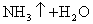
(4)注意浓酸中水的含量
浓H2SO4的浓度一般为98%,水的含量很少,其溶质基本上以硫酸分子的形式存在,所以有浓硫酸参加的一些反应,可以认为不是在溶液中进行的反应。如NaCl固体与浓硫酸、Cu与浓硫酸的反应,一般不用离子方程式表示,只能用化学方程式表示:
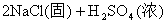

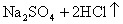
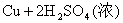

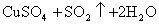
浓盐酸的浓度一般为36%,浓硝酸的浓度一般为69%,它们溶液中的溶质几乎完全以离子形式存在,所以在离子方程式中,浓HCl与浓HNO3都应写成离子形式。如:
MnO2与浓盐酸共热制取Cl2的离子方程式为:
MnO2 + 4H+ + 2Cl- Mn2+ + Cl2
Mn2+ + Cl2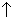 + 2H2O
+ 2H2O
Cu与浓硝酸反应的离子方程式为:
Cu + 4H+ + 2NO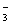 =Cu2+ + 2NO2
=Cu2+ + 2NO2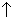 + 2H2O
+ 2H2O
Cu与稀硝酸反应的离子方程式为:
3Cu + 8H+ + 2NO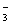 =3Cu2++2NO
=3Cu2++2NO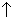 +4H2O
+4H2O
(5)注意电荷是否守恒
一个正确的离子方程式,不仅要遵循质量守恒,还要遵循电荷守恒。即反应前后各元素的原子个数要相等,方程式两边离子所带电荷也应相等。如Cl2与FeBr2反应的离子方程式,若写成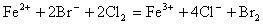 就错了。虽然反应前后各元素原子个数相等,但两边电荷数不等,因而是错误的。正确的写法是:
就错了。虽然反应前后各元素原子个数相等,但两边电荷数不等,因而是错误的。正确的写法是:
2Fe2+ +4Br-+3Cl2=2Fe3++6Cl-+2Br2。
(6)注意溶液中溶质电离出的阴离子和阳离子配比数是否正确
有些离子方程式中离子数不能任意约减,要注意电解质电离时阴、阳离子的配比。如:H2SO4与Ba(OH)2溶液反应的离子方程式,应当是

而不应写成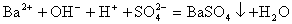 ,因为Ba(OH)2 电离时,电离出的
,因为Ba(OH)2 电离时,电离出的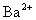 与
与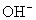 物质的量之比为1∶2而不是1∶1;H2SO4电离出的H+与SO
物质的量之比为1∶2而不是1∶1;H2SO4电离出的H+与SO 物质的量之比为2∶1而不是1∶1。
物质的量之比为2∶1而不是1∶1。
(7)注意有水参加的反应
在许多离子反应中,水是一种反应物,书写离子方程式时一定要注意这一隐含因素。如Ca(ClO)2溶液中通入CO2的离子方程式为:
Ca2++2ClO-+CO2+H2O = CaCO3 +2HClO
+2HClO
又如往溴水中通入SO2气的离子方程式为:
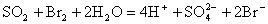
5、判断离子方程式正误的主要内容
(1)看反应能否写离子方程式。
(2)看“==”、“ ”、“
”、“ ”、“
”、“ ”及必要的反应条件是否正确、齐全。
”及必要的反应条件是否正确、齐全。
(3)看表示各物质的化学式是否正确。如HCO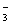 不能写成H++CO
不能写成H++CO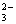 ,而HSO
,而HSO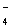 通常应写成H++SO
通常应写成H++SO 等。该用离子表示的是否拆成了离子,该用分子式表示的是否写成了分子式。
等。该用离子表示的是否拆成了离子,该用分子式表示的是否写成了分子式。
(4)看产物是否符合事实。如H2S与FeCl3反应生成FeCl2、S和HCl,而不生成FeS。
(5)看是否漏掉离子反应。如Ba(OH)2溶液与CuSO4溶液反应,既要写Ba2+与SO 生成BaSO4的反应,又不能漏掉Cu2+与OH-生成Cu(OH)2的反应。
生成BaSO4的反应,又不能漏掉Cu2+与OH-生成Cu(OH)2的反应。
此外,还要检查是否符合质量守恒、电荷守恒;检查反应物或生成物的配比是否正确。
(三)关于溶液中离子共存问题
在溶液中离子共存问题的实质是哪些离子之间不能发生反应。能够发生反应的离子就不能共存,不能发生反应的离子才可以共存。
1、在溶液中某些离子间能互相反应生成难溶性物质时,这些离子就不能大量共存。如SO 与Ba2+、Pb2+、Ag+;OH-与Cu2+、Fe3+、Mg3+、Al3+、Zn2+;Ag+与Cl-、Br-、I-、CO
与Ba2+、Pb2+、Ag+;OH-与Cu2+、Fe3+、Mg3+、Al3+、Zn2+;Ag+与Cl-、Br-、I-、CO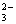 、SO
、SO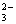 、S2-;Mg2+、Ca2+、Ba2+2+2+2+222+、与CO
、S2-;Mg2+、Ca2+、Ba2+2+2+2+222+、与CO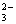 、SO
、SO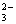 、PO
、PO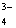 ;S2-与Cu2+、Pb2+等,不能大量共存。
;S2-与Cu2+、Pb2+等,不能大量共存。
2、离子间能结合生成难电离物质时,则这些离子不能大量共存。如H+与、OH-、ClO-、CH3COO-、HPO 、H2PO
、H2PO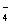 ;OH-与HCO
;OH-与HCO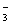 、HS-、HSO
、HS-、HSO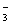 、H2PO
、H2PO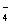 、HPO
、HPO 、H+等不能大量共存。
、H+等不能大量共存。
3、离子间能结合生成挥发性物质时,则这些离子不能大量共存。如H+与CO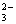 、SO
、SO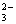 、HCO
、HCO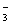 、HSO
、HSO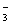 、S2-、HS-;OH-与NH
、S2-、HS-;OH-与NH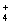 等不能大量共存。
等不能大量共存。
4、离子之间能发生氧化还原反应时,则这些离子不能大量共存。一般说来,有氧化性的离子(如MnO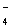 、ClO-、Fe3+、NO
、ClO-、Fe3+、NO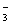 等)与有还原性的离子(如S2-、I-、Br-、SO
等)与有还原性的离子(如S2-、I-、Br-、SO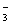 、Cl-、Fe2+等)不能大量共存。
、Cl-、Fe2+等)不能大量共存。
5、注意以下几种情况
(1)在有H+存在的情况下,MnO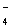 、ClO-、NO
、ClO-、NO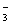 的氧化性会增强。如Fe2+、Na+、NO
的氧化性会增强。如Fe2+、Na+、NO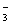 可以共存;但Fe2+、H+、NO
可以共存;但Fe2+、H+、NO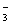 不能共存,Fe2+被氧化成Fe3+。
不能共存,Fe2+被氧化成Fe3+。
(2)Fe2+与Fe3+可以共存,因为它们之间不存在中间价态。
(3)Fe3+不能氧化Cl-。NO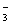 (有H+时)不能氧化Cl-.
(有H+时)不能氧化Cl-.
(4)还应注意题目是否给出溶液的酸碱性,是否给定溶液是无色的。在酸性溶液中除题给离子外,还应有大量H+;在碱性溶液中除题给离子外,还应有大量OH-。若给定溶液为无色时,则应排除Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄棕色)、MnO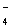 (紫色)。
(紫色)。
第三篇:工作总结结尾怎么写,工作总结结尾10则例文
工作总结结尾怎么写,工作总结结尾10则例文
好的工作总结结尾对一篇工作总结来说是锦上添花的作用。
工作总结结尾格式/怎么写
一篇好的个人工作总结,除了要有非常充实的内容、准确无误的、清晰明了的条理之外,还要有一个好的开头与结尾。好的工作总结结尾,可以给读者留下深刻的印象,让人回味无穷。工作总结结尾是整篇文章的收尾,最好能与总结开头相呼应,详略得当,篇幅不宜太长。
怎样写好工作总结的结尾?
结尾的方式可以是在总结教训的基础上,提出今后努力方向,或认识自己的不足,提出改进意见,也可以表明决心、展望前景。
第一种:结尾提出今后努力方向。
在工作总结结尾的写法当中,提出今后努力方向是最为常见的一种,就是在总结的结尾表明心迹,给阅读者留下印象。
例如,常见的办公室个人工作总结的结尾如下:在今后的工作中,我将不断加强个人修养,努力学习,努力提高工作能力,适应新形势下本职工作的需要,扬长避短,发奋工作,克难攻坚,力求把工作做得更好,树立办公室的良好形象。
第二种:认识自己的不足,提出改进意见。
例如,常见的银行人员工作总结结尾:回顾过去一年的工作,虽然取得了不少的成绩,但我仍感自己有不少不足之处:
1、只是满足自身任务的完成,工作开拓不够大胆等;
2、业务素质提高不够快速,对新业务知识仍然学习得不够多,不够透彻;
3、本职工作与其他同行相比还有差距,创新意识不强。
在以后的工作中,请大家给予我监督与建议,我将努力改进自己的不足,争取获得更好的成绩。
第三种:表明决心、展望前景。
例如:以上是我个人20xx年年度工作总结,俗话说:"点点滴滴,造就不凡",在以后的工作中,不管工作室枯燥的还是多彩多姿的,我都要不断积累经验,与各位同事一起共同努力,勤奋的工作,刻苦的学习,努力提高素质和各种工作技能,为了单位的做出最大的贡献。
工作总结结尾例文
例文一
充分发挥政协的独特优势,切实做好各项联谊工作。加强联谊交往,增强人民政协的凝聚力,要充分发挥人民政协作为最广泛的爱国统一战线组织的作用,求同存异,把不同党派、不同阶层、不同民族、不同信仰的人在爱国主义和社会主义的旗帜下团结起来,团结一切可以团结的力量,在实现祖国统一和振兴中华的大目标下凝聚起来,努力增进全县人民的大团结、大联合。进一步加强海内外联谊,多渠道、多形式地做好对外联系工作。广交新朋友,不忘老朋友,为不断扩大我县最广泛的爱国统一战线作贡献。充分发挥政协的特点和优势,不断开辟、拓宽对外开放的新渠道、新领域,为我县经济发展和社会进步做出新成绩。
例文二
我们三位老师也经过了从生疏到磨合再到心领神会的转变过程,大家鼎力配合、和谐相处,从孩子们身上,我们也学到了很多,他们稚嫩的心灵,他们活跃的思维,他们调皮的表情,曾经有过多少次的感动、惊喜与微笑,就像"猜猜我有多爱你"那样,我们
竭尽全力爱孩子们,孩子们同样用最大的进步来回报,为你们开心、为你们骄傲、为你们喝彩,为我们美好的幼儿园生活加油!在接下来的工作中,我们会做好xx年上半年工作总结及计划,争取将工作做到更好。
例文三
近半年的工作中,我通过实践学到了许多房地产的相关知识,通过不断的学习逐步提高了自己的业务水平。但是作为新人,我深深知道,自己经验还是相对欠缺的,需要不断的学习和磨练。因此,在新的一年里,我希望通过到销售第一线的不断学习和实践,做好个人工作计划,在现场不断增加自己的经验和见识,争取使自己的业务水平提到一个更高的高度,为公司多做贡献。
例文四
探索创新是青年人应有的职责,也是社会向高层次发展的必由之路。我顺应时代付于给我们的历史重任,做好人事年度工作计划,参与人事电脑操作培训,勇于在人事工作方面多使用现代化的武器,不断寻找能人事工作的科学性和规范性,力求能在人事的工作领域寻找出一点有价值的东西。
总之,我无愧于一个人民教师,共 产 党员的光荣称号,无愧于学校领导所委托的重任。
例文五
总之,在过去的一年里,在厂党政领导以及各部门的大力支持下,经过全体人员共同努力,基本上按计划完成了工作任务。尽管取得了一些成绩,但我们深知,办公室工作没有止境,如何更好地树立窗口形象,更好地发挥协调与服务职能,更好地开拓创新和持续发展,仍然是我们今后在工作中需要不断思考的问题。我们深感重任在肩,不敢有丝毫懈怠。
例文六
在接下来的学期,工作中必然免不了有些挫折和缺陷,但我会尽力做好每一件事情,不断完善自己。如果同学们对我的工作有什么不满意的地方,也希望同学们帮我指正,让我们一起把工作做到最好,让我们每个人都拥有一个健康的心灵。
例文七
教育需要无私奉献,管理需要不断创新。让我在反思与展望中以更好的姿态投入崭新的XX年。相信在新一年的工作中,我会取得更大的成绩!
例文八
展望20xx年,我将在中心和报社领导的决策和带领下,继续努力、扎实工作、务实开拓、奋发进取,围绕新一年的中心工作思路和报社工作重点,与各位同事团结一心,***合作,争取在新的一年取得新的更大的成绩,更希望推动报社乃至中心工作在新的一年取得更大发展。
例文九
在这一年的工作中,我以一名党员和教师的双重标准严格要求自己,得到了学校领导,教师们及学生们的好评。但是,检查起来,所存在的缺点毛病也是不少的,还需今后努力改正。主要缺点还有以下几个方面:一是理论知识的学习还是欠缺,还存在有懒惰思想;二是工作虽然很努力,可是个人能力还有待提高,学生成绩进步太慢。今后,我一定在校领导及全体同志们的帮助下,加强学习,提高工作能力,使自己的思想和工作都能更上一个台阶!
例文十
在以后的岁月里,我的工作一定会越来越努力的,尽量不会出现任何的差错,这对我是必须要要求的,我对自己的要求是最严格的,一定要做到为公司的事业尽出自己最
大的努力!
-
工作总结结尾怎么写,工作总结结尾10则例文
工作总结结尾怎么写工作总结结尾10则例文好的工作总结结尾对一篇工作总结来说是锦上添花的作用工作总结结尾格式怎么写一篇好的个人工作总…
-
个人工作总结范文怎么写
个人工作总结范文怎么写20xx年我坚持以xx重要思想和科学发展观为指导认真学习xx大xx届x中全会精神在各级领导的带领下认真完成了…
-
工作总结结尾怎么写及范例
工作总结结尾怎么写及范例写文章就要兼顾开头和结尾工作总结的写作也是这样的有一个好的开头和充实无误的内容之后一个好的结尾同样必不可少…
-
如何写好年度工作总结范文提纲
如何写好年度工作总结范文提纲总结的写法工作进行到一定阶段或告一段落时需要回过头来对所做的事情认真地分析研究一下肯定成绩找出问题归纳…
-
怎么写工作总结_工作总结范文2
财务工作总结在上级财务部门的业务指导下以年初支公司提出的工作思路为指导以提高企业效益为核心以增强企业综合竞争力为目标以成本治理和资…
-
怎么写总结
一、总结概论总结是对已经做过的工作进行理性的思考。它要回顾的是过去做了些什么,如何做的,做得怎么样。总结与计划是相辅相成的,要以计…
-
如何写总结材料
撰写总结材料经验交流会发言提纲一、开场语寒暄,客套话。二、需要清楚的几个概念(一)什么是总结:人们对某一阶段或某项工作的回顾、分析…
-
如何写总结和调查报告
ZTE(H.K)LIMITEDETHIOPIANBRANCH6/F,SevitaBuilding,BoleRoad,AddisAb…
-
关于如何写总结的总结
20xx-07-03改变自己#周日每周多做点总结#彭萦邀请了一个神秘嘉宾来讲写工作总结的高深学问...他口述彭萦笔录的。(是有多大…
-
申报技师、高级技师编写总结、论文的要求
申报技师、高级技师编写技术总结、论文的要求1.总结、论文的题目和内容应与所申报的工种有关。如申报的是“钻探灌浆工”就不能写防渗墙方…