超详细人教版必修一化学第三章金属及其化合物化学方程式总结
第三章金属及其化合物方程式总结
----------加粗的是对应的离子方程式
1.金属钠的化学性质:
钠露置空气中变暗:4Na+O2=2Na2O(白色)
钠的燃烧:2Na+O2 Na2O2(淡黄色)
Na2O2(淡黄色)
反应条件不同,产物不同
钠投入水中:2Na+2H2O=2NaOH+H2↑ 2Na+2H2O=2Na++2OH–+H2↑
(现象:浮、融、游、响、红)
钠与盐酸(先酸后水):2Na+ 2HCl===2NaCl+H2↑ 2Na+ 2H+===2Na++H2↑
钠与硫酸铜溶液(先水后盐):2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑(总式)
2Na+2H2O=2NaOH+H2↑ 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
2.氧化钠的化学性质:
氧化钠与水:Na2O+H2O=2NaOH Na2O+H2O=2Na++2OH–
氧化钠与二氧化碳:Na2O+CO2=Na2CO3
氧化钠与盐酸:Na2O+2HCl=2NaCl+H2O Na2O+2H+=2Na++H2O
3.过氧化钠的化学性质(漂白性、强氧化性):
过氧化钠与水:2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2H2O=4Na++4OH–+O2
过氧化钠与二氧化碳:2Na2O2+2CO2=2Na2CO3+O2
4.碳酸钠与碳酸氢钠的化学性质:
溶解性的的比较:Na2CO3>NaHCO3
碱性的比较:Na2CO3> NaHCO3
热稳定性的比较:Na2CO3>NaHCO3
碳酸氢钠受热分解:2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
碳酸钠与酸的反应:Na2CO3+HCl =NaCl+ NaHCO3 CO32–+H+= HCO3-
Na2CO3+2HCl =2NaCl+H2O+CO2↑ CO32–+2H+=CO2↑+H2O
碳酸氢钠与酸的反应:NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+=CO2↑+H2O
碳酸钠转换成碳酸氢钠(Na2CO3→NaHCO3):
通入CO2:Na2CO3+H2O+CO2=2NaHCO3 CO32–+H2O+CO2=2HCO3-
加入适量稀盐酸:Na2CO3+HCl =NaCl+ NaHCO3 CO32–+H+= HCO3-
碳酸氢钠转换成碳酸钠(NaHCO3→Na2CO3):
碳酸氢钠受热分解:2NaHCO3 Na2CO3+H2O+CO2↑(除去NaHCO3最佳方法)
Na2CO3+H2O+CO2↑(除去NaHCO3最佳方法)
加入适量氢氧化钠:NaHCO3+NaOH= Na2CO3 + H2O HCO3-+OH-=CO32–+H2O
5.金属铝的化学性质:
铝在空气中常温或加热条件下都生成致密的氧化膜: 4Al+3O2=2Al2O3
铝与稀盐酸的反应:2Al+6HCl===2AlCl3+3H2↑ 2Al+6H+=2Al3++3H2↑
铝与氢氧化钠的反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2Al+2OH–+2H2O=2AlO2–+3H2↑
注意:1.等质量的或等物质的量的铝与足量稀盐酸或氢氧化钠反应产生的氢气的量是相等的
2.反应刚开始比较慢,是因为铝表面致密的氧化膜(Al2O3)
3.因为铝既可与盐酸反应又可与氢氧化钠反应生成盐和氢气,所以我们说Al是两性金属。
6.氧化铝的化学性质:(物理性质:难溶于水,熔点高,硬度大)
氧化铝与稀盐酸的反应: Al2O3+6HCl=2AlCl3+3H2O Al2O3+6H+=2Al3++3H2O
氧化铝与氢氧化钠的反应:Al2O3+2NaOH=2NaAlO2+H2O Al2O3+2OH–=2AlO2―+H2O
注意:因为氧化铝既可与盐酸反应生成盐和水,又可与氢氧化钠反应生成盐和水,所以我们说Al2O3是两性氧化物。
7.氢氧化铝的化学性质:
氢氧化铝的制取:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl Al3++3NH3·H2O=Al(OH)3↓+3NH4+
Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4 )2SO4 Al3++3NH3·H2O=Al(OH)3↓+3NH4+
氢氧化铝与稀盐酸的反应:Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O
氢氧化铝与氢氧化钠的反应:Al(OH)3+ NaOH =NaAlO2+2H2O Al(OH)3+ OH– =AlO2–+2H2O
注意:因为氢氧化铝既可与盐酸反应生成盐和水,又可与氢氧化钠反应生成盐和水,所以我们说Al(OH)3是两性氢氧化物。
氢氧化铝溶解性差,热稳定性也不好,受热易分解:2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O
8.金属铁的化学性质:
铁与水蒸气在加热条件的反应:3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
铁在氧气中燃烧:3Fe+ 2O2 Fe3O4
Fe3O4
铁与酸的反应:Fe+2HCl = FeCl2+H2↑ Fe+2H+= Fe 2++H2↑
铁的还原:Fe2O3+3CO=2Fe+3CO2(条件是高温)
铁与盐的反应:Fe+CuSO4=FeSO4+Cu Fe+Cu2+=Fe2++Cu
9.铁的氧化物的化学性质:
常见的铁的氧化物有:氧化亚铁(FeO)、氧化铁(Fe2O3)、四氧化三铁(Fe3O4)
氧化亚铁与盐酸的反应:FeO+2HCl=FeCl2+H2O FeO+2H+=Fe2++H2O
氧化铁与盐酸的反应:Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+6H+=2Fe3++3H2O
四氧化三铁与盐酸的反应:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O Fe3O4+8H+=2Fe3++Fe2++4H2O
10.铁的氢氧化物的化学性质:
氢氧化亚铁的制取:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4 Fe2+ + 2OH— = Fe(OH)2↓
现象:先有白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
Fe(OH)2沉淀变色的方程式是:4Fe(OH)2+O2+2H2O=4Fe(OH)3
氢氧化铁的制取:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl Fe3+ + 3OH— = Fe(OH)3↓
现象:迅速产生红褐色沉淀。
氢氧化亚铁与酸的反应:Fe(OH)2 + 2HCl = FeCl2 + 2H2O Fe(OH)2 + 2H+= Fe2+ + 2H2O
氢氧化铁与酸的反应:Fe(OH)3 + 3HCl = FeCl3 + 3H2O Fe(OH)3 + 3H+= Fe3+ + 3H2O
氢氧化铁溶解性差,热稳定性也不好,受热易分解:2Fe(OH)3 Fe2O3+3H2O
Fe2O3+3H2O
11.Fe2+ 与Fe3+之间的相互转化与鉴定:
三价铁离子(Fe3+)的鉴定:往溶液中滴入几滴KSCN溶液,溶液迅速变成红色;而二价铁(Fe2+)则无任何现象,所涉及的方程式(了解):Fe3+ + 3SCN- =Fe(SCN)3
三价铁转化为二价铁(Fe3 →+Fe2+):三价铁自身是强氧化剂,遇较强还原剂会被还原成二价铁。
氯化铁与铜的反应:FeCl3+Cu=2FeCl2+CuCl2 (用于溶解铜线路版) 2Fe3++Cu=2Fe2++Cu2+
氯化铁与铁粉的反应: 2FeCl3+Fe=3FeCl2 2Fe3++Fe=3Fe2+
二价铁转化为三价铁(Fe2+ →Fe3+):二价铁自身是强还原剂,遇较强氧化剂会被氧化成三价铁。
氯化亚铁溶液中通入氯气:2FeCl2+Cl2=2FeCl3 2Fe2++Cl2=2Fe3++2Cl-
所以Fe2+ 、Fe3+在一定条件下是可以相互转化的。
12.重点:过量问题
二氧化碳与氢氧化钠的反应:
CO2+2NaOH(过量)=Na2CO3+H2O ① 2OH–+CO2=CO32–+H2O
Na2CO3+H2O+CO2=2NaHCO3 ②中间反应 CO32–+H2O+CO2=2HCO3 -
CO2(过量)+NaOH=NaHCO3 (①式+②式) OH–+CO2=HCO3–
二氧化碳与氢氧化钙的反应:先生成沉淀,后沉淀消失。
CO2+Ca(OH)2(过量)=CaCO3↓+H2O① Ca2++2 OH–+CO2=CaCO3↓+H2O
CaCO3+CO2+ H2O=Ca(HCO3)2②中间反应 CaCO3+CO2+ H2O=Ca2++2HCO3–
2CO2(过量)+ Ca(OH)2=Ca(HCO3)2(①式+②式) OH–+CO2=HCO3–
碳酸钠与酸的反应:
Na2CO3(过量)+HCl =NaCl+ NaHCO3 CO32–+H+= HCO3-
Na2CO3+2HCl(过量) =2NaCl+H2O+CO2↑ CO32–+2H+=CO2↑+H2O
氯化铝与氢氧化钠的反应:先生成沉淀,后沉淀消失。
3NaOH+AlCl3(过量) =Al(OH)3↓+3NaCl ① 3OH–+Al3+=Al(OH)3↓
NaOH+Al(OH)3=NaAlO2+2H2O ②中间反应 OH–+Al(OH)3=AlO2–+2H2O
4NaOH(过量)+AlCl3 =NaAlO2+2H2O+3NaCl(①式+②式) 4OH–+Al3+=AlO2–+2H2O
偏铝酸钠与盐酸的反应:先生成沉淀,后沉淀消失。
NaAlO2(过量)+HCl+H2O = Al(OH)3↓+NaCl ① AlO2–+H++H2O=Al(OH)3↓
Al(OH)3+3HCl=AlCl3+3H2O②中间反应 Al(OH)3+3H+=Al3++3H2O
NaAlO2+4HCl(过量) =AlCl3+NaCl +2H2O(①式+②式) AlO2–+4H+=Al3++2H2O
附1:(了解,额外的重点~~~)
二氧化碳与偏铝酸钠的反应:
CO2(不足)+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3 CO2+3H2O+2AlO2–=2Al(OH)3↓+CO32–
CO2(足量)+NaAlO2+2H2O=Al(OH)3↓+NaHCO3 CO2+2H2O+AlO2–=Al(OH)3↓+HCO3–
氯化铝与偏铝酸钠的双水解反应:
3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl 3AlO2-+Al3++6H2O=4Al(OH)3↓
附2:金属及其化合物之间的相互转化:
1、钠及其重要化合物之间的转化关系,写出相应的化学反应方程式:

2、铝及其重要化合物之间的转化关系,写出相应的化学反应方程式:
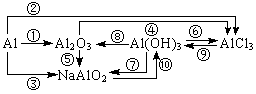
3、铁及其重要化合物之间的转化关系,写出相应的化学反应方程式:
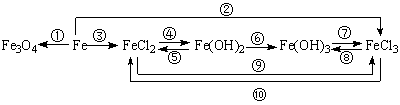
4、金属钠(Na)在空气中长时间放置的变质过程:

水:H2O:18
氧气:O2:32
氢气:H2:2
氮气:N2:28
盐酸:HCL:36.5
硫酸:H2SO4:98
硝酸:HNO3:63
氧化钠:NAOH:40
氢氧化钾:KOH:56
二氧化锰:MnO2:87
二氧化硫:SO2:64
二氧化碳:CO2:44
二氧化氮:NO2:46
金属的话 相对原子质量表有
氨气:NH3:17
氧化镁:MgO:40
氧化铜:CuO:80
氧化铁:Fe2O3:160
四氧化三铁:Fe3O4:232
氢氧化铜:Cu(OH)2 :98
氢氧化铁:Fe(OH)3:90
氯化银:AgCl :143.5
氯化钠:NaC:58.5
氯化锌:ZnCl2 :136
硫酸钡:BaSO4:233
氢氧化钙:Ca(OH)2 :74
氢氧化钡:Ba(OH)2 :171
硝酸氨:NH4NO3:80
碳酸钙:CaCO3:100
碳酸氢钙:Ca(HCO3)2:162
碳酸钠: Na2CO3:106
甲烷:CH4:16
一氧化碳:CO:28
一氧化硫:SO:48
一氧化氮:NO:30
第二篇:《金属及其化合物》化学方程式总结
金属及其化合物化学方程式
1、钠放置在空气中 4Na + O2 = 2Na2O
2、钠在空气中燃烧(黄色的火焰)2Na + O2 Na2O2(淡黄色固体)
4Li + O2 2Li2O
3、铝箔被氧气氧化 4Al + 3O2 2Al2O3
4、钠与水反应(浮、熔、游、响、红)
2Na + 2H2O = 2NaOH + H2 ↑
【2Na + 2H2O = 2Na+ + 2OH - + H2 ↑】
5、高温下铁与水反应 3Fe + 4H2O(g) Fe3O4 + 4H2
6、铝片与稀盐酸反应
2Al + 6HCl = 2AlCl3 + 3H2↑ 【2Al + 6H+ = 2Al3+ +3H2↑】
7、铝与氢氧化钠溶液反应
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
【2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑】
8、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白) 2Na2O2 + 2H2O = 4NaOH + O2↑
【2Na2O2 + 2H2O = 4Na+ + 4OH - +O2↑】
9、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:
2Na2O2 + 2CO2 = 2Na2CO3 + O2
10、苏打(纯碱)与盐酸反应 Na2CO3 +2HCl=2NaCl+H2O +CO2↑
【 CO32- + 2H+ = H2O + CO2↑】
11、小苏打溶液与盐酸反应 NaHCO3 + HCl= NaCl+H2O +CO2↑
【HCO3- + H+ = H2O + CO2↑】
12、小苏打受热分解 2NaHCO3 Na2CO3 + H2O +CO2 ↑
13、氢氧化钠溶液和碳酸氢钠溶液反应
NaHCO3+NaOH= Na2CO3 + H2O
【HCO3-+ OH - = H2O + CO32- 】
14、氧化铝溶于氢氧化钠溶液 Al2O3 + 2NaOH ===2NaAlO2 +H2O
【Al2O3 + 2OH - === 2AlO2- + H2O】
15、氧化铝溶于硫酸 Al2O3+ 3H2SO4==Al2(SO4)3+3H2O
【Al2O3 +6H+ = 2Al3+ +3H2O】
16、硫酸铝溶液中滴加过量氨水
Al2(SO4)3 +6NH3·H2O = 2Al(OH)3↓+ 3(NH4)2SO4
【Al3+ + 3 NH3·H2O = Al(OH)3↓+ 3NH4+】
17、氢氧化铝中加盐酸 Al(OH)3 + 3HCl = AlCl3 + 3H2O
【Al(OH)3 + 3H+ = Al3+ + 3H2O】
18、Al(OH)3与NaOH溶液反应:
Al(OH)3 + NaOH NaAlO2 +2H2O
【Al(OH)3 + OH- = AlO2- +2H2O】
19、氢氧化铝受热分解 2Al(OH)3Al2O3+3H2O
20、铁与盐酸反应 Fe + 2HCl = FeCl2 + H2↑
【Fe + 2H+ = Fe2+ + H2↑】
21、氧化铁溶于盐酸中 Fe2O3 + 6HCl = 2FeCl3 + 3H2O
【Fe2O3 + 6H+ = 2Fe3+ + 3H2O】
22、氧化亚铁溶于盐酸中 FeO + 2HCl = FeCl2 + H2O
【FeO + 2H+ = Fe2+ + H2O】
23、氯化铁溶液中滴入氢氧化钠溶液(红褐色沉淀)
FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl
【Fe3+ + 3OH - = Fe(OH)3 ↓(红褐色沉淀)】
24、硫酸亚铁溶液中滴加氢氧化钠溶液
FeSO4+ 2NaOH = Fe(OH)2↓+ Na2SO4
【Fe2+ + 2OH - = Fe(OH)2 ↓(白色沉淀)】
25、氢氧化亚铁在空气中被氧化(白色沉淀迅速变为灰绿色,最后变为红褐色沉淀) 4Fe(OH)2 + O2 +2H2O = 4Fe(OH)3
26、氢氧化铁受热分解 2Fe(OH)3Fe2O3+3H2O
27、氯化亚铁溶液中通入氯气 2FeCl2 + Cl2 = 2FeCl3
【2Fe2+ + Cl2 = 2Fe3+ + 2Cl- 】
28、氯化铁溶液中加入铁粉
2FeCl3 + Fe =3FeCl2
【2Fe3+ + Fe =3Fe2+】
-
高中化学必修1化学方程式总结
1、钠及其化合物的转化关系2②NaCl2①Na2O+2HCl=2NaCl+H2O②2Na+2HCl=2NaCl+H2↑++++Na…
- 高一化学必修1化学方程式及离子方程式汇总(背诵版)
-
高中化学必修一方程式大全
化学方程式一化学方程式总结1硫酸根离子的检验BaCl2Na2SO4BaSO42NaCl2碳酸根离子的检验CaCl2Na2CO3Ca…
-
高中化学必修1化学方程式总结
高中化学必修1化学方程式总结一钠及其化合物的转化关系1钠在空气中燃烧2NaO2点燃Na2O22钠在氧气中燃烧4NaO2点燃2Na2…
-
高一化学必修一化学方程式及离子方程式小结
必修一化学方程式及离子方程式小结1硫酸根离子的检验BaCl2Na2SO4BaSO42NaClSO4BaBaSO42碳酸根离子的检验…
-
高中化学必修一第三章金属及其化合物化学方程式或离子方程式总汇(完美编辑版)
高中化学必修一第三章金属及其化合物化学方程式或离子方程式总汇第一节金属的化学性质一、钠、镁、铝、铁、铜分别与氧气反应1、4Na+O…
-
高中化学必修1化学方程式总结
1、钠及其化合物的转化关系2②NaCl2①Na2O+2HCl=2NaCl+H2O②2Na+2HCl=2NaCl+H2↑++++Na…
-
高中必修1化学方程式总结
一、教材中涉及的离子检验:背下来,必考物质检验的一般步骤:取试样→加试剂→观现象→定结论1、SO42-的检验:取样,加稀盐酸酸化,…
-
高中化学必修1化学方程式总结
高中化学必修1化学方程式总结一钠及其化合物的转化关系1钠在空气中燃烧2NaO2点燃Na2O22钠在氧气中燃烧4NaO2点燃2Na2…
-
人教版高中化学必修1化学方程式总结知识点归纳
化学必修一知识大总结一教材中涉及的离子检验物质检验的一般步骤取试样加试剂观现象定结论1SO4的检验取待测液先用稀盐酸酸化再加BaC…
-
高中必修1化学方程式大全
高中化学必修1化学方程式总结1、钠及其化合物的转化关系2②NaCl2①Na2O+2HCl=2NaCl+H2O②2Na+2HCl=2…