初中化学常用的除杂方法
初中化学除杂常用的方法
一、物理方法
物理方法是根据被提纯物质和杂质之间物理性的差异而除去杂质的方法,初中化学有过滤和结晶两种。
1. 过滤法:是把难溶性物质跟易溶性物质分离的一种方法。
例1. 如何除去食盐中混有的少量泥沙。
简析:将含有泥沙的食盐溶于水,利用食盐溶于水而泥沙不溶,通过过滤,把泥沙从食盐中除去,再把滤液蒸干即得纯净的食盐。
2. 结晶法:是根据几种固体物质的溶解度受温度变化影响的不同,通过冷却或升温的方法使其中的一种物质先结晶出来,然后过滤使结晶出来的晶体与母液分离的一种方法。
例2. 如何除去 中混有的少量
中混有的少量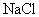 。
。
简析:将含有少量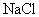 的
的 配成热的饱和溶液,利用
配成热的饱和溶液,利用 的溶解度受温度变化影响大的性质,采用降温冷却的方法,使
的溶解度受温度变化影响大的性质,采用降温冷却的方法,使 结晶析出,而
结晶析出,而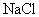 则留在母液里,再过滤即可得纯净的
则留在母液里,再过滤即可得纯净的 晶体。
晶体。
二、化学方法
化学方法是根据被提纯物质和杂质之间的化学性质差异,选择不与被提纯物反应而与杂质反应的试剂把杂质除杂的同时,不能给被提纯物带来新的杂质。常用的方法有以下五种:
1. 沉淀法:即将杂质转变为沉淀而除去。常用的沉淀剂为: 等阳离子,一般用可溶性碱,
等阳离子,一般用可溶性碱, 用
用 ,
, 用
用 用
用 。
。
例3. 如何除去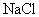 中混有的少量
中混有的少量 。
。
简析:把混合物溶于水,得到含 的溶液,其中
的溶液,其中 为杂质离子,可加
为杂质离子,可加 使
使 转变为
转变为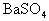 沉淀而除去,加入的试剂不能带来新的杂质,故试剂的阴离子为
沉淀而除去,加入的试剂不能带来新的杂质,故试剂的阴离子为 ,即向混合溶液中加入
,即向混合溶液中加入 溶液至不再产生沉淀为止,过滤、蒸发滤液即得纯净的氯化钠。
溶液至不再产生沉淀为止,过滤、蒸发滤液即得纯净的氯化钠。

2. 气化法:即将杂质转变为气体而除去
例4. 如何除去 中混有的少量
中混有的少量
简析:把混合物溶于水,得到含 的溶液,其中
的溶液,其中 为杂质离子。可加酸使
为杂质离子。可加酸使 转变为
转变为 气体而除去,加入的试剂不能带来新的杂质,故试剂的阴离子为
气体而除去,加入的试剂不能带来新的杂质,故试剂的阴离子为 ,即加入适量
,即加入适量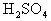 后将溶液蒸干即得纯净的
后将溶液蒸干即得纯净的 。
。

3. 转化法:即将杂质转变为被提纯物而除去。
例5. 如何除去 中混有的少量CO。
中混有的少量CO。
简析:把混合气体通过灼热CuO充分发生反应即可把CO转变为 而除去。
而除去。

4. 置换法:类似于转化法,它是采用合适的置换剂将杂质置换出来而除去。
例6. 如何除去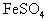 中混有的少量
中混有的少量 。
。
简析:把混合物溶于水,得到含 的溶液,其中
的溶液,其中 为杂质离子,向混合溶液中加入过量铁粉,铁粉与
为杂质离子,向混合溶液中加入过量铁粉,铁粉与 发生置换反应而除去,然后过滤、蒸发结晶即得纯净的
发生置换反应而除去,然后过滤、蒸发结晶即得纯净的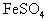 。
。

5. 吸收法:适用于气体杂质,它是用吸收剂直接将混合气体中的杂质吸收而除去。一般地,酸性气体用碱溶液吸收;碱性气体用酸溶液吸收; 用灼热铜网吸收等。
用灼热铜网吸收等。
例7. 如何除去 中混有的少量
中混有的少量 。
。
简析: 是酸性气体,
是酸性气体, 是中性气体,将混合气体通过盛有碱(如
是中性气体,将混合气体通过盛有碱(如 )溶液的洗气瓶,
)溶液的洗气瓶, 被吸收而除去。
被吸收而除去。

初中化学除杂具体方法
1、CO2(CO):把气体通过灼热的氧化铜,
2、CO(CO2):通过足量的氢氧化钠溶液
3、H2(水蒸气):通过浓硫酸/通过氢氧化钠固体
4、CuO(C):在空气中(在氧气流中)灼烧混合物
5、Cu(Fe) :加入足量的稀硫酸
6、Cu(CuO):加入足量的稀硫酸
7、FeSO4(CuSO4): 加入足量的铁粉
8、NaCl(Na2CO3):加入足量的盐酸
9、NaCl(Na2SO4):加入足量的氯化钡溶液
10、NaCl(NaOH):加入足量的盐酸
11、NaOH(Na2CO3):加入足量的氢氧化钙溶液
12、NaCl(CuSO4):加入足量的氢氧化钡溶液
13、NaNO3(NaCl):加入足量的硝酸银溶液
14、NaCl(KNO3):蒸发溶剂
15、KNO3(NaCl):冷却热饱和溶液。
16、CO2(水蒸气):通过浓硫酸
1除去N2中的O2,可将混合气体通过灼热的铜网(2Cu+O2=2CuO)。
2除去NaOH溶液中的Na2CO3,可向溶液中加入适量的Ca(OH)2溶液,(Na2CO3+Ca(OH)2=2NaOH+CaCO3),然后过滤后取滤液。
3除去Cu中的Fe,可将混合固体加入CuSO4溶液中,(Fe+CuSO4=Cu+FeSO4),然后过滤后取滤渣。
4除去Na2SO4溶液中的NaOH,可向溶液中加入适量的稀H2SO4溶液(2NaOH+H2SO4=Na2SO4+2H2O)
5除去KCl溶液中的K2SO4,可向溶液中加入适量的BaCl2溶液(K2SO4+BaCl2=2KCl+BaSO4),然后过滤后取滤液。
6除去NaCl溶液中的BaCl2,可向溶液中加入适量的Na2SO4溶液(BaCl2+Na2SO4=2NaCl+BaSO4),然后过滤后取滤液。
7除去KNO3溶液中的AgNO3,可向溶液中加入适量的KCl溶液(AgNO3+KCl=KNO3+AgCl),然后过滤后取滤液。
8除去NaNO3溶液中的CuSO4,可向溶液中加入适量的Ba(OH)2溶液
(CuSO4+Ba(OH)2=Cu(OH)2+BaSO4),然后过滤后取滤液。
9除去NaNO3溶液中的(NH4)2SO4,可向溶液中加入适量的Ba(OH)2溶液
((NH4)2SO4+Ba(OH)2=BaSO4+2NH3+2H2O),然后过滤后取滤液。
10除去Na2SO4溶液中的Na2CO3,可向溶液中加入适量的稀H2SO4溶液(Na2CO3+H2SO4=Na2SO4+H2O+CO2)
11除去C粉中的CuO,可加入适量的稀H2SO4溶液(CuO+H2SO4=CuSO4+H2O),然后过滤后取滤渣。
12除去CaO中的CaCO3,可加热混合固体(CaCO3=CaO+CO2)
第二篇:初中化学除杂方法和习题
初中化学除杂常用的方法
一、物理方法
物理方法是根据被提纯物质和杂质之间物理性的差异而除去杂质的方法,初中化学有过滤和结晶两种。
1. 过滤法:是把难溶性物质跟易溶性物质分离的一种方法。
例1. 如何除去食盐中混有的少量泥沙。
简析:将含有泥沙的食盐溶于水,利用食盐溶于水而泥沙不溶,通过过滤,把泥沙从食盐中除去,再把滤液蒸干即得纯净的食盐。
2. 结晶法:是根据几种固体物质的溶解度受温度变化影响的不同,通过冷却或升温的方法使其中的一种物质先结晶出来,然后过滤使结晶出来的晶体与母液分离的一种方法。
例2. 如何除去 中混有的少量
中混有的少量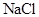 。
。
简析:将含有少量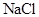 的
的 配成热的饱和溶液,利用
配成热的饱和溶液,利用 的溶解度受温度变化影响大的性质,采用降温冷却的方法,使
的溶解度受温度变化影响大的性质,采用降温冷却的方法,使 结晶析出,而
结晶析出,而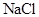 则留在母液里,再过滤即可得纯净的
则留在母液里,再过滤即可得纯净的 晶体。
晶体。
二、化学方法
采用化学方法,必须遵循以下几个原则:
(一).加入的试剂只与杂质反应,不与原物反应。
例如:氢氧化钠中混入碳酸钠。如果用盐酸来除的话,确实可以把碳酸钠除去,但同时也把氢氧化钠除去了。
(二).反应后不能带入新的杂质。
例如:氢氧化钠中混入碳酸钠。如果用氯化钙来除的话,确实可以把碳酸钠除去,但同时引进了新的杂质——氯化钠。
(三).反应后恢复原物状态。
对于所要提纯的物质,原来是什么状态,提纯后还应该是什么状态。一般情况下,我们主要考虑怎样把杂质除掉,对恢复原物状态不做考虑。
(四).操作方法简便易行。
除杂的时候尽力用简单易行的方法进行,尽量避免用高温,电解等方法。
化学方法是根据被提纯物质和杂质之间的化学性质差异,选择不与被提纯物反应而与杂质反应的试剂把杂质除杂的同时,不能给被提纯物带来新的杂质。常用的方法有以下五种:
1. 沉淀法:即将杂质转变为沉淀而除去。常用的沉淀剂为: 等阳离子,一般用可溶性碱,
等阳离子,一般用可溶性碱, 用
用 ,
, 用
用 用
用 。
。
常见气体吸收剂见下表:

⑴常见的干燥剂

例3. 如何除去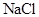 中混有的少量
中混有的少量 。
。
简析:把混合物溶于水,得到含 的溶液,其中
的溶液,其中 为杂质离子,可加
为杂质离子,可加 使
使 转变为
转变为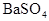 沉淀而除去,加入的试剂不能带来新的杂质,故试剂的阴离子为
沉淀而除去,加入的试剂不能带来新的杂质,故试剂的阴离子为 ,即向混合溶液中加入
,即向混合溶液中加入 溶液至不再产生沉淀为止,过滤、蒸发滤液即得纯净的氯化钠。
溶液至不再产生沉淀为止,过滤、蒸发滤液即得纯净的氯化钠。

2. 气化法:即将杂质转变为气体而除去
例4. 如何除去 中混有的少量
中混有的少量
简析:把混合物溶于水,得到含 的溶液,其中
的溶液,其中 为杂质离子。可加酸使
为杂质离子。可加酸使 转变为
转变为 气体而除去,加入的试剂不能带来新的杂质,故试剂的阴离子为
气体而除去,加入的试剂不能带来新的杂质,故试剂的阴离子为 ,即加入适量
,即加入适量 后将溶液蒸干即得纯净的
后将溶液蒸干即得纯净的 。
。

3. 转化法:即将杂质转变为被提纯物而除去。
例5. 如何除去 中混有的少量CO。
中混有的少量CO。
简析:把混合气体通过灼热CuO充分发生反应即可把CO转变为 而除去。
而除去。

4. 置换法:类似于转化法,它是采用合适的置换剂将杂质置换出来而除去。
例6. 如何除去 中混有的少量
中混有的少量 。
。
简析:把混合物溶于水,得到含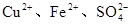 的溶液,其中
的溶液,其中 为杂质离子,向混合溶液中加入过量铁粉,铁粉与
为杂质离子,向混合溶液中加入过量铁粉,铁粉与 发生置换反应而除去,然后过滤、蒸发结晶即得纯净的
发生置换反应而除去,然后过滤、蒸发结晶即得纯净的 。
。

5. 吸收法:适用于气体杂质,它是用吸收剂直接将混合气体中的杂质吸收而除去。一般地,酸性气体用碱溶液吸收;碱性气体用酸溶液吸收; 用灼热铜网吸收等。
用灼热铜网吸收等。
例7. 如何除去 中混有的少量
中混有的少量 。
。
简析: 是酸性气体,
是酸性气体, 是中性气体,将混合气体通过盛有碱(如
是中性气体,将混合气体通过盛有碱(如 )溶液的洗气瓶,
)溶液的洗气瓶, 被吸收而除去。
被吸收而除去。

专题练习——除杂题
1、下列各组离子在水溶液中能大量共存的是( )
A. H+、Ba2+、NO3-、OH- B. H+、K+、Cl-、CO32-
C. Na+、Ag+、NO3-、CO32- D. Na+、K+、OH-、SO42-
2、某NaNO3溶液中混有少量NaCl,Na2SO4和Na2CO3杂质,为除去这些杂质,仅提供3种药品:AgNO3溶液、BaCl2 溶液和稀HCl。请设计合理的顺序将杂质逐一除去,并填写下面实验报告。(简要回答)Ba+ OH-

3、在分开盛放的A、B两溶液中,共含有Na+、Cu2+、Ba2+、Mg2+、OH-、NO3-、
SO42-七种离子两溶液中所含离子各不相同,已知A溶液里含三种阳离子和两种阴离子,其余在B溶液里,则B溶液里所含离子应该是 。
5、分离NaCl、FeCl3和BaSO4的混合物,应选用的一组试剂是( )
A. H2O、AgNO3、HNO3 B. H2O、NaOH、HNO3
C. H2O、NaOH、HCl D. H2O、KOH、HNO3
6、欲除去下列各物质中的少量杂质(括号内的物质为杂质),同时,又不能引入新的杂质,分别写出所加试剂和发生反应的化学方程式。
(1) (2)
(2)
(3) (4)
(4)
7、除去 中混有的少量
中混有的少量 杂质,可加入试剂( )
杂质,可加入试剂( )
A. 盐酸 B. 石灰水 C. 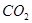 D.
D.  溶液
溶液
8、下列试管内壁的物质能用括号内所给试剂除去的是( )
A. 盛石灰水后留下的固体(氢氧化钠溶液)
B. 用足量 还原
还原 后留下的光亮红色固体(稀盐酸)
后留下的光亮红色固体(稀盐酸)
C. 盛过植物油的试管(热碱液)
D. 氯化铁溶液和氢氧化钠溶液反应后留下的固体(水)
9、下列物质中,不能与 溶液发生反应的是( )
溶液发生反应的是( )
A. 稀 B.
B.  溶液 C.
溶液 C.  溶液 D.
溶液 D.  溶液
溶液
10、下列各组物质的溶液,两两混合都能发生反应的一组是( )
A.  、
、 、
、 B.
B.  、
、 、
、
C.  、
、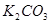 、
、 D.
D.  、
、 、
、
11、硫酸钠溶液中含有少量碳酸钠杂质,除去该杂质可加入适量( )
A. 稀 B.
B.  C. 硝酸 D. 石灰水
C. 硝酸 D. 石灰水
12、为了除去 溶液中含有的少量
溶液中含有的少量 和
和 杂质,应依次加入的试剂是( )
杂质,应依次加入的试剂是( )
A. 先加入适量 溶液,再加入适量
溶液,再加入适量 溶液。
溶液。
B. 先加入适量 溶液,再加入适量
溶液,再加入适量 溶液。
溶液。
C. 先加入适量 溶液,再加入适量
溶液,再加入适量 溶液。
溶液。
D. 先加入适量 溶液,再加入适量
溶液,再加入适量 溶液。
溶液。
13、某溶液中大量含有 ,
, ,
, ,三种阳离子中的两种离子和离子
,三种阳离子中的两种离子和离子 ,
, ,
, ,
, 四种阴离子中的两种离子溶液中大量含有的四种离子应该是( )
四种阴离子中的两种离子溶液中大量含有的四种离子应该是( )
A.  、
、 、
、 、
、 B.
B.  、
、 、
、 、
、
C.  、
、 、
、 、
、 D.
D.  、
、 、
、 、
、
14、除去硝酸中混有的少量盐酸,可加入的试剂是( )
A.  溶液 B.
溶液 B.  溶液 C.
溶液 C.  溶液 D.
溶液 D.  溶液
溶液
15、除去铜粉中混有的少量氧化铜,其主要操作过程是( )
A. 加入过量稀 微热后,过滤,洗涤。 B. 加强热或在空气中灼热。
微热后,过滤,洗涤。 B. 加强热或在空气中灼热。
C. 加适量水,加热,过滤,洗涤。 D. 加适量稀 ,微热,过滤,洗涤。
,微热,过滤,洗涤。
16、有 、
、 、
、 、
、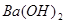 溶液、
溶液、 溶液、
溶液、 溶液和稀
溶液和稀 等7种物质,常温下每两种物质间能发生的化学反应有( )
等7种物质,常温下每两种物质间能发生的化学反应有( )
A. 7个 B. 6个 C. 5个 D. 4个
17、工业上食盐水的精制是为了除去粗盐中的 ,
, ,
, 及泥沙,可将粗盐溶于水,然后进行下列五项操作:
及泥沙,可将粗盐溶于水,然后进行下列五项操作:
① 过滤 ② 加过量的 溶液
溶液
③ 加适量的 ④ 加过量的
④ 加过量的 溶液
溶液
⑤ 加过量的 溶液。正确操作顺序是( )
溶液。正确操作顺序是( )
A. ①④②⑤③ B. ④①②⑤③ C. ②⑤④①③ D. ⑤④①②③
18、某溶液中仅含 ,
, ,
, ,
, 四种离子,其中离子个数比为
四种离子,其中离子个数比为
 ,若
,若 为8m个,则
为8m个,则 离子个数可能是( )
离子个数可能是( )
A. 1m B. 2m C. 4m D. 6m
19、将下列试剂分别滴入硝酸铜溶液,碳酸钠溶液和稀盐酸中,能观察到三种不同现象的是( )
A. 氢氧化钾溶液 B. 氯化钡溶液 C. 氢氧化钙溶液 D. 氯化钾溶液
20、在不用指示剂的条件下,欲将含有盐酸的氯化钡溶液由酸性变为中性,应选用的最佳试剂是( )
A. 氢氧化钡溶液 B. 硝酸银溶液 C. 碳酸钡粉末 D. 生石灰粉末
21、 某工厂的废渣中混有少量的锌粒和氧化铜(其它成分不跟酸反应),与大量废盐酸接触能形成污水,产生公害,若向污水中撒入铁粉,且反应后铁粉有剩余,此时污水中一定含有金属离子是( )
A. 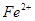 ,
, B.
B.  ,
, C.
C.  ,
,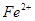 D.
D.  ,
,
22、当土壤的pH值为4时,农作物不能生长,现要改良它,应撒施的物质是( )
A. 食盐 B. 石灰石 C. 熟石灰 D. 胆矾
23、某溶液中存在 、
、 、
、 三种阳离子,现用
三种阳离子,现用 ,
, 和
和 三种溶液使它们转化为沉淀并分离出来,要求每次只加一种溶液,滤出一种沉淀,则所加溶液的顺序正确的是( )
三种溶液使它们转化为沉淀并分离出来,要求每次只加一种溶液,滤出一种沉淀,则所加溶液的顺序正确的是( )
A.  、
、 、
、 B.
B.  、
、 、
、
C.  、
、 、
、 D.
D.  、
、 、
、
24、某溶液中滴加 溶液,产生不溶于稀
溶液,产生不溶于稀 的白色沉淀,则该溶液中可能含有的离子是( )
的白色沉淀,则该溶液中可能含有的离子是( )
A.  B.
B.  C.
C.  或
或 D.
D. 
25、下列反应能够一步实现的是( )
A.  B.
B. 
C.  D.
D. 
26、在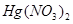 、
、 和
和 的混合溶液中,加入足量的铁粉,充分反应后,溶液中存在的溶质是( )
的混合溶液中,加入足量的铁粉,充分反应后,溶液中存在的溶质是( )
A.  和
和 B.
B.  和
和
C. 只有 D. 只有
D. 只有
27、 溶液中混有少量
溶液中混有少量 ,若加一种试剂除去,该试剂是 。若加两种试剂除去,应加 和 (写化学式)。
,若加一种试剂除去,该试剂是 。若加两种试剂除去,应加 和 (写化学式)。
28、  溶液中混入少量
溶液中混入少量 ,可加入 除去
,可加入 除去 ,实验现象 ,化学方程式 。
,实验现象 ,化学方程式 。
29、 溶液中混入少量
溶液中混入少量 ,可加入 除去
,可加入 除去 ,现象 ,充分反应经过 (填写实验操作)可得纯净
,现象 ,充分反应经过 (填写实验操作)可得纯净 溶液,化学方程式 。
溶液,化学方程式 。
30、选用一种试剂除去硝酸钠中含有的少量硫酸铁,该试剂是 ,选用一种试剂除去硝酸钠中含有的少量氯化钠,该试剂是 。
31、填表:欲除去下表中各物质溶液中含有的少量杂质(括号内的物质为杂质),试分别写出所要加入物质(适量)的名称和发生反应的化学方程式:

32、含有少量水蒸气、氢气、一氧化碳、二氧化碳的氮气,欲得纯净氮气,可使混合气体先通过足量 ,再通过 ,最后通过 。
33、硝酸钠溶液中含有少量氯化钠、碳酸钠和硫酸钠杂质,欲分别除去这些杂质,可先加入 试剂,除去 ,再向溶液中加入 试剂,除去 ,过滤后再向滤液中加入 试剂,以除去 ,可得纯净硝酸钠溶液。
34、现有以下几项操作:① 加适量盐酸 ② 加适量水溶解 ③ 过滤 ④ 高温或加热灼烧 ⑤ 蒸发,请选择合适的操作,以除去下列各物质中含有的少量杂质,并将其标号按操作的先后顺序填在横线上。
A. 除去氯化钾晶体中的碳酸钾,应先 再 。
B. 除去生石灰中的碳酸钙,应 。
C. 除去铜粉中的氧化铜,应先 再 。
D. 除去碳酸钙中的碳酸钠,应先 再 。
-
初三化学学习方法总结
初三化学的学习方法同学们进入初三了,面对一个全新的学科——化学。根据第一次月考成绩来看很多同学还不太清楚应该如何学习化学,在这里主…
-
学习方法:学好初中化学不得不看的方法
本文集资料共4个分类学习方法记忆方法快速阅读潜能开发每个分类都有多个资料可在百度文库新浪爱问共享豆丁文库中直接搜索学习方法记忆方法…
-
初中化学学习方法总结
--------王瑞芳化学学科有两大特点:(一)化学是一门以实验为基础的自然科学,这门学科的形成和发展,起源于实验又依赖于实验。(…
-
初三化学学习方法的建议
初三化学学习方法的建议1、激发兴趣兴趣是最好的老师。刚接触一门新的学科,大多数同学都抱有极大的兴趣。化学第一节课《绪言》中有三个演…
-
初中化学学习方法总结
初中化学学习方法总结化学学科有两大特点一化学是一门以实验为基础的自然科学这门学科的形成和发展起源于实验又依赖于实验二化学繁这个繁实…
-
初中化学离子共存及除杂总结
初中化学离子共存及除杂一、离子共存问题-2-2-1、所有的弱酸根离子和OH都不能在酸性溶液中存在(如CO3、SO3、)-++22+…
-
权威总结:初中化学除杂专题
初中化学除杂专题(李恒伊春市西林职业技术学校)主要物质(杂质)除杂试剂除杂方法1、CO(CO2)石灰水或NaOH溶液洗气2、CO2…
-
初中化学除杂问题总结
初中化学常见物质的除杂总结一、概念理解首先明白物质除杂是干什么,物质除杂又叫物质提纯,即把混合物中少量的杂质出去,得到较纯净物质的…
-
初中化学除杂问题总结
初中化学常见物质的除杂总结概念理解首先明白物质除杂是干什么,物质除杂又叫物质提纯,即把混合物中少量的杂质出去,得到较纯净物质的过程…