有机化学实验考研总结

 有机物分离和提纯的常用方法
有机物分离和提纯的常用方法
1、常压蒸馏
【原理】利用互溶液体混合物中各组分沸点不同
(30℃以上)进行分离提纯的一种方法。
【注意】
①主要仪器:蒸馏烧瓶、冷凝管、接引管、锥形瓶
②温度计水银球位于支管口处
③冷凝管从下口进水,上口出水
④沸点高而不稳定的液态物质可以考虑减压蒸馏
⑤要加入碎瓷片防止液体暴沸
 ⑥蒸馏烧瓶盛装溶液体积最大为烧瓶体积的 2/3
⑥蒸馏烧瓶盛装溶液体积最大为烧瓶体积的 2/3
【找错误】
1.圆底烧瓶中盛液量过多,应为烧瓶容积的1/3-2/3。
2.没有加沸石。
3.温度计水银球的上沿应位于蒸馏支管下沿的水平线上。
4.球形冷凝管应改为直形冷凝管。
5.通水方向应改为下口进水,上口出水。
6.系统密闭。应将接引管改为带分支的接引管;
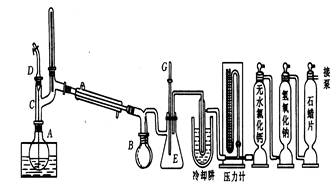 2.减压蒸馏
2.减压蒸馏
蒸馏部分:主要仪器有蒸馏烧瓶,克氏蒸馏头,毛细管,温度计,直形冷凝管,多头接引管,接受器等,起分离作用。
抽提部分:可用水泵或油泵,起产生低压作用。
油泵保护部分:有冷却阱,有机蒸气吸收塔,酸性蒸气吸收塔,水蒸气吸收塔,起保护油泵正常工作作用。
测压部分:主要是压力计,可以是水银压力计或真空计量表,起测压力的用
[实验原理] 在低于大气压力下进行的蒸馏称为减压蒸馏。减压蒸馏是分离提纯高沸点有机化合物的一种重要方法,特别适用于在常压下蒸馏未达到沸点时即受热分解、氧化或聚合的物质。
【实验操作】 1.首先按图安装好装置,在未装样品前应检查是否漏气。
2.装入样品安上毛细管,开启真空泵,再关上安全瓶活塞,调整真空度至所要求的数字。
3.待压力稳定后,开始加热进行减压蒸馏,控制馏出速度,以每秒一滴为宜。
4.蒸馏完毕,先放松毛细管活夹子,再开启安全瓶活塞通大气,停止加热,停止抽气。
【注意事项】1.减压蒸馏装置的严密不漏气。
2.液体样品不得超过容器的1/2
3.先恒定真空度再加热。
4.开泵与关泵前,安全瓶活塞一定要通大气。
5.沸点低于150℃的有机液体不能用油泵减压。
3.水蒸气蒸馏
【原理】道尔顿定律:当有机物与水一起共热时,整个系统的蒸气压为各组分蒸气压,即P(总)=P(水)+P(有机物)
【蒸馏条件】
(1)混合物中含有大量的固体,通常的蒸馏、过滤、萃取等方法都不适
(2)混合物中含有焦油状物质,采用通常的蒸馏、萃取等方法都不适用。
(3)在常压下蒸馏会发生分解的高沸点有机物质。
【蒸馏物质条件】
 (1)随水蒸气蒸出的物质应不溶或难溶于水,且在沸腾下与水长时间共存而不起化学变化。
(1)随水蒸气蒸出的物质应不溶或难溶于水,且在沸腾下与水长时间共存而不起化学变化。
(2)随水蒸气蒸出的物质,应在比该物质的沸点低得多的温度,而且比水的沸点还要低得多的温度下即可蒸出。
【找错误】
①水蒸气发生器的安全管在液面之上,应插入接近底部处。
②三通管有水蒸气泄漏,应用止水夹夹紧。
③水蒸气导入管在待蒸馏物质的液面之上,应插液面以下。
④冷凝管应改用直形冷凝管。
⑤通水方向反了,应从下面进水。
⑥系统密闭,应改带分支的接引管或非磨口锥形瓶作接器。
【实验操作】1.在进行水蒸气蒸馏之前,应认真检查水蒸气蒸馏装置是否严密。
2.开始蒸馏时,应将T形管的止水夹打开,待有蒸气溢出时再旋紧夹子,使水蒸气进入三颈烧瓶中,并调整加热速度,以馏出速度2—3滴/秒为宜。
3.操作中要随时注意安全管中的水柱是否有异常现象发生,若有,应立即打开夹子,停止加热,找出原因,排除故障后方可继续加热。
4.当馏出液无明显油珠时,可停止蒸馏。既先旋开螺旋夹,再移开热源,以免发生倒吸现象。
【注意事项】1.安装正确,连接处严密; 2.严守操作程序;
3.水蒸气导入管必须插入三颈烧瓶液面以下,并接近底部处;
4.实验加热前,止水夹应注意打开,待有水蒸气从止水夹处冒出后,关闭止水夹;
实验结束时,也首先打开止水夹,然后再停止加热(防止倒吸);
5.调节火焰,控制蒸馏速度2~3 d/s,并时刻注意安全管;6.按安装相反顺序拆卸仪器;
7.在蒸馏过程中,如发现安全管中的水位迅速上升,则表示系统中发生了堵塞。
此时应立即打开止水夹,然后移去热源,待排除堵塞后再进行水蒸气蒸馏;
8.万一冷凝管已经被堵塞,应立即停止蒸馏,并且设法疏通;
9.通入和停通冷却水都要缓慢旋动开关,以免水流过急而撑开橡胶导管;
1. 怎样判断水蒸汽蒸馏操作是否结束?
答:当流出液澄清透明不再含有有机物质的油滴时,即可断定水蒸汽蒸馏结束(也可用盛有少量清水的锥形瓶或烧杯来检查是否有油珠存在)。
2. 蒸馏时为什么蒸馏烧瓶中所盛液体的量既不应超过其容积的2 /3,也不应少于1/3?
答:如果装入液体量过多,当加热到沸腾时,液体可能冲出或飞沫被蒸气带走,混入馏出液中。如果装入液体量太少,在蒸馏结束时,相对地也会有较多的液体残留在瓶内蒸不出来。
3. 蒸馏时,为什么最好控制馏出液的流出速度为1-2滴/秒。
答:蒸馏时,最好控制馏出液的流出速度为1~2滴/秒。因为此速度能使蒸馏平稳,使温度计水银球始终被蒸气包围,从而无论是测定沸点还是集取馏分,都将得到较准确的结果,避免了由于蒸馏速度太快或太慢造成测量误差。
 4、重结晶
4、重结晶
 【原理】固体有机物在溶剂中的溶解度一般随温度的生高而增大。把固体有机物溶解在热的溶剂中使之饱和,趁热滤去不溶性杂质,滤液于低温处放置,使主要成分在低温时析出结晶,可溶性杂质仍留在母液中,产品纯度相对提高。
【原理】固体有机物在溶剂中的溶解度一般随温度的生高而增大。把固体有机物溶解在热的溶剂中使之饱和,趁热滤去不溶性杂质,滤液于低温处放置,使主要成分在低温时析出结晶,可溶性杂质仍留在母液中,产品纯度相对提高。
【溶剂要求】a.不与被提纯物质发生化学反应
b.温度高时能溶解较多量的被提纯物,低温时只能溶解很少量
c.对杂质的溶解度在低温时或非常大或非常小,
d.沸点不宜太高,也不宜太低,易挥发除去,
e.能给出好的结晶,f.毒性小,价格便宜,易得。
 【实验操作】
【实验操作】
1. 加热溶解,将待重结晶的物质溶解于沸腾或将进沸腾的适宜溶剂中,制成过饱和溶液。
2.趁热过滤,除去不溶物质和活性碳。
3.冷却滤液,使结晶析出;
4.减压过滤,滤出结晶,必要时用适宜的溶剂洗涤结晶
【主要操作】选择溶剂→溶解固体→热过滤除杂质→晶体析出→抽滤,洗涤晶体→干燥
1. 重结晶的目的是什么?
答:从有机反应中得到的固体产品往往不纯,其中夹杂一些副产物、不反应的原料及催化剂等。纯化这类物质的有效方法就是选择合适的溶剂进行重结晶,其目的在于获得最大回收率的精制品。
2在重结晶过程中,必须注意哪几点才能使产品的产率高、质量好?
答1. 正确选择溶剂;2. 溶剂的加入量要适当;4. 吸滤瓶和布氏漏斗必需充分预热;
3. 活性炭脱色时,一是加入量要适当,二是切忌在沸腾时加入活性炭;
5. 滤液应自然冷却,待有晶体析出后再适当加快冷速度, 以确保晶形完整;
6. 最后抽滤时要尽可能将溶剂除去,并用母液洗涤有残留品的烧杯。
3. 重结晶操作中,活性炭起什么作用?为什么不能在溶液沸腾时加入?
答:(1)重结晶操作中,活性炭起脱色和吸附作用。
(2)千万不能在溶液沸腾时加入,否则会引起暴沸,使溶液溢出,造成产品损失
3、萃取
【原理】利用物质在互不相溶的溶剂中溶解度的不同,将物质从一种溶剂转移到另一溶剂中,从而进行分离的方法。
【萃取剂的选择】②溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度
①萃取剂与原溶剂不互溶、不反应③溶质不与萃取剂发生任何反应
1.什么是萃取?什么是洗涤?指出两者的异同点。
答:萃取是从混合物中抽取所需要的物质;洗涤是将混合物中所不需要的物质除掉。萃取和洗涤均是利用物质在不同溶剂中的溶解度不同来进行分离操作,二者在原理上是相同的,只是目的不同。从混合物中提取的物质,如果是我们所需要的,这种操作叫萃取;如果不是我们所需要的,这种操作叫洗涤。
2. 如何使用和保养分液漏斗?
答:1.分液漏斗的磨口是非标准磨口,部件不能互换使用。
2.使用前,旋塞应涂少量凡士林或油脂,并检查各磨口是否严密。
3.使用时,应按操作规程操作,两种液体混合振荡时不可过于剧烈,以防乳化;振荡时应注意及时放出气体;上层液体从上口倒出;下层液体从下口放出。
4.使用后,应洗净凉干,在磨口中间夹一纸片,以防粘结
5分馏 定义:利用分馏柱使几种沸点相近的混合物得到分离和纯化
【原理】利用分馏柱进行分馏,实际上就是在分馏柱内使混合物进行多次气化和冷凝。混合液沸腾后蒸气进入分馏柱中被部分冷凝,冷凝液在下降途中与继续上升的 蒸气接触,二者进行热交换,蒸汽中高沸点组分被冷凝,低沸点组分仍呈蒸气上升,而冷凝液中低沸点组分受热气化,高沸点组分仍呈液态下降。结果是上升的蒸汽中低沸点组分增多,下降的冷凝液中高沸点组分增多。如此经过多次热交换,就相当于连续多次的普通蒸馏。以致低沸点组分的蒸气不断上升,而被蒸馏出来;高沸点组分则不断流回蒸馏瓶中,从而将它们分离
【注意事项】
 1. 在仪器装配时应使分馏柱尽可能与桌面直,以保证上面冷凝下来的液体与下面上升的气体进行充分的热交换和质交换,提高分离效果
1. 在仪器装配时应使分馏柱尽可能与桌面直,以保证上面冷凝下来的液体与下面上升的气体进行充分的热交换和质交换,提高分离效果
2. 根据分馏液体的沸点范围,选用合适的热浴加热,不要在石棉网上用直接火加热。用小火加热热浴,以便使浴温缓慢而均匀地上升。
3.液体开始沸腾,蒸气进入分馏柱中时,要注意调节浴温,使蒸气环缓慢而均匀地沿分馏柱壁上升。若室温低或液体沸点较高,应将分馏柱用石棉绳或玻璃布包裹起来,以减少柱内热量的损失。
4.当蒸气上升到分馏柱顶部,开始有液体馏出时,应密切注意调节浴温,控制馏出液的速度为每2~3秒一滴。如果分馏速度太快,产品纯度下降;若速度太慢,会造成上升的蒸气时断时续,馏出温度波动。
5.根据实验规定的要求,分段集取馏份,实验结束时,称量各段馏份。
6.回流
1、冷凝管的选用:回流时多选用球形冷凝管,若反应混合物沸点很低或其中有毒性大的原料或溶剂时,可选用蛇形冷凝管。
2、热浴的选用:回流加热前应先放入沸石,根据瓶内液体的沸腾温度,可选用水浴、油浴、空气浴或电热套加热等方式。
3.有机实验中,什么时候利用回流反应装置?怎样操作回流反应装置?
答:有两种情况需要使用回流反应装置:
一是反应为强放热的、物料的沸点又低,用回流装置将气化的物料冷凝回到反应体系中。
二是反应很难进行,需要长时间在较高的温度下反应,需用回流装置保持反应物料在沸腾温度下进行反应。部件不可拆开放置)。
7、分液漏斗
1、分液漏斗的选用:无论选用何种形状的分液漏斗,加入全部液体的总体积不得超过其容量的3/4。
2、盛有液体的分液漏斗的放置(两种方法):
(a)放置在固定的铁环上,而铁环应固定在铁架台的适当高度;
(b)分液漏斗颈上配一塞子,然后用单爪铁夹稳稳地将其夹住,并固定在铁架台的适当高度。不论如何放置,接受液体容器的内壁应紧贴分液漏斗颈。
3、分液漏斗的检查:使用分液漏斗前,应检查玻璃活 塞、活塞芯是否原装配套;分液漏斗是否漏液;活塞芯是否旋转自如;活塞芯孔是否被堵塞等。
第二篇:有机化学实验总结
20xx年春季学期有机化学实验总结
清华大学
医学实验班 生37
谢雯婷 2013012468
记得上学期有机化学赵亮老师告诉我们:“没有实验的化学只是一半的化学。”从那时候开始我就对这学期的有机化学实验课程有了些许期待。
可是做好一次实验并不只是简单去实验室进行操作。以下是我根据自己的实验情况总结的几点:
1. 每一次实验前,在认真地阅读有机化学实验课本的前提之下,我会将实验报告中预习的部分根据自己的理解整理誊写在实验报告上。我可以根据有机化学的课本去理解实验的原理,再通过现场实验去加深理解。
2. 并且可以借助网络资源,去查化合物的物理化学性质、实验的注意事项或者是自己对实验的疑问。
3. 有时候,我也会在预习完之后与宿舍的同学交流交流实验的注意点或者自己的疑问之处。这样的交流往往使得我们的预习效率有很明显提高,因为每位同学的关注点都是不完全相同的。
4. 在做实验时,我觉得最重要的是在自己操作实验之前要仔仔细细地听老师的讲解。老师不光会讲解实验的原理,更会提到实验的重点和一些操作的技巧。实验是一门动手的课程,老师的丰富经验能帮助我们更好地完成实验操作。
5. 每次做实验,我都会在组装好实验装置之后请老师或者助教来检查我的实验装置是否安全可靠。我认为这样一步不是多余的,而是更加确保了实验的安全性。
6. 在实验操作同时要学会记录实验现象。这一点我做的不好,希望以后能有所该进。
7. 完成课上的操作之后,学会如何处理实验数据也对我来说是一个难点。不过通过有机和无机的两门实验课的系统培训已经有所进步。
8. 课后的实验分析和课后总结也是实验报告不可缺少的一部分。每次完成思考题时都会使得我去回想自己的实验操作是否有什么失误。也使得我对实验的一些细节问题有了更深的理解,理解了为什么要有这样那样的操作。 我总体觉得有机实验很好,兼具趣味性和实用性。以下是我对有机实验课程的一点建议:
1. 能不能麻烦老师增加一些和生物实验相关更紧密的实验?
2. 实验课可以增加一些关于如何设计实验的教学内容吗?
3. 可不可增加有机实验的课时,这样我们就可以学习到更多的实验技巧,更好地巩固自己的理论知识。
-
有机化学实验总结
有机化学实验一、复习要点1.反应原理(方程式);2.反应装置特点及仪器的作用;3.有关试剂及作用;4.反应条件;5.实验现象的观察…
-
高中有机化学实验总结最全
有机化学基础实验(一)烃1.甲烷的氯代(必修2)(性质)实验:取一个100mL的大量筒(或集气瓶),用排水的方法先后收集20mLC…
-
有机化学实验总结
本学期通过这五个有机化学实验使我更加熟悉了有机化学实验的基本操作,如水浴加热,蒸馏,冷凝回流等,了解了各种药品的实验方法及原理,明…
-
有机化学实验总结
转眼间,短短五周的实验课已经结束了。现在回想起来,在有机化学实验课上,真的收获了很多。这些收获也不仅仅是学会了一些基本的化学实验操…
-
20xx高中有机化学实验总结最全
(一)烃1.20xx有机化学基础实验甲烷的氯代(必修2、P56)(性质)实验:取一个100mL的大量筒(或集气瓶),用排水的方法先…
-
有机实验心得体会
大三上学期,我修完了大学四年中的第二个基础有机化学实验,也可能是本科里的最后一次的有机实验。这两个学期的基础有机化学实验给我带来了…
-
有机化学学习心得体会
当今社会已经进入了信息社会,世界已经开始全面信息化、全球化。所以,为了适应社会的发展,我们教师必须首先牢固树立信息化、全球化的思想…
-
高中化学有机化学实验总结
高中化学有机化学实验总结(必修二加选修五)1、石油的分馏(1)两种或多种相差较大且的液体混合物,要进行分离时,常用这种分离方法。(…
-
20xx高中有机化学实验总结最全
(一)烃1.20xx有机化学基础实验甲烷的氯代(必修2、P56)(性质)实验:取一个100mL的大量筒(或集气瓶),用排水的方法先…
-
有机化学实验归纳小结(正版)
有机化学实验归纳小结一、有机物物理性质归纳有机物的物理性质与化学性质同等重要,且“结构决定性质,性质反映结构”不仅表现在化学性质中…
-
有机化学实验总结
转眼间,短短五周的实验课已经结束了。现在回想起来,在有机化学实验课上,真的收获了很多。这些收获也不仅仅是学会了一些基本的化学实验操…