《有机化学基础》烃与烃的衍生物知识点归纳整理
《有机化学基础》知识点整理
班级 姓名 学号
一、重要的物理性质
1.有机物的溶解性
(1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的[一般指N(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。(它们都能与水形成氢键)。
(3)具有特殊溶解性的:
① 乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物,所以常用乙醇来溶解植物色素或其中的药用成分,也常用乙醇作为反应的溶剂,使参加反应的有机物和无机物均能溶解,增大接触面积,提高反应速率。例如,在油脂的皂化反应中,加入乙醇既能溶解NaOH,又能溶解油脂,让它们在均相(同一溶剂的溶液)中充分接触,加快反应速率,提高反应限度。
② 苯酚:室温下,在水中的溶解度是9.3g(属可溶),易溶于乙醇等有机溶剂,当温度高于65℃时,能与水混溶,冷却后分层,上层为苯酚的水溶液,下层为水的苯酚溶液,振荡后形成乳浊液。苯酚易溶于碱溶液和纯碱溶液,这是因为生成了易溶性的钠盐。
③ 乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反应吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于闻到乙酸乙酯的香味。
④ 有的淀粉、蛋白质可溶于水形成胶体。蛋白质在浓轻金属盐(包括铵盐)溶液中溶解度减小,会析出(即盐析,皂化反应中也有此操作)。但在稀轻金属盐(包括铵盐)溶液中,蛋白质的溶解度反而增大。
⑤ 线型和部分支链型高聚物可溶于某些有机溶剂,而体型则难溶于有机溶剂。
⑥ 氢氧化铜悬浊液可溶于多羟基化合物的溶液中,如甘油、葡萄糖溶液等,形成绛蓝色溶液。
2.有机物的密度
(1)小于水的密度,且与水(溶液)分层的有:各类烃、一氯代烃、酯(包括油脂)
(2)大于水的密度,且与水(溶液)分层的有:多氯代烃、溴代烃(溴苯等)、碘代烃、硝基苯
3.有机物的状态[常温常压(1个大气压、20℃左右)]
(1)气态:
① 烃类:一般N(C)≤4的各类烃 注意:新戊烷[C(CH3)4]亦为气态
② 衍生物类:
一氯甲烷(CH3Cl,沸点为-24.2℃) 氟里昂(CCl2F2,沸点为-29.8℃)
氯乙烯(CH2==CHCl,沸点为-13.9℃) 甲醛(HCHO,沸点为-21℃)
氯乙烷(CH3CH2Cl,沸点为12.3℃) 一溴甲烷(CH3Br,沸点为3.6℃)
四氟乙烯(CF2==CF2,沸点为-76.3℃) 甲醚(CH3OCH3,沸点为-23℃)
甲乙醚(CH3OC2H5,沸点为10.8℃) 环氧乙烷( ,沸点为13.5℃)
(2)液态:一般N(C)在5~16的烃及绝大多数低级衍生物。如,
己烷CH3(CH2)4CH3 环己烷
甲醇CH3OH 甲酸HCOOH
溴乙烷C2H5Br 乙醛CH3CHO
溴苯C6H5Br 硝基苯C6H5NO2
★特殊:
不饱和程度高的高级脂肪酸甘油酯,如植物油脂等在常温下也为液态
(3)固态:一般N(C)在17或17以上的链烃及高级衍生物。如,石蜡,
C12以上的烃
饱和程度高的高级脂肪酸甘油酯,如动物油脂在常温下为固态
★特殊:苯酚(C6H5OH)、苯甲酸(C6H5COOH)、氨基酸等在常温下亦为固态
4.有机物的颜色
☆ 绝大多数有机物为无色气体或无色液体或无色晶体,少数有特殊颜色,常见的如下所示:
☆ 三硝基甲苯( 俗称梯恩梯TNT)为淡黄色晶体;
☆ 部分被空气中氧气所氧化变质的苯酚为粉红色;
☆ 2,4,6—三溴苯酚 为白色、难溶于水的固体(但易溶于苯等有机溶剂);
☆ 苯酚溶液与Fe3+(aq)作用形成紫色[H3Fe(OC6H5)6]溶液;
☆ 多羟基有机物如甘油、葡萄糖等能使新制的氢氧化铜悬浊液溶解生成绛蓝色溶液;
☆ 淀粉溶液(胶)遇碘(I2)变蓝色溶液;
☆ 含有苯环的蛋白质溶胶遇浓硝酸会有白色沉淀产生,加热或较长时间后,沉淀变黄色。
5.有机物的气味
许多有机物具有特殊的气味,但在中学阶段只需要了解下列有机物的气味:
☆ 甲烷 无味
☆ 乙烯 稍有甜味(植物生长的调节剂)
☆ 液态烯烃 汽油的气味
☆ 乙炔 无味
☆ 苯及其同系物 芳香气味,有一定的毒性,尽量少吸入。
☆ 一卤代烷 不愉快的气味,有毒,应尽量避免吸入。
☆ 二氟二氯甲烷(氟里昂) 无味气体,不燃烧。
☆ C4以下的一元醇 有酒味的流动液体
☆ C5~C11的一元醇 不愉快气味的油状液体
☆ C12以上的一元醇 无嗅无味的蜡状固体
☆ 乙醇 特殊香味
☆ 乙二醇 甜味(无色黏稠液体)
☆ 丙三醇(甘油) 甜味(无色黏稠液体)
☆ 苯酚 特殊气味
☆ 乙醛 刺激性气味
☆ 乙酸 强烈刺激性气味(酸味)
☆ 低级酯 芳香气味
☆ 丙酮 令人愉快的气味
二、重要的反应
1.能使溴水(Br2/H2O)褪色的物质
(1)有机物
① 通过加成反应使之褪色:含有、—C≡C—的不饱和化合物
② 通过取代反应使之褪色:酚类
注意:苯酚溶液遇浓溴水时,除褪色现象之外还产生白色沉淀。
③ 通过氧化反应使之褪色:含有—CHO(醛基)的有机物(有水参加反应)
注意:纯净的只含有—CHO(醛基)的有机物不能使溴的四氯化碳溶液褪色
④ 通过萃取使之褪色:液态烷烃、环烷烃、苯及其同系物、饱和卤代烃、饱和酯
(2)无机物
① 通过与碱发生歧化反应
3Br2 + 6OH- == 5Br- + BrO3- + 3H2O或Br2 + 2OH- == Br- + BrO- + H2O
② 与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、I-、Fe2+
2.能使酸性高锰酸钾溶液KMnO4/H+褪色的物质
(1)有机物:含有、—C≡C—、—OH(较慢)、—CHO的物质
与苯环相连的侧链碳碳上有氢原子的苯的同系物(与苯不反应)
(2)无机物:与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、Br-、I-、Fe2+
3.与Na反应的有机物:含有—OH、—COOH的有机物
与NaOH反应的有机物:常温下,易与含有酚羟基、—COOH的有机物反应
加热时,能与卤代烃、酯反应(取代反应)
与Na2CO3反应的有机物:含有酚羟基的有机物反应生成酚钠和NaHCO3;
含有—COOH的有机物反应生成羧酸钠,并放出CO2气体;
含有—SO3H的有机物反应生成磺酸钠并放出CO2气体。
与NaHCO3反应的有机物:含有—COOH、—SO3H的有机物反应生成羧酸钠、磺酸钠并放出等物质的量的CO2气体。
4.既能与强酸,又能与强碱反应的物质
(1)2Al + 6H+ == 2 Al3+ + 3H2↑ 2Al + 2OH- + 2H2O == 2 AlO2- + 3H2↑
(2)Al2O3 + 6H+ == 2 Al3+ + 3H2O Al2O3 + 2OH- == 2 AlO2- + H2O
(3)Al(OH)3 + 3H+ == Al3+ + 3H2O Al(OH)3 + OH- == AlO2- + 2H2O
(4)弱酸的酸式盐,如NaHCO3、NaHS等等
NaHCO3 + HCl == NaCl + CO2↑ + H2O NaHCO3 + NaOH == Na2CO3 + H2O
NaHS + HCl == NaCl + H2S↑ NaHS + NaOH == Na2S + H2O
(5)弱酸弱碱盐,如CH3COONH4、(NH4)2S等等
2CH3COONH4 + H2SO4 == (NH4)2SO4 + 2CH3COOH
CH3COONH4 + NaOH == CH3COONa + NH3↑+ H2O
(NH4)2S + H2SO4 == (NH4)2SO4 + H2S↑
(NH4)2S +2NaOH == Na2S + 2NH3↑+ 2H2O
(6)氨基酸,如甘氨酸等
H2NCH2COOH + HCl → HOOCCH2NH3Cl
H2NCH2COOH + NaOH → H2NCH2COONa + H2O
(7)蛋白质
蛋白质分子中的肽链的链端或支链上仍有呈酸性的—COOH和呈碱性的—NH2,故蛋白质仍能与碱和酸反应。
5.银镜反应的有机物
(1)发生银镜反应的有机物:
含有—CHO的物质:醛、甲酸、甲酸盐、甲酸酯、还原性糖(葡萄糖、麦芽糖等)
(2)银氨溶液[Ag(NH3)2OH](多伦试剂)的配制:
向一定量2%的AgNO3溶液中逐滴加入2%的稀氨水至刚刚产生的沉淀恰好完全溶解消失。
(3)反应条件:碱性、水浴加热
若在酸性条件下,则有Ag(NH3)2+ + OH- + 3H+ == Ag+ + 2NH4+ + H2O而被破坏。
(4)实验现象:①反应液由澄清变成灰黑色浑浊;②试管内壁有银白色金属析出
(5)有关反应方程式:AgNO3 + NH3·H2O == AgOH↓ + NH4NO3
AgOH + 2NH3·H2O == Ag(NH3)2OH + 2H2O
银镜反应的一般通式: RCHO + 2Ag(NH3)2OH2 Ag↓+ RCOONH4 + 3NH3 + H2O
【记忆诀窍】: 1—水(盐)、2—银、3—氨
甲醛(相当于两个醛基):
HCHO + 4Ag(NH3)2OH4Ag↓+ (NH4)2CO3 + 6NH3 + 2H2O
乙二醛:
OHC-CHO + 4Ag(NH3)2OH4Ag↓+ (NH4)2C2O4 + 6NH3 + 2H2O
甲酸:
HCOOH + 2 Ag(NH3)2OH2 Ag↓+ (NH4)2CO3 + 2NH3 + H2O
葡萄糖: (过量)
CH2OH(CHOH)4CHO +2Ag(NH3)2OH2Ag↓+CH2OH(CHOH)4COONH4+3NH3 + H2O
(6)定量关系:—CHO~2Ag(NH)2OH~2 Ag HCHO~4Ag(NH)2OH~4 Ag
6.与新制Cu(OH)2悬浊液(斐林试剂)的反应
(1)有机物:羧酸(中和)、甲酸(先中和,但NaOH仍过量,后氧化)、醛、还原性糖(葡萄糖、麦芽糖)
(2)斐林试剂的配制:向一定量10%的NaOH溶液中,滴加几滴2%的CuSO4溶液,得到蓝色絮状悬浊液(即斐林试剂)。
(3)反应条件:碱过量、加热煮沸
(4)实验现象:① 若有机物只有官能团醛基(—CHO),则滴入新制的氢氧化铜悬浊液中,常温时无变化,加热煮沸后有(砖)红色沉淀生成;
② 若有机物为多羟基醛(如葡萄糖),则滴入新制的氢氧化铜悬浊液中,常温时溶解变成绛蓝色溶液,加热煮沸后有(砖)红色沉淀生成;
(5)有关反应方程式:2NaOH + CuSO4 == Cu(OH)2↓+ Na2SO4
RCHO + 2Cu(OH)2RCOOH + Cu2O↓+ 2H2O
HCHO + 4Cu(OH)2CO2 + 2Cu2O↓+ 5H2O
OHC-CHO + 4Cu(OH)2HOOC-COOH + 2Cu2O↓+ 4H2O
HCOOH + 2Cu(OH)2CO2 + Cu2O↓+ 3H2O
CH2OH(CHOH)4CHO + 2Cu(OH)2CH2OH(CHOH)4COOH + Cu2O↓+ 2H2O
(6)定量关系:—COOH~½ Cu(OH)2~½ Cu2+ (酸使不溶性的碱溶解)
—CHO~2Cu(OH)2~Cu2O HCHO~4Cu(OH)2~2Cu2O
7.能发生水解反应的有机物是:卤代烃、酯、糖类(单糖除外)、肽类(包括蛋白质)。
HX + NaOH == NaX + H2O
(H)RCOOH + NaOH == (H)RCOONa + H2O
RCOOH + NaOH == RCOONa + H2O 或
8.能跟FeCl3溶液发生显色反应的是:酚类化合物。
9.能跟I2发生显色反应的是:淀粉。
10.能跟浓硝酸发生颜色反应的是:含苯环的天然蛋白质。
三、各类烃的代表物的结构、特性
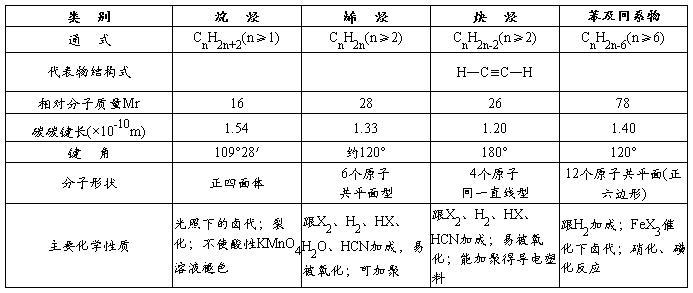
四、烃的衍生物的重要类别和各类衍生物的重要化学性质

五、有机物的鉴别 鉴别有机物,必须熟悉有机物的性质(物理性质、化学性质),要抓住某些有机物的特征反应,选用合适的试剂,一一鉴别它们。
1.常用的试剂及某些可鉴别物质种类和实验现象归纳如下:

2.卤代烃中卤素的检验 取样,滴入NaOH溶液,加热至分层现象消失,冷却后加入稀硝酸酸化,再滴入AgNO3溶液,观察沉淀的颜色,确定是何种卤素。
3.烯醛中碳碳双键的检验
(1)若是纯净的液态样品,则可向所取试样中加入溴的四氯化碳溶液,若褪色,则证明含有碳碳双键。
(2)若样品为水溶液,则先向样品中加入足量的新制Cu(OH)2悬浊液,加热煮沸,充分反应后冷却过滤,向滤液中加入稀硝酸酸化,再加入溴水,若褪色,则证明含有碳碳双键。
★若直接向样品水溶液中滴加溴水,则会有反应:—CHO + Br2 + H2O → —COOH + 2HBr而使溴水褪色。
4.二糖或多糖水解产物的检验 若二糖或多糖是在稀硫酸作用下水解的,则先向冷却后的水解液中加入足量的NaOH溶液,中和稀硫酸,然后再加入银氨溶液或新制的氢氧化铜悬浊液,(水浴)加热,观察现象,作出判断。
5.如何检验溶解在苯中的苯酚? 取样,向试样中加入NaOH溶液,振荡后静置、分液,向水溶液中加入盐酸酸化,再滴入几滴FeCl3溶液(或过量饱和溴水),若溶液呈紫色(或有白色沉淀生成),则说明有苯酚。
★若向样品中直接滴入FeCl3溶液,则由于苯酚仍溶解在苯中,不得进入水溶液中与Fe3+进行离子反应;若向样品中直接加入饱和溴水,则生成的三溴苯酚会溶解在苯中而看不到白色沉淀。
★若所用溴水太稀,则一方面可能由于生成溶解度相对较大的一溴苯酚或二溴苯酚,另一方面可能生成的三溴苯酚溶解在过量的苯酚之中而看不到沉淀。
第二篇:有机化学基础烃的衍生物
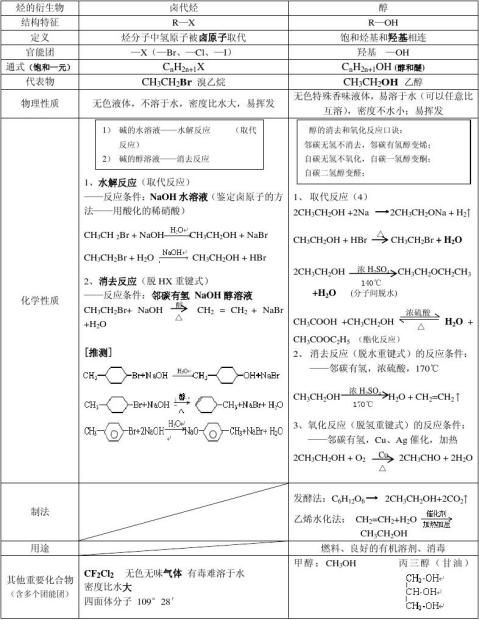
烃的衍生物——结构、性质、制法、用途
1
烃的衍生物——结构、性质、制法、用途
2
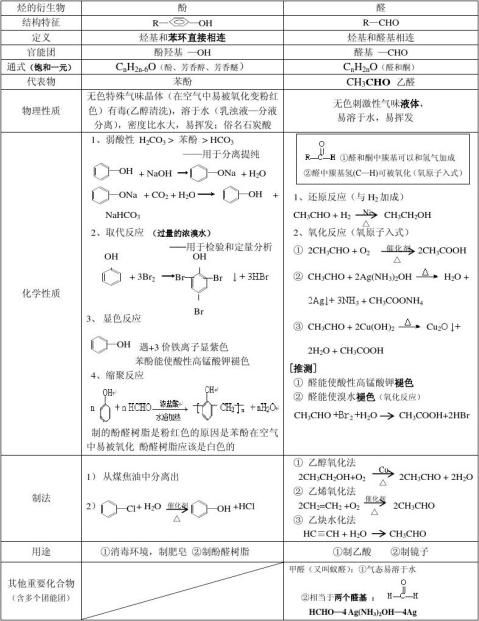
烃的衍生物——结构、性质、制法、用途
3
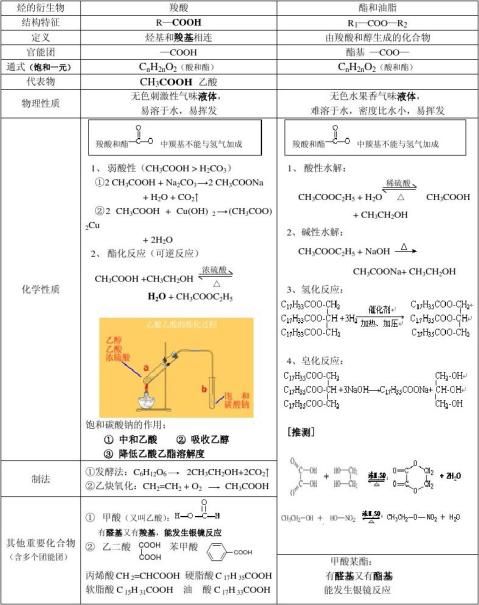
-
高中化学有机知识点总结
练习101、有机物的正确命名为()A、2-乙基-3,3-二甲基-4-乙基戊烷B、3,3-二甲基-4-乙基戊烷C、3,3,4-三甲基…
-
有机化学知识点总结
一类别异构的常见情况烯烃环烷烃炔烃二烯烃环烯苯及苯的同系物多烯饱和一元醇和醚酚类芳香醇芳香醚醛酮烯醇环氧烷烃羧酸酯羟基醛硝基化合物…
-
高中化学有机物知识点总结
高中化学有机物知识点总结1、各类有机物的通式、及主要化学性质烷烃CnH2n+2仅含C—C键与卤素等发生取代反应、热分解、不与高锰酸…
-
高一化学有机物知识点总结
1、各类有机物的通式、及主要化学性质烷烃CnH2n+2仅含C—C键与卤素等发生取代反应、热分解、不与高锰酸钾、溴水、强酸强碱反应烯…
-
高一化学必修二有机物知识点总结
必修二有机物一、有机物的概念1、定义:含有碳元素的化合物为有机物(碳的氧化物、碳酸、碳酸盐、碳的金属化合物等除外)2、特性①种类多…
-
有机化学基础方程式总结
一、脂肪烃1.烷烃化学性质:不与强酸、强碱、强氧化剂和强还原剂反应,不能使溴的四氯化碳溶液或酸性高锰酸钾溶液褪色。(1)取代反应C…
-
大学有机化学复习总结
有机化学复习总结一、有机化合物的命名命名是学习有机化学的“语言”,因此,要求学习者必须掌握。有机合物的命名包括俗名、习惯命名、系统…
-
高中有机化学基础知识总结概括
高中有机化学基础知识总结概括1、常温常压下为气态的有机物:1~4个碳原子的烃,一氯甲烷、新戊烷、甲醛。2、碳原子较少的醛、醇、羧酸…
-
湖南农大20xx有机化学期末复习总结
有机化学期末复习总结本课程的学习即将结束,现将全书的重点内容按命名、基本反应、化合物转化及合成方法、推断等几个专题进行总结归纳,供…
-
高中有机化学基础知识总结概括
高中有机化学基础知识总结概括1常温常压下为气态的有机物14个碳原子的烃一氯甲烷新戊烷甲醛2碳原子较少的醛醇羧酸如甘油乙醇乙醛乙酸易…