20xx届药学专业本科生毕业论文
本科生毕业论文(设计)
题 目: 白藜芦醇对亚硝酸盐的清除及亚硝胺阻断作用研究 姓 名: 刘玉锋 学 院: 食品药品学院 专 业: 药物制剂 班 级: 09级2班 学 号: 2303090213 指导教师: 张孝林 职称: 讲师
20xx年12月30日
安徽科技学院教务处制


目 录
摘要 ······························································································································· 1 关键词 ··························································································································· 1 前言 ······························································································································· 1 1试剂和仪器 ················································································································ 2
1.1试剂 ························································································································ 2
1.2仪器 ························································································································ 2 2 原理 ··························································································································· 2
2.1亚硝酸钠的清除率的测定 ···················································································· 2
2.2阻断亚硝胺合成的原理 ························································································ 2 3实验方法 ···················································································································· 3
3.1溶液的配制 ············································································································ 3
3.2 NaNO2 标准液的制备及吸光度的测定 ································································ 3
3.3不同浓度白藜芦醇溶液在pH=3时对亚硝酸钠的清除率的测定 ······················ 4
3.4不同浓度白藜芦醇溶液在pH=3时对亚硝胺合成的阻断率测定 ······················ 4 4 结果及分析 ··············································································································· 5
4.1 NaNO2溶液的标准曲线的绘制·············································································· 5
4.2不同浓度的白藜芦醇在pH=3时对亚硝酸钠的清除率及对亚硝胺的阻断率 ·· 5 5讨论及结论 ················································································································ 7 致谢 ······························································································································· 7 参考文献 ······················································································································· 8 英文摘要 ······················································································································· 9
安徽科技学院 食品药品学院 本科毕业论文
白藜芦醇对亚硝酸盐的清除及亚硝胺阻断作用研究
药物制剂 :刘玉锋
指导老师 :张孝林
摘要:目的:以亚硝酸盐的清除率和亚硝胺合成的阻断率为指标,研究不同浓度的白藜芦醇
在酸性下对亚硝酸盐的清除和对亚硝胺合成的阻断作用。方法:分别配制0.1mg/mL、
0.2mg/mL 、0.4mg/mL 、0.8mg/mL 、0.16mg/mL、0.32mg/mL和0.64mg/mL浓度的白藜芦醇
溶液和5ug/mL亚硝酸钠溶液,在pH=3模拟胃酸条件下,采用分光光度法,分别测定不同浓度
的白藜芦醇对亚硝酸钠的清除率及亚硝胺生成的阻断率[1]。结果:在酸性条件下,不同浓度
的白藜芦醇对亚硝酸钠均有较强清除作用,在浓度小于0.32 mg/mL时随着浓度增大而增大,最大达到63.48%。同时对亚硝胺的生成有较强的阻断率,最大达到40.94%。结论:白藜芦
醇对亚硝酸盐有很强的清除能力,对亚硝胺的生成有较强的阻断能力。
关键词:亚硝酸盐,白藜芦醇,分光光度法,亚硝胺,清除,阻断 前言
癌症是当前威胁人类生活的最大杀手, 根据世界卫生组织统计, 全世界每年约有 500万左右的人被癌症夺去生命。在致癌物中, 亚硝胺是最令人关注的一类化学致癌物质。亚硝酸盐作为一种发色剂和防腐剂[2],在肉制品加工中得到了普遍的应用[3] 。许多蔬菜中天然含有的硝酸盐,在人体内通过细菌的作用也可被还原为亚硝酸盐。亚硝酸盐是合成亚硝胺的前体之一[4],人体内的这些亚硝酸盐在一定条件下可以与食物中的仲胺、叔胺等形成亚硝胺。N-亚硝基化合物是一种致癌性很强的化合物[5],已研究的近300种N-亚硝基化合物中,约90%以上具有动物致癌性,并证明N-亚硝基化合物可在体内外由前体物胺类与硝酸盐或亚硝酸盐形成[6]。在体内代谢过程中,特别是在胃液中容易形成亚硝胺[7]。因此,降低胃内的亚硝酸盐含量及阻断亚硝胺前提的合成从而达到防癌抗癌的目的是人类同癌症斗争的有效途径之一,而白藜芦醇在这方面的研究鲜见报道。
白藜芦醇(resveratrol,简称Res)是非黄酮类的多酚化合物,日本人Tokaoka 19xx年首次从毛叶藜芦的根部分离得到。19xx年Nonomura等提出白藜芦醇是某些草药治疗炎症、脂类代谢紊乱和心脏疾病等的有效成分,是存在于植物中的天然抗氧化剂,如葡萄、虎杖等[8]被列为抗心血管、抗癌最有前景的药物之一。白藜芦醇具有优良的药理活性和保健功能,其市场需求很大且与日剧增。目前,已有大部分国家和地区都开发了白藜芦醇的相关保健品和其他产品。中国已将含白藜芦醇的植物提取物制成降脂美容的天然保健食品,美国也已把白藜芦醇作为膳食补充剂,日本已将从植物提取的白藜芦醇作为食品添加剂[9]。白藜芦醇的药理功能引起了人们的广泛兴趣,因为它涉及到与人体健康密切相关的许多生理疾病,例如,动脉粥样化、老年痴呆症、病毒性肝炎、胃溃疡、炎症与过敏反应
1 [7]
安徽科技学院 食品药品学院 本科毕业论文 等。随着人们对白藜芦醇的深入研究,已经显示白藜芦醇具有抗癌、抗氧化、抗菌、抗炎以及预防食物过敏等作用,可广泛地应用于医药、保健品、食品、化妆品等领域。所以,对白藜芦醇的研究及开发,特别是白藜芦醇对亚硝酸盐的清除及阻断作用具有良好的市场前景及重要的意义。
1 试剂和仪器
1.1试剂
白藜芦醇(纯度99%,购于陕西西慈生物技术有限公司)、蒸馏水、二乙胺盐酸盐、二水合柠檬酸三钠、十二水合磷酸氢二钠、二甲胺盐酸盐、磷酸二氢钠(均为AR,购于国药集团化学试剂有限公司)、 亚硝酸钠(AR,淮化试剂厂)、无水对氨基苯磺酸(AR,上海山浦化工有限公司)、95%乙醇、氢氧化钠、盐酸(均为AR,合肥工业大学化学试剂厂)
1.2 仪器
紫外可见分光光度计 UV-5500PC型(上海元析仪器有限公司)、电子分析天平(上海精密科学仪器有限公司)、恒温水浴锅(江苏省金坛市荣华仪器制造有限公司)、超净工作台(苏州苏净有限公司)
2 原理
2.1 亚硝酸钠的清除率的测定[10]
亚硝酸钠在弱酸性的条件下, 能与氨基苯磺酸重氮化后, 再与 N -1-萘乙二胺盐酸盐偶合生成红色的化合物,本实验通过测定相同条件下亚硝酸钠含量的变化来反映白藜芦醇对亚硝酸根离子的清除能力,并计算清除率:
清除率=( A 0 - A x ) / A0×100%
A 0—没有加入白藜芦醇的亚硝酸钠溶液空白实验的吸光度值;
A x—加入不同浓度白藜芦醇溶液时的反应液的平均吸光度值。
温度为37℃在pH=3的条件下,当用相同量的亚硝酸钠溶液同具有一定浓度梯度的白藜芦醇溶液反应后,再测量吸光度。吸光度越小,溶液中残存的亚硝酸钠含量就越小,表明白藜芦醇对亚硝酸盐的清除率越高;反之,表明白藜芦醇对亚硝酸盐的清除率越低。
2.2 阻断亚硝胺合成的原理[11]
二甲胺与亚硝酸钠在 37℃条件下, 可适宜地生成二甲基亚硝胺, 反应式如下:
(CH3)2NH+NaNO23)2NH·NO + NaCl + H2O
其实质为:
2
安徽科技学院 食品药品学院 本科毕业论文 (CH3)23)2NH·NO + H2O
当往白藜芦醇溶液中依次加入二甲胺与亚硝酸钠时, 白藜芦醇优先同亚硝酸钠作用, 使得二甲胺不能与亚硝酸钠反应, 达到阻止二甲基亚硝胺生成的目的。据此可以比较相同条件下生成二甲基亚硝胺量的多少来反映白藜芦醇阻断能力的强弱, 生成二甲基亚硝胺量少, 白藜芦醇的阻断能力就强, 反之则弱。在紫外光照射下, 二甲基亚硝胺可分解成二甲基仲胺和亚硝酸根, 反应式如下:
H2O + (CH3)2N-N=O 紫外光 (CH3)2NH2+ + NO2-
亚硝酸根与对氨基苯磺酸重氮化后, 再与1-萘胺偶合生成红色化合物。用紫外分光光度计测出该红色化合物的吸光度值可反映出溶液中亚硝酸根离子的含量,亚硝酸根离子的含量可反映出原来溶液中二甲基亚硝胺含量的多少。
3 方法
3.1 溶液的配制
3.1.1 0.4%对氨基苯磺酸溶液的配制:用分析天平精确称取对氨基苯磺酸0.4g充分溶解
后,定容至100mL。
3.1.2 0.2%盐酸萘乙二胺溶液的配制:精确称取盐酸萘乙二胺0.2g充分溶解后,定容至
100mL。
3.1.3 0.1% 1-萘胺溶液的配制:精确称取1-萘胺0.1g充分溶解后,定容至100mL。
3.1.4 浓度为1mmol/L的二甲胺盐酸盐溶液的配制:精确称取二甲胺盐酸盐0.08541g充
分溶解后,定容至100mL。
3.1.5 浓度为1mmol/L的亚硝酸钠溶液的配制:精确称取亚硝酸钠0.069g充分溶解后,
定容至1000mL。
3.1.6不同浓度的白藜芦醇溶液的配制:精确称取64mg白藜芦醇,置于烧杯中,加适量
95%乙醇溶解,用蒸馏水定容于100mL 容量瓶中,配制成0.64mg/mL的白藜芦醇溶液并标记为7号容量瓶,再分别稀释配制成0.01mg/mL、0.02mg/mL、0.04mg/mL 、0.08mg/mL 、0.16 mg/mL和0.32mg/mL白藜芦醇溶液,分别标记为1,2,3,4,5,6号容量瓶,避光保存,备用。
3.2 NaNO2标准液的制备及吸光度的测定
NaNO2标准液制备:用天平精确称取亚硝酸钠20mg,充分溶解后,定容至1L即得20 mg/L的 NaNO2溶液。然后准确取20 mg/ L的 NaNO2溶液250mL于一1L的容量瓶中并用蒸
3 [12]
安徽科技学院 食品药品学院 本科毕业论文 馏水稀释、定容至刻度,摇匀后得到浓度为5ug/mL的NaNO2标准液。NaNO2标准曲线的绘制:分别准确吸取浓度为5ug/mL的NaNO2标准液0mL,0. 2mL ,0. 4mL , 0. 6mL ,0.8mL,1. 0mL ,1. 5mL ,2. 0 mL置于10 mL具塞试管中,并分别编号为0,1,2,3,4,5,6,7号试管。然后分别向各试管中加入0. 4%对氮基苯磺酸1 mL,摇匀,静置3—5 min,再加入0. 2 %的盐酸萘乙二胺溶液0.5 mL ,用水稀释至刻度,摇匀得到浓度分别为0 ug/mL,0.1ug/mL,0.2ug/mL, 0.3ug/mL,0.4 ug/mL, 0.5ug/mL, 0.75ug/mL, 1.0ug/mL的NaNO2溶液,将所得到的溶液静置15 min后,亚硝酸根离子在538 nm下存在最大吸收峰,因此,本实验在538 nm下测定其吸光度的值,绘制NaNO2标准曲线。
3.3 不同浓度的白藜芦醇溶液在pH=3时对亚硝酸钠的清除率的测定[13]
取8个10mL具塞试管,分别标记为0,1,2,3,4,5,6,7号试管,依次向各试管中加入5ug/mL的NaNO2 的溶液1mL。然后分别取0,1,2,3,4,5,6,7号100mL容量瓶中的白藜芦醇溶液分别依次向0,1,2,3,4,5,6,7号具塞试管中顺序加入1mL, 并依次向各试管中分别加入1mL pH=3.0 的柠檬酸钠-盐酸缓冲液[14], 之后将8个试管置于37 ℃恒温水浴槽中反应1小时。反应结束后,取出试管后立即分别向8个试管中加入质量分数为0.4% 的对氨基苯磺酸溶液各1mL,摇匀静置3至5分钟后,再向各试管加入质量分数为0. 2%盐酸萘乙二胺溶液各1mL , 摇匀放置15 min 后, 用分光光度计在 538 nm 处分别测出0,1,2,3,4,5,7号试管反应液吸光度值(A),其中以加入除白藜芦醇溶液和亚硝酸钠溶液外其他所有等量的其他试剂的溶液作为参比溶液,每个浓度配制3个样品测量吸光度求平均值。根据下列公式求得白藜芦醇对亚硝酸根离子的清除率:
清除率= ( A 0 - A x ) / A0×100%
A 0—没有加入白藜芦醇溶液的试管中NaNO2 的吸光度值,即0号试管的吸光度值; A x—加入不同浓度白藜芦醇溶液反应后试管中NaNO2的吸光度值。
3.4 不同浓度的白藜芦醇溶液在pH=3时对亚硝胺合成的阻断率测定[11]
取8个10mL具塞试管,分别标记为0,1,2,3,4,5,6,7号试管。分别取0,1,2,3,4,5,6,7号100mL容量瓶中的白藜芦醇溶液分别依次向0,1,2,3,4,5,6,7号具塞试管中顺序加入0.5mL, 然后再依次向各试管中分别加入1mL pH= 3.0 的柠檬酸钠-盐酸缓冲液,然后依次向各试管加入1mmol/mL的NaNO2的溶液1mL,再向各试管加入1mmol/mL的二甲胺溶液1mL。用蒸馏水将各试管定容刻度为8mL,将各试管置于37℃恒温水浴槽中反应1 小时。反应结束后,置于紫外分析仪上照15 min , 取出后加1%的对氨基苯磺酸溶液1mL,再加0.1%的1-萘胺1mL,然后摇匀放置15min后, 用分光光度计在525nm 处测吸光度值(A) ,其中以加入除白藜芦醇溶液和亚硝酸钠溶液外其他所有试剂的溶液为参比溶液,每个浓度配制3个样品测量吸光度求平均值。根据下列公式求得白藜芦醇对亚硝胺合成的阻断率:
阻断率= ( A 0 - A x ) / A 0×100%
A 0 —没有加白藜芦醇溶液试管中NaNO2 的吸光度值,即0号试管的吸光度值;
A x —加入不同浓度的白藜芦醇溶液后试管中NaNO2 的吸光度值。
4
安徽科技学院 食品药品学院 本科毕业论文 4 结果及分析
4.1 NaNO2溶液的标准曲线的绘制:
NaNO2标准液在538 nm下测定其吸光度的值如表1所示,标准曲线如图1所示。从标准曲线可NaNO2知在浓度0.1-1 ug/mL存在很好的线性关系,随着亚硝酸根离子浓度的增大吸光度增大。
表1 NaNO2标准液的吸光度
Table 1 The absorbance of standard solution of NaNO2
序号
浓度(ug/mL)
吸光度 A 0.004 0.007 0.011 0.014 0.017 0.025 0.034 0.1 0.2 0.3 0.4 0.5 0.75 1 1 2 3 4 5 6 7
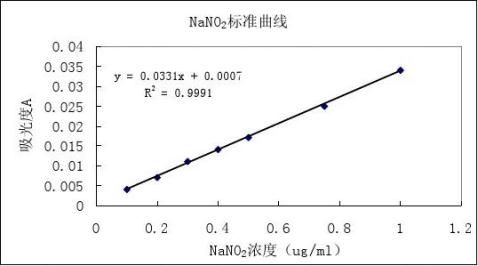
图1 NaNO2标准曲线
Figure 1Thestandard curve of NaNO2
4.2 不同浓度的白藜芦醇在pH=3时对亚硝酸钠的清除率及对亚硝胺的阻断率
从表2和图2可知,白藜芦醇浓度在0.01-0.32mg/mL时,对亚硝酸根离子的清除率随着浓度的增大而增大,对亚硝酸根离子的清除率最大达到63.48%。随后对亚硝酸根离子的清除率并不再继续随着浓度的增大显著增加。
表2 pH=3时不同浓度白藜芦醇对亚硝酸钠的清除率
Table 2 The rate of resveratrol at different concentrations clearing sodium nitrate under
PH=3
5
安徽科技学院 食品药品学院 本科毕业论文
序号
白藜芦醇浓度0 1 2 3 4 5 6 7
(mg/mL)
清除率(%) 0.00 0.01 0.02 0.04 0.08 0.16 0.32 0.64 18.44 28.72 34.75 39.01 43.43 63.48 63.49
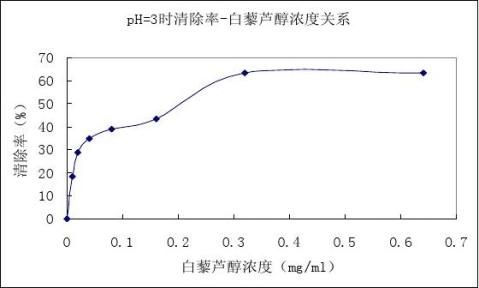
图2 pH=3时不同浓度白藜芦醇对亚硝酸钠的清除率
Figure 2 The clearing rate of NaNO2 on resveratrol with different concentrations at PH=3
从表3和图3可知,白藜芦醇浓度在0.01-0.32mg/mL时,对亚硝胺的阻断率随着浓度的增大而增大,对亚硝胺的阻断率最大达到40.94%。随后对亚硝胺的阻断率并不再继续随着浓度的增大显著增加。
表3 pH=3时不同浓度白藜芦醇对亚硝胺的阻断率
Table 3 The blocking of nitrosamine on resveratrol with different concentrations at PH=3
序号 白藜芦醇浓度
(mg/mL) 阻断率(%) 0.00 8.39 12.75 17.11 24.16 31.21 40.94 40.96 0.01 0.02 0.04 0.08 0.16 0.32 0.64 0 1 2 3 4 5 6 7
6
安徽科技学院 食品药品学院 本科毕业论文

5
安徽科技学院 食品药品学院 本科毕业论文
参考文献
[1] 王广健.亚硝酸根偶联反应及其应用于光度法测定亚硝酸根离子[J].分析化学.1998.26(4:):495-497.
[2] 李冬梅.降低肉制品中的亚硝酸盐含量[J].肉类加工.1997,(3):16-19.
[3] 谭燕,庄松娟.肉制品中亚硝酸盐国标测定方法的探讨.2005,(7):26-28.
[4] 曹会兰.亚硝酸盐对人体的危害和预防[J].微量元素与健康研究,2003,(2):78-80.
[5] 徐国平.蔬菜、水果对N-亚硝基化合物致癌的预防作用[J].国外医学:卫生学分册,1989,(2):93-94.
[6] 许后效.环境中的N-亚硝基化合物[M].北京:科学出版社,1988:59-65.
[7] 褚衍信,冯华进.亚硝酸根清除剂体外研究的新方法及其应用[J].癌症,1994,13(5):470-471.
[8] 李延华,王伟君.白藜芦醇的研究现状及应用前景[J].中国酿造,2008.7:10-12.
[9] 高年发,姜丽等.葡萄酒发酵过程中白藜芦醇含量变化的研究[J].酿酒科技,2006(12):33-36.
[10] 赵二劳,王晓妮,张海容等.山楂清除亚硝酸盐及阻断亚硝胺合成的研究[J].食品与发酵工
业,2006,32(10):29-31.
[11] 黄高凌,翁聪泽,倪辉等.琯溪蜜柚果皮提取物抑制亚硝化反应的研究[J].食品科学,2007(12):36-39.
[12] 张平,叶文慧,石志华.姜汁对亚硝酸盐清除作用的研究[J].黑龙江八一农垦大学学报,2005,17(4):73-75.
[13] 王威.4种辛辣蔬菜抗氧活性的研究.食品与发酵工业.2001,(5):123-126.
[14] 勃拉特AH.有机合成(第二集)(中译本)[M].北京科学出版社,1964,321.
8
安徽科技学院 食品药品学院 本科毕业论文
The study of resveratrol's ability on clearing sodium nitrate and
blocking nitrosamine
Yufeng Liu,Xiaolin Zhang
School of Food and Drug, Anhui Science and Technology University, Fengyang 233100, Anhui,
China
Abstract:Objective:It is the indicator to study the different concentrations of resveratrol in the acidic environment and alkaline environment , clearing nitrite and blocking nitrosamine,which includes the clearing rate of nitrite and the blocking rate of nitrosamine. Methods:Preparing concentrations of resveratol solution differently,which is at 0.1mg/mL, 0.2mg/mL, 0.4mg/mL, 0.8mg/mL, 0.16mg/mL, 0.32mg/mL and 0.64mg/mL and the concentration of sodium nitrate solution,which is at 5ug/mL, simulating gastric conditions under PH=3, different concentrations of resveratrol’s clearing rate of nitrite and blocking rate [1]of nirosamine are measured by spectrophotometry respectively. Results:Under acidic conditions, different concentrations of resveratrol all have strong scavenging effect on sodium nitrate at concentrations less than 0.32mg/mL,which is increased as the concentration increases , and up to 63.48%.Meanwhile , the rate of blocking the formation of nitrosamine is high , and up to 4.94%. Conclusion: Resveratrol have a strong ability to clear sodium nitrateand block the formation of nitrosamine. Keywords: nitrite, resveratrol, spectrophotometry, nitrosamines, clear, blocking
9
-
药学专业毕业论文格式
浙江大学远程教育学院本科生毕业论文设计题目专业学习中心姓名学号指导教师20年月日药学1论文摘要药品集中招标采购推行5年来在规范医药…
-
药学毕业论文范文.doc1
药学服务与医用指导通辽职业学院药学院06级药学二班王冬岩指导教师杨光摘要药学服务是一种实践不仅仅只停留在理论上同时必须在患者治疗过…
-
药学毕业论文范文[1].doc1
药学服务与医用指导摘要药学服务是一种实践不仅仅只停留在理论上同时必须在患者治疗过程中实施并获得效果不管是预防性的治疗性的或恢复性的…
-
药学的毕业论文格式
20xx电大届秋季药学专业毕业论文浅谈药品不良反应与安全用药李永梅【关键词】合理的用药随着社会的发展,如何安全、有效、合理的用药已…
-
药学系本科毕业论文范本
药学系本科毕业论文范本封面:学号:(宋体,小4号)福建中医学院届药学系本科生毕业论文(宋体,4号,居中)中文题目(宋体,小2号,居…
-
医学系药学专业毕业论文模板
医学系药学专业09级同学:一、毕业论文课题某制剂制备工艺研究或探讨;某制剂某工艺研究或探讨等二、毕业论文内容和目标通过在制药企业实…
-
药学院本科生毕业论文统一格式规定与相关要求
药学系本科毕业论文基本要求与一般格式一、毕业论文的基本要求:要求毕业论文对所研究的课题有独特见解,富有新意或有较深刻的分析阐述过程…
-
20xx届药学学生毕业论文实施具体安排
20xx届药学系学生毕业论文实施具体安排1、选题时间:20xx年x月x日至20xx年x月x日要求:一人一题,课题要与实际相结合。鼓…
-
药学专业毕业论文题目方向目录费下载
药学专业毕业论文题目方向目录1马晓微1、药剂学实验2、药品生产研究3、药品经营研究4、医院药学研究5、药事管理研究2王珏1、药理、…
-
0-江苏大学继续教育学院药学专业本科毕业论文注意事项
江苏大学继续教育学院药学专业本科毕业论文注意事项毕业论文应力求做到选题新颖,主题鲜明,观点正确,方法科学,技术先进,层次分明,论述…
-
药学系本科毕业论文范本
药学系本科毕业论文范本封面:学号:(宋体,小4号)福建中医学院届药学系本科生毕业论文(宋体,4号,居中)中文题目(宋体,小2号,居…