高中化学平衡试题(详细答案)
化学平衡反应试题
1.在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,不能说明反应A(s)+2B(g)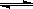 C(g)+D(g)已达平衡状态的是
C(g)+D(g)已达平衡状态的是
A.混合气体的压强 B.混合气体的密度
C.气体的平均相对分子质量 D.B的物质的量浓度
【答案】A
【解析】在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项D可以说明。分解反应式可知,反应前后体积不变,所以压强和气体的物质的量都是不变的,因此A不正确;密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但质量水变化的,所以选项B可以说明;混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,物质的量不变,但质量是变化的,所以选项C也可以说明。答案选A。
2.下列说法中,可以证明反应N2+3H2 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
A.3v(H2) = 2v(NH3) B.3v正(H2) = 2v逆(NH3)
C.3v(N2) = v(H2) D.2v正(N2) = v逆(NH3)
【答案】D
【解析】在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。所以如果反应速率的方向相反,且满足反应速率之比是相应的化学计量数之比,则就能说明反应已经达到平衡状态,因此根据方程式可知,选项D正确。
3.一定温度下的恒容容器中,发生反应A(s)+2B(g)=当C(g)+D(g),下列能表示该反应已达平衡状态的是
A.2v(B)正=V(D)逆
B.混合气体的密度保持不变
C.气体总物质的量不随时间变化而变化
D.混合气体的压强不随时间变化而变化
【答案】B
【解析】在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。A中反应速率的方向相反,但不满足速率之比是相应的化学计量数之比,不正确。密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但质量是变化的,所以B正确;根据方程式可知,反应前后体积是不变的,所以气体的物质的量和压强都是不变的,因此CD不正确,答案选B。
4.在一定条件下,可逆反应X(g)+3Y(g)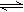 2Z(g)达到平衡时有50%的Y转化为气体Z,若X的转化率为25%,则起始时充入容器的X与Y的物质的量之比应为( )
2Z(g)达到平衡时有50%的Y转化为气体Z,若X的转化率为25%,则起始时充入容器的X与Y的物质的量之比应为( )
A. 3:2 B. 2:3 C. 1:3 D. 1:2
【答案】B
【解析】设起始时充入容器的X与Y的物质的量分别是x和y,则根据方程式可知0.25x︰0.5y=1︰3,解得x︰y=2︰3,答案选B。
5.一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是 ( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是 ( )
A.c1∶c2=3∶1
B.平衡时,Y和Z的生成速率之比为2∶3
C.c1的取值范围为0.04 mol/L<c1<0.14 mol/L
D.X、Y的转化率相等
【答案】D
【解析】根据方程式可知, ,解得c1∶c2=1∶3,即二者的起始浓度之比恰好等于相应的化学计量数之比,所以X、Y的转化率相等,A不正确,D正确;反应速率之比是相应的化学计量数之比,所以平衡时,Y和Z的生成速率之比为3∶2,B不正确;如果反应向正反应方向进行,则(c1-0.1)×2=0.08-c3,解得c1<0.14 mol/L。如果反应向逆反应方向进行,则c1只要大于0即可,所以选项C也不正确,答案选D。
,解得c1∶c2=1∶3,即二者的起始浓度之比恰好等于相应的化学计量数之比,所以X、Y的转化率相等,A不正确,D正确;反应速率之比是相应的化学计量数之比,所以平衡时,Y和Z的生成速率之比为3∶2,B不正确;如果反应向正反应方向进行,则(c1-0.1)×2=0.08-c3,解得c1<0.14 mol/L。如果反应向逆反应方向进行,则c1只要大于0即可,所以选项C也不正确,答案选D。
6.某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g) C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则 ( )
C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则 ( )
A.a=3 B.a=2
C.B的转化率为40% D.B的转化率为60%
【答案】C
【解析】温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,说明反应前后气体的体积是不变的,即a=1。设平衡时消耗A和B都是x,则生成C和D都是x,所以有 ,解得x=1.2mol,所以B的转化率是1.2÷3=0.4,答案选C。
,解得x=1.2mol,所以B的转化率是1.2÷3=0.4,答案选C。
7.某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)  2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则( )
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则( )
A.平衡不移动 B.再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C.再达平衡时,C的体积分数增大 D.再达平衡时,正反应速率增大,逆反应速率减小
【答案】C
【解析】保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,相当于缩小容器的容积,增大压强,平衡向正反应方向移动,所以选项C正确,其余都是错误的。
8.在一个不导热的密闭反应器中,只发生两个反应:
a(g)+b(g)  2c(g) △H1<0; x(g)+3y(g)
2c(g) △H1<0; x(g)+3y(g)  2z (g) △H2>0
2z (g) △H2>0
进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是( )
A.等压时,通入惰性气体,c的物质的量不变
B.等压时,通入z气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入z气体,y的物质的量浓度增大
【答案】A
【解析】等压时,通入惰性气体,则容器容积扩大,物质的浓度减小,前者平衡不移动,后者平衡向逆反应方向,反应放热,因此温度升高,所以导致前者向逆反应方向移动,c的物质的量增加,A不正确;等压时,通入z气体,平衡向逆反应方向,反应放热,因此温度升高,B正确;等容时,通入惰性气体,浓度不变,平衡不移动,C正确;等容时,通入z气体,平衡向逆反应方向,y的浓度增大,D正确,答案选A。
9.下列事实中不能用勒夏特列原理来解释的是( )
A.向H2S水溶液中加入NaOH有利于S2-增多
B.鼓入过量空气有利于SO2转化为SO3
C.高压对合成氨有利
D.500 ℃左右比室温更有利于合成氨的反应 (合成氨反应是放热反应)
【答案】D
【解析】如果改变影响平衡的一个条件,则平衡就向能够减弱这种改变的方向进行,这就是勒夏特列原理,该原理适用于所有的平衡体系。氨气的合成是放热反应,根据勒夏特列原理可知,高温不利于氨气的合成,所有答案选D。
10.可逆反应:3A(g)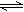 3B(?)+C(?)(△H>0),随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
3B(?)+C(?)(△H>0),随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
A. B和C可能都是固体 B. B和C只能有一个是气体
C. B和C一定都是气体 D. 若C为固体,则B一定是气体
【答案】D
【解析】混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,由于正反应是吸热反应,所以升高温度,平衡向正反应方向移动,所以如果BC都是气体,则可能正确。如果BC都不是气体,则相对分子质量不变。如果C是固体,B是气体,也是正确的,因此正确的答案选D。
11.在可逆反应:X(g)+2Y(g)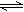 2Z(g)(△H>0),为了有利于Z的生成,应采用的反应条件是( )
2Z(g)(△H>0),为了有利于Z的生成,应采用的反应条件是( )
A. 高温高压 B. 高温低压 C. 低温高压 D. 低温低压
【答案】A
【解析】根据方程式可知,该反应是体积减小的、吸热的可逆反应,所以要有利于Z的生成,应该是高温高压,答案选A。
12.在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是
A.平衡向正反应方向移动了 B.物质A的转化率增大了
C.物质B的质量分数增加了 D.a>b
【答案】D
【解析】将容器体积增加一倍的瞬间,B的浓度是原来的50%。但最终平衡时B的浓度是原来的60%,这说明降低压强平衡向正反应方向移动,所以正反应是体积增大的,即a小于b,所以答案选D。
13.某温度时,一定压强下的密闭容器中发生反应:aX(g)+bY(g)  cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是( )
cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是( )
A. 平衡正移 B. (a+b)>(c+d)
C. Z的体积分数变小 D. X的转化率变大
【答案】C
【解析】保持温度不变压强增大至原来的2倍的瞬间,W的浓度为原平衡状态的2倍,但最终平衡时,W的浓度为原平衡状态的1.8倍,这说明增大压强,平衡向逆反应方向移动,即正反应是体积增大的,因此选项C正确,其余都是错误的,答案选C。
14.在密闭容器中进行反应:X2(g)+Y2(g) 2Z(g)。已知X2、Y2、Z起始浓度分别为0.1mol/L、0.3mol/L 、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度不可能是( )
2Z(g)。已知X2、Y2、Z起始浓度分别为0.1mol/L、0.3mol/L 、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度不可能是( )
A. Z为0.3mol/L B. Y2为0.35mol/L
C. X2为0.15mol/L D. Z为0.4mol/L
【答案】D
【解析】由于是可逆反应,转化率达不到100%,所以选项ABC都是可能的,选项D不可能,因为此时物质X2的浓度为0,答案选D。
15.某反应2AB(g) C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的正反应的ΔH、ΔS应为( )
C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的正反应的ΔH、ΔS应为( )
A.ΔH>0,ΔS>0 B.ΔH<0,ΔS<0 C.ΔH<0,ΔS>0 D.ΔH>0,ΔS<0
【答案】A
【解析】根据方程式可知,正反应是熵值增大的。由于正反应在高温下自发进行,所以根据△G=△H-T·△S可知,正反应是吸热反应,答案选A。
16.一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图的是
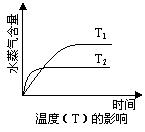
A.CO2(g) + 2NH3(g) CO(NH2)2(s) + H2O(g); △H<0
CO(NH2)2(s) + H2O(g); △H<0
B.CO2(g) + H2(g) CO(g) + H2O(g); △H>0
CO(g) + H2O(g); △H>0
C.CH3CH2OH (g) CH2=CH2(g) + H2O(g); △H>0
CH2=CH2(g) + H2O(g); △H>0
D.2C6H5CH2CH3(g) + O2(g) 2 C6H5CH=CH2(g) + 2H2O(g); △H<0
2 C6H5CH=CH2(g) + 2H2O(g); △H<0
【答案】A
【解析】A中反应是体积减小的、放热的可逆反应,所以温度越低、压强越大,水蒸气的含量越高,正确、B中反应前后体积不变,改变压强平衡不移动,不正确。C中是吸热反应,升高温度,水蒸气的含量增大,不正确。D中反应是体积增大的,增大压强平衡向逆反应方向移动,水蒸气含量降低,不正确,答案选A。
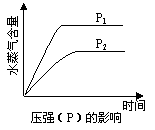
17.反应2X(g)+Y(g)  2Z(g) ΔH在不同温度(T1、T2)及压强(P1、P2)下产物Z的物质的量n(Z)与反应时间(t)的关系如下图所示,下列判断正确的是
2Z(g) ΔH在不同温度(T1、T2)及压强(P1、P2)下产物Z的物质的量n(Z)与反应时间(t)的关系如下图所示,下列判断正确的是
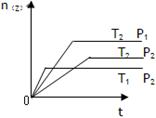
A.T1<T2 P1<P2 ΔH<0
B.T1<T2 P1>P2 ΔH>0
C.T1>T2 P1>P2 ΔH<0
D.T1>T2 P1<P2 ΔH>0
【答案】C
【解析】反应是体积减小的可逆反应,所以增大压强平衡向正反应方向移动,即Z的物质的量增加,所以根据图像可知,当温度相同时,P1大于P2。当压强相同时,温度为T1的首先平衡,说明温度是T1大于T2。但温度越高,Z的量越少。说明升高温度,平衡向逆反应方向移动,因此正反应是放热反应,答案选C。
18.反应A(g)+2B(g)=C(g)的反应过程中能量变化如右下图所示。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。下列相关说法正确的是

A.该反应是吸热反应
B.催化剂改变了该反应的焓变
C.催化剂降低了该反应的活化能
D.该反应的焓变△H=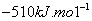
【答案】C
【解析】根据图像可知,反应物的能量高于生成物的,因此是放热反应,A不正确;催化剂能降低反应的活化能,但不能改变反应热,因此C正确,B不正确;反应热是419kJ/mol-510kJ/mol=-91kJ/mol,D不正确,答案选C。
19.在密闭容器中,反应X2(g)+Y2(g)  2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是
2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是

A.图Ⅰ是增大压强的变化情况
B.图Ⅱ是一定是加入催化剂的变化情况
C.图Ⅲ是增大压强或升高温度的变化情况
D.图Ⅲ一定是升高温度的变化情况
【答案】D
【解析】根据方程式可知,反应是条件不变的、放热的可逆反应。所以改变压强平衡不移动,A、B、C都不正确,所以正确的答案选D。
20.如下图所示,△H1=-393.5 kJ?mol-1,△H2=-395.4 kJ?mol-1,下列说法或表示式正确的是( )
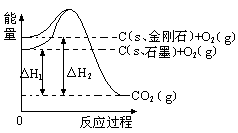
A. C(s、石墨)== C(s、金刚石) △H= +1.9 kJ?mol-1
B. 石墨和金刚石的转化是物理变化
C. 金刚石比石墨稳定
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
【答案】A
【解析】根据图像可知,石墨的总能量低于金刚石的总能量,所以石墨转化为金刚石是吸热反应,其反应热是-393.5 kJ?mol-1+395.4 kJ?mol-1=+1.9 kJ?mol-1,A正确。B不正确,该反应是化学变化。由于能量越低体系越稳定,所以石墨比金刚石稳定,C不正确。1.9kJ表示1mol石墨转化为金刚石要吸收热量1.9kJ,所以选项D不正确,答案选A。
第二篇:高中化学电离水解平衡选择题专项训练(终极版,部分附答案)
电离水解平衡选择题训练
1.下列溶液中,c(H)有小到大的排列顺序正确的是:①0.1mol/LHCl溶液②0.1mol/LH2SO4溶液③0.1mol/LNaOH溶液④0.1mol/LCH3COOH溶液
A、③②④① B、③④①② C、②①④③ D、④①②③
2.向一定体积的0.1mol/L的醋酸溶液加入等体积的蒸馏水后,下列叙述不正确的是 ...
A.溶液的PH值变大 B.醋酸的电离程度增大
C.溶液的导电能力减弱 D.中和此溶液所需同浓度氢氧化钠溶液的体积增加 3.0.1 mol/L NH4Cl溶液中,由于NH4的水解,使得c (NH4) < 0.1 mol/L。如果要使 c (NH4)更接近于0.1 mol/L,可采取的措施是
A 加入少量氢氧化钠 B 加入少量盐酸
C 加入少量水 D 加热
4.25℃时,将0.1mol/L的某酸与0.1mol/L的KOH溶液等体积混合,所得混合溶液的PH为
A.≤7 B.≥7 C.= 7 D、不能确定
5.100mL浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成的氢气的总量,可采用的方法是
A.加入适量的6mol/L的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
6.浓度均为0.1mol/L的甲酸和氢氧化钠溶液等体积相混合后,下列关系式正确的是
A.c(Na+)>c( HCOO-) >c( OH-) >c( H+) B.c( HCOO-) >c( Na+) >c( OH-) >c( H+)
C.c( Na+) =c( HCOO-) =c( OH-) =c( H+) D.c( Na+) =c( HCOO-) >c( OH-) >c( H+)
7. 用[H+]均为0.01mol/L的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为Vl和V2,则Vl和V2的关系正确的是
A.V1>V2 B.V1<V2C.V1=V2 D.V1≤ V2 ++++
8.某酸的酸式盐NaHY在水溶液中,HY-的电离度小于HY-的水解程度。有关的叙述中,正确的是
-A H2Y在电离时为:H2Y+H2OHY+H3O+
---B 在该盐的溶液中,离子浓度为:c(Na+)>c(Y2)>c(HY)>C(OH)>c(H+)
--C 在该盐的溶液中,离子浓度为:c(Na+)>c(HY)>c(OH)>c(H+)
---D HY的水解方程式为:HY+ H2OH3O++Y2
9.将0.2mol/LCH3COOK与0.1mol/L盐酸等体积混合,溶液中下列微粒物质的量的浓度关系正确的是
A c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH) B c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) D c(CH3COO-)+c(Cl-)+c(OH-)=c(H+)+c(K+)
10.在相同温度下,等体积等物质的量的浓度的4种稀溶液:①Na2SO4、②H2SO4、③NaHSO4、④Na2S中所含带电微粒数由多到少的顺序是
A ①=④>③=② B ④=①>③>②C ①>④>③>②D ④>①>③>②
11.把50mL 2mol/L的NaOH溶液,100mL 1mol/L的H2SO4溶液,以及40mL 3mol/L的氨水相混合,所得溶液能使酚酞试液呈浅红色,则溶液中离子浓度关系正确的是
A.c(SO42-)=c(Na+)>c(NH4+)>c(H+)>c(OH-)B.c(H+)+c(NH4+)+c(Na+)=c(SO42-)+c(OH-)
C.c(Na+)>c(SO42-)>c(NH4+)>c(OH-)>c(H+)D.c(NH4+)>c(SO42-)=c(Na+)>c(OH-)>c(H+)
12.用物质的量都是0.1mol的HCN和NaCN配成1L溶液,已知溶液中的c(CN-)<c(Na+),则对该混合溶液的下列判断正确的是
A.c(Na+)>c(CN-)>c(H+)>c(OH-)B.c(Na+)+c(H+)=c(CN-)+c(OH-)
C.c(CN-)+c(OH-)=0.1mol/L D.c(CN-)+c(HCN)= 0.2mol/L
13.下列物质溶解于水时,电离出的阴离子能使水的电离平衡向右移动的是
(A)CH3COONa (B)Na2SO4 (C)NH4Cl (D)H2SO4
14.表示0.1mol/L NaHCO3溶液中有关微粒浓度的关系式中正确的是
————(A)c(Na+)=c(HCO3) (B)c(H+)>c(OH) (C)c(Na+)>c(HCO3) (D)c(OH)>
c(H+)
15.0.1mol/L的Na2S溶液中,有关粒子的浓度大小关系正确的是
—————(A)c(Na+)+c(H+)=c(S2)+c(HS)+c(OH) (B)c(Na+)+c(H+)=2c(S2)+c(HS)+c(OH
—)
————(C)c(Na+)=2c(S2)+2c(HS)+2c(H2S) (D)c(Na+)=2c(S2)+2c(HS)+2c(H2S)
16.在常温下,将等体积的盐酸和氨水混和后,所得溶液的pH=7,则下列说法正确的是
—(A)原来盐酸的物质的量浓度等于氨不的物质的量浓度(B)所得溶液中c(NH4+)=c(Cl)
—(C)所得溶液中c(NH4+)+c(H+)=c(Cl) (D)所得溶液中c(NH4+)+c(NH3·H2O)=c(Cl
—)
—17.为了配制c(NH4+):c(Cl)=1 :1的溶液,可在NH4Cl溶液中加入①适量的HCl②适量
的NaCl③适量的氨水④适量的NaOH,正确的是
(A)①② (B)③ (C)③④ (D)④
18.碳酸钠溶液中存在着Na2CO3+H NaHCO3+NaOH的平衡,加热蒸干溶液,得到的固体是
(A)Na2CO3 (B)NaHCO3和NaOH(C)NaOH(D)Na2CO3和NaOH
19.物质的量浓度相同的下列溶液:①Na2CO3、②NaHCO3、③H2CO3、④(NH4)2CO3、⑤
—NH4HCO3按[CO32]由小到大排列的顺序是
(A)⑤<④<③<②<① (B)③<⑤<②<④<①
(C)③<②<⑤<④<① (D)③<⑤<④<②<①
(AB)20.50mL浓度为1mol/L的醋酸溶液与100mLNaOH溶液混合后,所得溶液的PH=7(常温下),则对该溶液的有关叙述正确的是
———A.c(Na+)==c(CH3COO) B.c(CH3COO)>c(OH)
C.原NaOH溶液的浓度为0.5mol/L D.NaOH溶液的浓度大于0.5mol/L
--(D )21.有五瓶溶液分别是:①10mL 0.60mol·L1NaOH水溶液,②20mL 0.50mol·L1H2SO4
--水溶液,③30mL0.40mol·L1HCl水溶液,④40mL 0.30mol·L1HAc水溶液,⑤50mL 0.20mol·L
-1蔗糖水溶液,以上各瓶溶液中所含离子、分子总数的大小顺序是
A.①>②>③>④>⑤ B.②>①>③>④>⑤
C.②>③>④>①>⑤ D.⑤>④>③>②>①
-1(A )22.0.1 mol·L的下列几种溶液:A.Na2CO3B.CH3COONaC.NaCl D.NaHCO3 E. NH4Cl,
其pH由大到小的顺序是
A.A>D>B>C>E B.C> E>B>D>A C.A>B>D>E>C D.E>A>B>D>E
( D )23.在FeCl3和Fe2(SO4)3的混合溶液中,若不计Fe3+的水解,当溶液中c(Fe3+)= c(SO42
-)时,下列判断正确的是
---A.c(Fe3+)>c(Cl) B.c(SO42)>c(Cl)
--C.c(SO42)<c(Cl) D.FeCl3和Fe2(SO4)3的物质的量相等
(AC)24.有一种酸式盐AHB,它的水溶液显弱碱性,今有下列说法,其中正确的是
A.同浓度的AOH溶液和H2B溶液,电离程度前者大于后者
--B.HB的电离程度大于HB的水解程度
-C.该盐的电离方程式为AHB === A++HB
—3—
---D.在溶液中离子浓度大小顺序一般为:c(A+)>c(HB)>c(OH)>c(B2)>c(H+)
( A )25.20℃,两种一元弱酸的钠盐NaX和NaY,已知往NaX溶液中通入CO2只能生成HX和NaHCO3;往NaY溶液中通入CO2能生成HY和Na2CO3,下列说法正确的是
A.酸性HX>HYB.溶液的碱性NaX>Na2CO3>NaY>NaHCO3
+----C. 结合H的能力:Y>CO32>X>HCO3D.HX和HY酸性相同,但比H2CO3弱
D. N3?与CO2含相等电子数
( A )26.明矾溶液中各种离子的物质的量浓度大小关系能够确定的是
+++A?c?K?>c?Al3+? B?c?K?=c?Al3+? C?c?H?=c?OH?? D?c?Al3+?<c?H+?
-( C )27.(04年北京)已知0.1mol·L1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
+---C.在NaHA溶液中一定有:c(Na+)+c(H)=c(HA)+c(OH)+2c(A2)
--D.在Na2A溶液中一定有:c(Na+)>c(A2)>c(H+)> c(OH)
28.浓度均为0.1mol/L的甲酸和氢氧化钠溶液等体积相混合后,下列关系式正确的是
A.c(Na+)>c( HCOO-) >c( OH-) >c( H+)
B.c( HCOO-) >c( Na+) >c( OH-) >c( H+)
C.c( Na+) =c( HCOO-) =c( OH-) =c( H+)
D.c( Na+) =c( HCOO-) >c( OH-) >c( H+)
29在甲酸溶液中加入一定量NaOH溶液,恰好完全反应,对于生成的溶液,下列判断一定正确的是
A.c(HCOO-)<c(Na+) B.c(HCOO-)>c(Na+)
C.c(OH-)>c(HCOO-) D.c(OH-)<c(HCOO-)
30将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10rnL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是
--+A.c (Ac)>c (Cl)>c (H)>c (HAc)
--+B.c (Ac)>c (Cl)>c (HAc)>c(H)
-++C.c (Ac)=c (Cl)>c (H)>c (HAc)
++---D.c(Na)+c (H)=c (Ac)+c (Cl)+c (OH)
31.在0.1mol·L-1 Na2CO3溶液中,下列关系正确的是
A.c(Na+)=2c(CO32-) B.c(OH-)=2c(H+)
C.c(HCO3-)>c(H2CO3) D.c(Na+)<{c(CO32-)+c(HCO3-)}
32.将20mL 0.4mol/L硝酸铵溶液跟50mL 0.1mol/L氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是
--++A.c(NO3)>c(OH)>c(NH4)>c(Ba2)
-+-+B.c(NO3)>c(Ba2)>c(OH)>c(NH4)
+--+C.c(Ba2)>c(NO3)>c(OH)>c(NH4)
-++-D.c(NO3)>c(Ba2)>c(NH4)>c(OH)
-33.(2003上海8)在10mL0.1mol·LNaOH溶液中加入同体积、同浓度的HAc溶液,反应
后溶液中各微粒的浓度关系错误的是
+-+-A.c(Na)>c(Ac)>c(H)>c(OH)
+--+B.c(Na)>c(Ac)>c(OH)>c(H)
+-C.c(Na)=c(Ac)>c(HAc)
++--D.c(Na)+c(H)=c(Ac)+c(OH)
34.常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是 ...
A.pH > 7,且c(OH) >c(Na+) >c(H+) >c(CH3COO)
——B.pH > 7,且c(Na+) + c(H+) = c(OH) + c(CH3COO)
——C.pH < 7,且c(CH3COO) >c(H+) >c(Na+) >c(OH)
——D.pH = 7,且c(CH3COO) >c(Na+) >c(H+) = c(OH) ——
35.叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是()
A、HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3?)>c(OH?)
B、HN3与NH3作用生成的叠氮酸铵是共价化合物
C、NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3?) >c(OH?)>c(H+)
D、N3?与CO2含相等电子数
36.将100毫升0.1摩/升的BaCl2溶液加入到100毫升0.2摩/升的H2SO4溶液中,则溶液中存在的离子浓度关系是
―――― A.[H+]>[Cl]>[Ba2+]>[SO42] B.[Cl]>[H+]>[SO42]>[Ba2+]
―――― C.[H+]>[Cl]>[SO42]>[Ba2+] D.[Cl]>[H+]>[Ba2+]>[SO42]
37.将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10rnL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是
--+ A.c (Ac)>c (Cl)>c (H)>c (HAc)
--+ B.c (Ac)>c (Cl)>c (HAc)>c(H)
--+ C.c (Ac)=c (Cl)>c (H)>c (HAc)
++--- D.c (Na)+c (H)=c (Ac)+c (Cl)+c (OH)
38.把0.02mol/LHAc溶液和0.01mol/LNaOH溶液以等体积混和,则混合液中微粒浓度关系正确的为
―+― A.C(Ac)>C(Na) B.C(HAc)>C(Ac)
+―― C.2C(H)=C(Ac)-C(HAc) D.C(HAc)+C(Ac)=0.01mol/L
-39.在10mL 0.1mol·LNaOH溶液中加入同体积、同浓度的HAc溶液,反应后溶液中各微
粒的浓度关系错误的是
+-+-+--+ A.C(Na)>C(Ac)>C(H)>C(OH) B.C(Na)>C(Ac)>C(OH)>C(H)
+-++-- C.C(Na)=C(Ac)+C(HAc) D.C(Na)+C(H)=C(Ac)+C(OH)
40.叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是
+―― A.HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H)>c(N3)>c(OH)
B.HN3与NH3作用生成的叠氮酸铵是共价化合物
+――+ C.NaN3水溶液中离子浓度大小顺序为:c(Na)>c(N3)>c(OH)>c(H)
― D.N3与CO2含相等电子数
41.等体积等浓度的MOH强碱溶液和HA弱酸溶液混合后,溶液中有关离子的浓度应满足的关系是(CD)
A、c(M+)>c(OH-)>c(A-)>c(H+) B、c(M+)>c(A-)>c(H+)>c(OH-)
C、c(M+)>c(A-)>c(OH-)>c(H+) D、c(M+)+c(H+)=c(A-)+c(OH-)
42.常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是(AD)
++A.pH>7,且c(OH—)>c(Na)>c(H)>c(CH3COO—)
++B.pH>7,且c(Na)+c(H)=c(OH—)+c(CH3COO—)
++C.pH<7,且c(CH3COO—)>c(H)>c(Na)>c(OH—)
++D.pH=7,且c(CH3COO—)>c(Na)>c(H)=c(OH—)
43、常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是(AD)
A.pH>7,且c(OH—)>c(Na)>c(H)>c(CH3COO—) ++
B.pH>7,且c(Na)+c(H)=c(OH—)+c(CH3COO—) ++
C.pH<7,且c(CH3COO—)>c(H)>c(Na)>c(OH—) ++
D.pH=7,且c(CH3COO—)>c(Na)>c(H)=c(OH—) ++
44、某氨水的pH=a, 其中水的电离度为?1;某硝酸的pH=b ,其中水的电离度为?2;且a+b= 14,a>11。将氨水和硝酸等体积混合后,所得溶液中其中水的电离度为?3。相同条件下纯水的电离度为?4。则下列关系中正确的是(B C)A.c(NO3—)>c(NH4+) >c(H+) >c(OH—)
B. ?4>?3>?2=?1
C. c(NH4+) > c(NO3—)> c(OH—)>c(H+) D ?3>?4>?2>?1
45、 常温下pH=3的二元弱酸H2R溶液与a L pH=11的NaOH溶液混合后,混合液的pH刚好等于7(假设反应前后体积不变),则对反应后混合液的叙述正确的是(C)
A.c(R)+ c(OH)=c(Na)+c(H)B.c(R)>c(Na)>c(H)=c(OH)
C.2c(R)+ c(HR)=c(Na)D. 混合后溶液的体积为2aL
46.常温下,0.1mol/L某一元酸(HA)溶液中c(OH)/c(H)=1×10,下列叙述正确的是
A.该溶液中由水电离出的c(H)=1×10 mol·L+-3-1 -+-82--+2--++2-++-B.由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中
c(Na+)>c(A-)>c(OH-)>c(H+)
C.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则
c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1mol·LHA溶液与0.05mol·LNaOH溶液等体积混合后所得溶液中
2c(H)+c(HA)=c(A)+2c(OH)
47.将0.1mol/L的醋酸钠溶液20ml与0.1mol/L盐酸10ml混合后,溶液显酸性,则溶液中
有关微粒的浓度关系正确的是
A.c(Ac)>c(Cl)>c(H)>c(HAc) B.c(Ac)>c(Cl)>c(HAc)>c(H) --+--++---1-1
C.c(Ac)=c(Cl)>c(H)>c(HAc) D.c(Na)+c(H)=c(Ac)+c(Cl)+c(OH)
48.盐酸.醋酸和碳酸氢钠是生活中常见的物质,关于它们下列表述正确的是
A.在NaHCO3溶液中加入等物质的量的NaOH,溶液中的阴离子只有CO3和OH B.等物质的量浓度的NaHCO3和Na2CO3溶液的PH前者大于后者。 C.10 mL0.10mol·LCH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是: c(Na)>c(CH3COO)>c(OH)>c(H) D.中和等体积等pH的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
列排序正确的是
A.c(OH)>c(HA)>c(HB)>c(H) B.c(OH)>c(A)>c(B)>c(H)
C.c(OH)>c(B)>c(A)>c(H) D.c(OH)>c(HB)>c(HA)>c(H)
A.NaHSO3和NaHCO3的中性混合液中(S和C均用R表示): ---+-+-+---++--+-12---++++--- 49.已知HA的酸性比HB弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下50.下列溶液中有关微粒的物质的量浓度关系正确的是
c(Na+)=c(HRO3-)+c(RO32-)
B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
c(Na+)>c(Cl—)>c(CH3COOH)
C.常温下等物质的量浓度的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中
c(NH4+):①<③<②
D.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H) + c(M) == c(OH) + c(A)
51.下列关于电解质溶液的叙述正确的是
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为
c(Cl)>c(NH4)>c(H)>c(OH)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
52.将标准状况下的2.24L CO2通入150mL 1mol/L NaOH溶液中,下列说法正确的是
A.c(HCO3-)略大于c(CO32-)B.c(HCO3-)=c(CO32-)
C.c(Na)=c(CO3)+c(HCO3) D.c(HCO3)略小于c(CO3)
53.在氯化铵溶液中,下列关系式正确的是 (A)
A.c(Cl-) >c(NH4+) >c(H+) >c(OH-) B.c(NH4+)>c(Cl-) >c(H+) >c(OH-)
C.c(NH4+)=c(Cl-) >c(H+) =c(OH-) D.c(NH4+)=c(Cl-) >c(H+) >c(OH-)
54.等体积等浓度的MOH强碱溶液和HA弱酸溶液混和后,混和液中有关离子的浓度应满足的关系是(C)
A、c(M+)> c(OH-)> c(A-)> c(H+) B、c(M+)> c(A-)> c(H+)> c(OH-)
C、c(M+)> c(A-)> c(OH-)> c(H+) D、c(M+)> c(H+) = c(OH-)+ c(A-)
55.将pH=3的盐酸溶液和pH=11的氨水等体积混和后,溶液中离子浓度关系正确的是(B)
A.c(NH4+)>c(Cl-)> c(H+)> c(OH-) B.c(NH4+)> c(Cl-)> c(OH-)> c(H+)
C.c(Cl-)> c(NH4+)> c(H+)> c(OH-) D. c(Cl-)> c(NH4+)> c(OH-)> c(H+) +2---2--++-++--
-
高中化学平衡归纳总结
高中化学平衡的归纳总结化学反应速率与化学平衡一、高考展望:化学反应速率和化学平衡理论的初步知识是中学化学的重要基本理论。从历年高考…
-
高中化学《化学平衡》知识点总结 新人教版选修4
安徽省安庆市第九中学高二化学化学平衡知识点总结新人教版选修4一1定义化学平衡状态一定条件下当一个可逆反应进行到正逆反应速率相等时更…
-
化学平衡知识点总结
化学平衡基础知识三化学平衡1可逆反应定义在同一条件下既能向正反应方向进行同时又能向逆反应方向进行的反应叫做可逆反应用代替可逆反应中…
-
高中化学平衡高考易错经典试题与总结
一化学平衡状态的判断一个可逆反应是否达到化学平衡状态判断依据主要有两个方面一是用同种物质浓度变化表示的正反应速率和逆反应速率相等或…
-
高中化学平衡高考易错经典试题与总结
一化学平衡状态的判断一个可逆反应是否达到化学平衡状态判断依据主要有两个方面一是用同种物质浓度变化表示的正反应速率和逆反应速率相等或…
-
高中化学平衡归纳总结
高中化学平衡的归纳总结化学反应速率与化学平衡一、高考展望:化学反应速率和化学平衡理论的初步知识是中学化学的重要基本理论。从历年高考…
-
高中化学选修4知识点总结
高中化学选修4知识点总结第1章化学反应与能量转化化学反应的实质是反应物化学键的断裂和生成物化学键的形成化学反应过程中伴随着能量的释…
-
高中化学《化学平衡》知识点总结 新人教版选修4
安徽省安庆市第九中学高二化学化学平衡知识点总结新人教版选修4一1定义化学平衡状态一定条件下当一个可逆反应进行到正逆反应速率相等时更…
-
高中化学选修4知识点归纳总结律
高中化学选修4知识点归纳总结第一章化学反应与能量一焓变反应热1反应热一定条件下一定物质的量的反应物之间完全反应所放出或吸收的热量2…
-
高中化学选修4知识点总结
高中化学选修4知识点总结第1章化学反应与能量转化化学反应的实质是反应物化学键的断裂和生成物化学键的形成化学反应过程中伴随着能量的释…