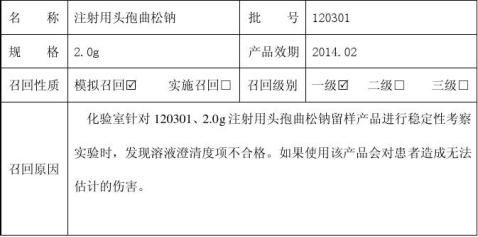
20xx年产品留样观察报告
20##年产品留样观察总结报告
采用留样观察法考察药品质量,操作简单、结果可靠;另
留样观察法是考察药物制剂稳定性的最可靠方法,也是新药上市前必须考察的项目之一。
药物制剂稳定性范围:化学方面:化学稳定性是指药物由于水解、氧化等化学降解反应,使药物含量(或效价)、色泽产生变化。包括药物与药物之间,药物与溶媒、附加剂、杂质、容器、外界物质(空气、光线、水分等)之间,产生化学反应而导致制剂中药物的分解变质;物理方面:物理稳定性是指药物制剂因物理性状的变化,导致原有质量下降,甚至不合格,如乳剂的分层、破裂;混悬剂中颗粒的结块或粗化;片剂的松散、崩解性能的改变等。一般物理变 化引起的不稳定,主要是制剂的外观质量受到影响而主药的化学结构不变,但经常会影响制剂使用的方便性;生物学方面:制剂由于生物学变化引起的不稳定,如微生物的污染、滋长、繁殖引起药物制剂发霉、腐败变质等。
药品可能在生产到使用这段时间内因各种因素而失效,如湿度、温度、氧气、光照等都会影响药品稳定性。药品抵御这些不稳定因素的能力取决于处方本身的性质、包装材料的性质及其贮存环境。稳定性实验目的就是要确定稳定的处方,合适的包装及贮存条件,以保证药品在有效期内的有效性及安全性。
鉴于此,特对本公司生产的所有剂型品种样品留样观察进行一年总结,对本公司所有生产品种剂型的安全、有效、稳定性等进行总结报告。根据留样观察项目及长期稳定性试验考察数据汇总统计分析结果,特拟下表对制剂质量安全、有效、稳定性等进行总结报告:
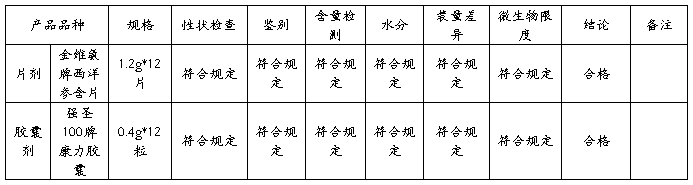
金维氨牌西洋参含片在20##年共生产了12批,留样观察12批,水分检测均低于标准值5%,其他检测项目均符合规定。
强圣100牌康力胶囊在20##年共生产1批,留样一批。水分检测均低于标准值5%,其他检测项目符合规定。
留样观察稳定性考察结果分析与讨论: 1.从留样观察长期稳定性试验考察测定结果得知所建立的检测方法对产品具体检查项目的测定有良好的稳定性指示性。 2.根据对产品具体检测检查项目的周期考察,每批次稳定性考察均符合规定,留样对外观、形状等检查均无异常。 3.从产品检测检查项目的周期考察结果得知,所生产的产品较为安全、有效、稳定。 4.从产品留样观察长期稳定性试验考察测定结果得知,产品检测检查项目在考察期内均符合要求,说明产品在有效期内较为安全、有效、稳定,有效期的确定均符合要求。 5.从产品具体检测检查项目的周期考察结果得知,所生产的产品的生产工艺较为稳定完善。 6.从产品具体检测检查项目的周期考察结果得知,所生产的产品的包装均符合要求且各剂型品种较为稳定。 7.各剂型品种在常温(0℃≤t≤30℃)、阴凉(0℃≤t≤20℃),湿度(45%~75%)留样观察长期稳定性考察试验中,从各剂型品种具体检测检查项目的周期考察结果得知,存储环境均符合要求且各剂型品种较为稳定。
第二篇:产品模拟召回报告-20xx年
产品召回报告
(注射用头孢曲松钠模拟召回报告)
制 定: 年 月 日
审 核: 年 月 日
批 准:
注射用头孢曲松钠模拟召回报告
1、目的:当销售的产品存在危害性或潜在危害时,能够迅速有效的做出反应,将危害程度和范围消除或降低。
2、依据:《药品召回管理规程》。
3、职责:召回小组全面负责、各部门协助。
3.1总经理负责召回产品命令的下达及召回工作的协调。
3.2质量受权人负责召回工作的实施、跟踪与协调。
3.3制造部负责召回产品的生产记录提供及查找生产技术原因,提供技术咨询。
3.4商务部、销售部负责销售记录的提供及同客户方进行沟通、协调以及召回产品的运输过程。
3.5质量部负责召回产品的质量记录提供及对库存产品、召回产品的控制、取样、检测工作,记录召回和通知情况。
3.6仓库负责货物的收发存核对工作及问题产品的登记、隔离、存放、保管。
4、模拟召回内容:
4.1模拟召回的准备
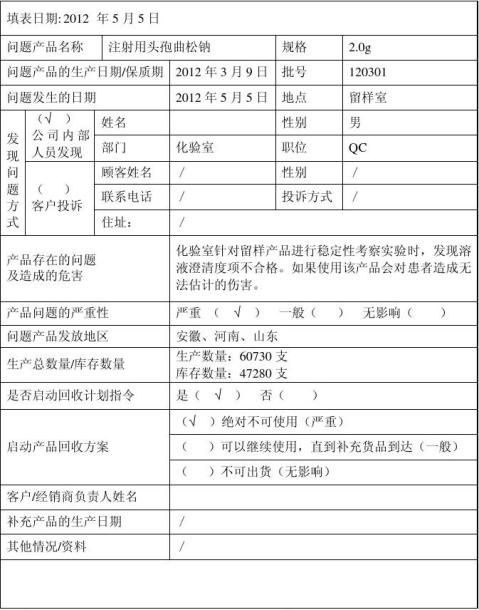
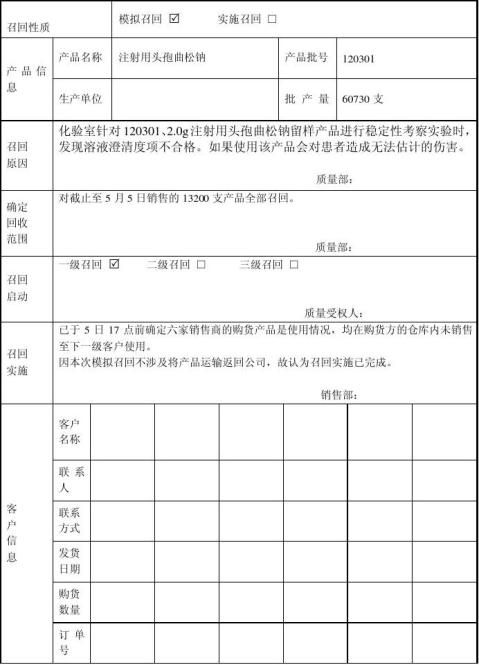
20xx年5月5日,公司决定进行一次模拟召回测试,以验证产品召回管理的可行性和有效性,并整改审核不符合项。
假定已经发货的注射用头孢曲松钠产品存在安全隐患(澄清度不合格),会给消费者健康造成危害,决定召回。
4.2模拟召回的实施
4.2.1启动召回
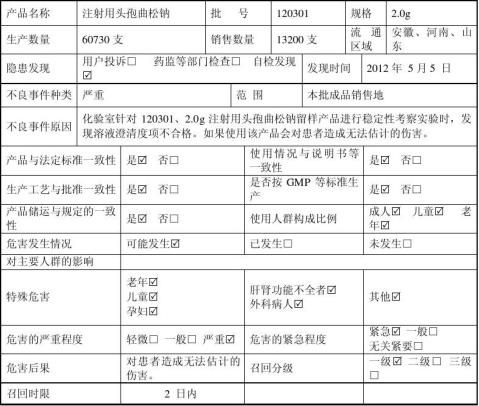
1、5月5日上午9:00:化验室针对20xx年 3月9 日生产的注射用头孢曲松钠(批号:120301 规格: 2.0g )产品,进行留样产品稳定性考察实验时发现,澄清度结果不合格;经重新取样复检,仍然显示澄清度结果不合格。
2、9点10分,质量部经理将问题汇报给质量负责人**,告知问题的严重性,建议启动产品召回。
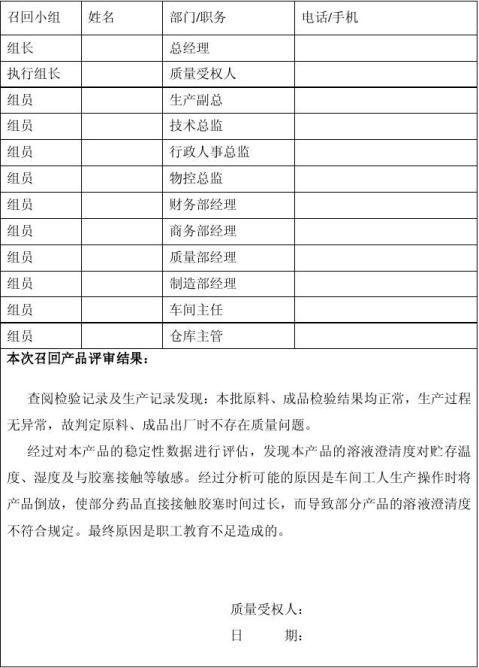
3、9点30分,召回小组执行组长迅速召开召回紧急会议:总经理**、质量
受权人**、生产副总**、技术总监**、行政人事总监**、物控部副总**、商务部经理**、质量部经理**、制造部经理**、财务部总监**、生产车间主任**、仓库主管**小组成员讨论评估后,决定实施产品召回。
4.2.2信息汇总分析与召回产品情况的确认
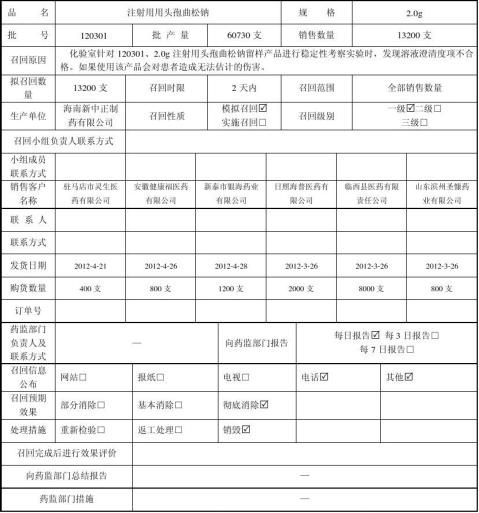
10点20分,经符英群查出库记录、吴飞查发货记录,产品情况确认如下: 产品批号: 120301 规 格:2.0g
生产数量:60730支
库存数量:47280支
销售数量:13200支
销售方向:河南、山东、安徽
质量问题:部分产品澄清度不合格。
4.2.3 召回实施
1、10点50分,总经理签发《药品召回指令》。
2、11点00分,经召回小组组长授权由商务部**制定药品召回计划。11点30分**分别电话告知驻马店市灵生医药有限公司(**);安徽健康福医药有限公司(**);新泰市银海药业有限公司(**);日照海普医药有限公司(**);临西县医药有限责任公司(**);山东滨州圣慷药业有限公司(**),提出对注射用头孢曲松钠产品实施召回,请求协助同时做好电话记录,并分别传真《药品召回通知单》。同时查询批号为120301 产品的销售及使用情况,验证公司各项记录的准确性。
2、11点50分驻马店市灵生医药有限公司(**)经查询后反馈,批号为120301的注射用头孢曲松钠,数量为1件;12点05分安徽健康福医药有限公司(**)经查询后反馈,批号为120301的注射用头孢曲松钠,数量为2件;13点10分日照海普医药有限公司(**)经查询后反馈,批号为120301的注射用头孢曲松钠,数量为5件;13点5分新泰市银海药业有限公司(**)经查询后反馈,批号为120301的注射用头孢曲松钠,数量为3件;15点15分山东滨州圣慷药业有限公司(**)经查询后反馈,批号为120301的注射用头孢曲松钠,数量为20件;16点临西县医药有限责任公司(**)经查询后反馈,批号为120301的注射用头孢曲松钠,数量为2件,截止20xx年5月5日16点6个客户反馈购进的药
品还未进行销售,存放在库中。产品信息与公司各项记录相符。
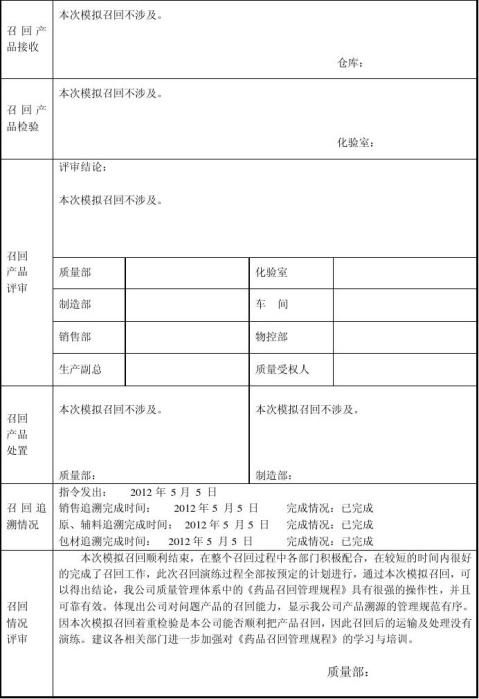
3、了解到此情况后,17点00分 **告知客户我们进行的是召回模拟测试,此批产品没有任何问题,由此带来的麻烦请求谅解。客户表示这是公司管理规范的体现,可以理解。
4、11点00分仓库**将该批的库存药品移至隔离区,挂上隔离标识牌。
5、11点10分质量部**安排符有校对同期其它批次的产品进行抽样检验。结果都合格。
6、后续处理:对于分析结果(产品存在或潜在危害)处理
1) 销售部、商务部联系将本批次销售的产品全部召回,并确认召回数量;填写《产品召回记录表》。
2)召回小组对召回产品和库存产品进行评估,处理。
3)销售部和顾客沟通进行索赔、补偿事宜。
5、结果评价:
本次模拟召回顺利结束,在整个召回过程中各部门积极配合,在较短的时间内很好的完成了召回工作,此次召回演练过程全部按预定的计划进行,通过本次模拟召回,可以得出结论,我公司质量管理体系中的《药品召回管理规程》具有很强的操作性,并且可靠有效。体现出公司对问题产品的召回能力,显示我公司产品溯源的管理规范有序。
因本次模拟召回着重检验是本公司能否顺利把产品召回,因此召回后的运输及处理没有演练。建议各相关部门进一步加强对《药品召回管理规程》的学习与培训。
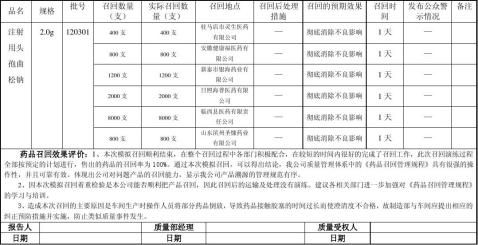
附表1
药品召回步骤和期限一览表

编制人: 审核人: 审核日期: 年 月 日
附表2
产品投诉资料收集及评价表
附表3
产品召回评审评估会议签到表
附表4
药品安全隐患调查评估报告
调查人: 评估人:
日 期: 日 期:
附表5
药品召回指令
签发人: 签发日期: 年 月 日
—————————————————— 公司各有关部门:
根据《药品管理法》、《药品生产质量管理规范》、《药品召回管理办法》及有
关规定的要求,我公司生产的产品,存在着质量问题。本着对人民用药安全有效负责和对患者身心健康负责,经本公司研究决定,对该批产品实行召回。望销售部在接到本通知后,迅速与有关医院、药店和药品销售客户以及可能与本产品有关的单位或个人(包括在运输途中的负责单位)进行联系,按召回指令,以最快的手段和途径召回,并做好召回的善后处理工作。公司其它部门做好产品召回的准备及处理工作。在产品召回的工作中随时与公司质量管理部门保持联系。
请将产品在 5 月6 日前收回。
望相关部门遵照执行。
****制药有限公司
20xx年 5月5日
附表6
电 话 纪 录
时间:20xx年5月5日
来电:销售部
内容:1、20xx年4月21日发给驻马店市灵生医药有限公司的 注射用头孢曲
松钠(规格2.0g、批号120301)400支 ,上市销售会导致顾客产生不良反应,为了避免更大的质量事故发生,召回本批产品,暂不要上市销售。 接电:11点30分,驻马店市灵生医药有限公司,业务负责人,接到电
话后,表示马上落实查询货物销售情况。
内容:2、 20xx年4月26日发给安徽健康福医药有限公司的 注射用头孢曲松
钠(规格2.0g、批号120301)800支 ,上市销售会导致顾客产生不良反应,为了避免更大的质量事故发生,召回本批产品,暂不要上市销售。 接电:11点40分,安徽健康福医药有限公司,业务负责人,接到电话
后,表示马上落实查询货物销售情况。
内容:3、 20xx年4月28日发给新泰市银海药业有限公司的 注射用头孢曲松
钠(规格2.0g、批号120301)1200支 ,上市销售会导致顾客产生不良反应,为了避免更大的质量事故发生,召回本批产品,暂不要上市销售。 接电:11点45分,新泰市银海药业有限公司,业务负责人接到电话后,表示马上落实查询货物销售情况。
内容:4、 20xx年3月26日发给日照海普医药有限公司的 注射用头孢曲松钠
(规格2.0g、批号120301)2000支 ,上市销售会导致顾客产生不良反应,为了避免更大的质量事故发生,召回本批产品,暂不要上市销售。
接电:11点55分,日照海普医药有限公司,业务负责人接到电话后,
表示马上落实查询货物销售情况。
内容:5、 20xx年3月26日发给临西县医药有限责任公司的 注射用头孢曲松
钠(规格2.0g、批号120301)8000支 ,上市销售会导致顾客产生不良反应,为了避免更大的质量事故发生,召回本批产品,暂不要上市销售。 接电:12点15分,临西县医药有限责任公司,业务负责人接到电话后,表示马上落实查询货物销售情况。
内容:6、 20xx年3月26日发给山东滨州圣慷药业有限公司的 注射用头孢曲
松钠(规格2.0g、批号120301)800支 ,上市销售会导致顾客产生不良反应,为了避免更大的质量事故发生,召回本批产品,暂不要上市销售。 接电:11点55分,山东滨州圣慷药业有限公司,业务负责人接到电话
后,表示马上落实查询货物销售情况。
附表7
药品召回计划表
附表8
药品召回通知单
单位: 驻马店市灵生医药有限公司
我公司于 2012 年 4 月 21日发往您处的药品(产品): 注射用头孢曲松钠 规格: 2.0g 批号: 120301 数量: 400支 ,存在质量问题,希望在接到本通知时,立即把已售出的药品(产品)收回,未售出的就地封存,并对已售出使用的药品(产品)采取下列补救或预防措施,我方将派人前往处理,特此通知。
补救或预防措施:
根据反馈的情况,全部销售产品经销商均未售出,已通知客户及业务负责人该批次库存产品停止发货,就地封存,全部即刻召回。
****制药有限公司
20xx年 5月 5 日
附表8
药品召回通知单
单位: 安徽健康福医药有限公司
我公司于 2012 年 4 月 26日发往您处的药品(产品): 注射用头孢曲松钠 规格: 2.0g 批号: 120301 数量: 800支 ,存在质量问题,希望在接到本通知时,立即把已售出的药品(产品)收回,未售出的就地封存,并对已售出使用的药品(产品)采取下列补救或预防措施,我方将派人前往处理,特此通知。
补救或预防措施:
根据反馈的情况,全部销售产品经销商均未售出,已通知客户及业务负责人该批次库存产品停止发货,就地封存,全部即刻召回。
****制药有限公司
20xx年 5月 5 日
附表8
药品召回通知单
单位: 新泰市银海药业有限公司
我公司于 2012 年 4 月 28日发往您处的药品(产品): 注射用头孢曲松钠 规格: 2.0g 批号: 120301 数量: 1200支 ,存在质量问题,希望在接到本通知时,立即把已售出的药品(产品)收回,未售出的就地封存,并对已售出使用的药品(产品)采取下列补救或预防措施,我方将派人前往处理,特此通知。
补救或预防措施:
根据反馈的情况,全部销售产品经销商均未售出,已通知客户及业务负责人该批次库存产品停止发货,就地封存,全部即刻召回。
****制药有限公司
20xx年 5月 5 日
附表8
药品召回通知单
单位: 日照海普医药有限公司
我公司于 2012 年 3 月 26日发往您处的药品(产品): 注射用头孢曲松钠 规格: 2.0g 批号: 120301 数量: 2000支 ,存在质量问题,希望在接到本通知时,立即把已售出的药品(产品)收回,未售出的就地封存,并对已售出使用的药品(产品)采取下列补救或预防措施,我方将派人前往处理,特此通知。
补救或预防措施:
根据反馈的情况,全部销售产品经销商均未售出,已通知客户及业务负责人该批次库存产品停止发货,就地封存,全部即刻召回。
****制药有限公司
20xx年 5月 5 日
附表8
药品召回通知单
单位: 临西县医药有限责任公司
我公司于 2012 年 3 月 26日发往您处的药品(产品): 注射用头孢曲松钠 规格: 2.0g 批号: 120301 数量: 8000支 ,存在质量问题,希望在接到本通知时,立即把已售出的药品(产品)收回,未售出的就地封存,并对已售出使用的药品(产品)采取下列补救或预防措施,我方将派人前往处理,特此通知。
补救或预防措施:
根据反馈的情况,全部销售产品经销商均未售出,已通知客户及业务负责人该批次库存产品停止发货,就地封存,全部即刻召回。
****制药有限公司
20xx年 5月 5 日
附表8
药品召回通知单
单位: 山东滨州圣慷药业有限公司
我公司于 2012 年 3 月 26日发往您处的药品(产品): 注射用头孢曲松钠 规格: 2.0g 批号: 120301 数量: 800支 ,存在质量问题,希望在接到本通知时,立即把已售出的药品(产品)收回,未售出的就地封存,并对已售出使用的药品(产品)采取下列补救或预防措施,我方将派人前往处理,特此通知。
补救或预防措施:
根据反馈的情况,全部销售产品经销商均未售出,已通知客户及业务负责人该批次库存产品停止发货,就地封存,全部即刻召回。
****制药有限公司
20xx年 5月 5 日
附表9
药品召回记录
附表10
药品召回总结报告
-
观察法市场调查报告.
对永辉超市观察法的调查报告1概要永辉超市股份有限公司创办于19xx年,是中国大陆第一家将生鲜农产品引进现代超市的流通企业,经过十多…
-
观察报告的格式
观察报告的构成要素标题:《关于??的观察》摘要:关键词:3-5个正文:一、导论:介绍观察的背景及观察所要达到的目标。二、正文内容:…
-
小学科学绿色植物的种植观察与行动研究报告
小学科学绿色植物的种植观察与行动研究报告白山市浑江区教师进修学校李英一课题的提出在小学科学教育中推行探究式教学是社会进步发展的需要…
-
小学科学绿色植物的种植观察与行动研究报告
小学科学绿色植物的种植观察与行动研究报告白山市浑江区教师进修学校李英一课题的提出在小学科学教育中推行探究式教学是社会进步发展的需要…
-
小学科学绿色植物的种植观察与行动研究报告
小学科学绿色植物的种植观察与行动研究报告白山市浑江区教师进修学校李英一课题的提出在小学科学教育中推行探究式教学是社会进步发展的需要…
-
电子信息科学与技术专业调查报告
专业调查报告电子信息(IT)产业是我国发展最快、最活跃,并伴随着国际竞争的产业,为提高我国IT产业的国际竞争力,继续保持中国经济快…