工程热力学的公式大全
5.梅耶公式:

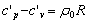

6.比热比:



外储存能:
1. 宏观动能:

2. 重力位能:

式中 g—重力加速度。
系统总储存能:
1.
或
2.
3. 或
或
 (没有宏观运动,并且高度为零)
(没有宏观运动,并且高度为零)
热力学能变化:
1. ,
,
适用于理想气体一切过程或者实际气体定容过程
2.
适用于理想气体一切过程或者实际气体定容过程(用定值比热计算)
3.
适用于理想气体一切过程或者实际气体定容过程(用平均比热计算)
4.把
 的经验公式代入
的经验公式代入 积分。
积分。
适用于理想气体一切过程或者实际气体定容过程(用真实比热公式计算)
5.
由理想气体组成的混合气体的热力学能等于各组成气体热力学能之和,各组成气体热力学能又可表示为单位质量热力学能与其质量的乘积。
6.
适用于任何工质,可逆过程。
7.
适用于任何工质,可逆定容过程
8.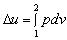
适用于任何工质,可逆绝热过程。
9.
适用于闭口系统任何工质绝热、对外不作功的热力过程等热力学能或理想气体定温过程。
10.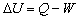
适用于mkg质量工质,开口、闭口,任何工质,可逆、不可逆过程。
11.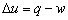
适用于1kg质量工质,开口、闭口,任何工质,可逆、不可逆过程
12.
适用于微元,任何工质可逆过程
13.
热力学能的变化等于焓的变化与流动功的差值。
焓的变化:
1.
适用于m千克工质
2.
适用于1千克工质
3.
适用于理想气体
4. ,
,
适用于理想气体的一切热力过程或者实际气体的定压过程
5.
适用于理想气体的一切热力过程或者实际气体的定压过程,用定值比热计算
6.
适用于理想气体的一切热力过程或者实际气体的定压过程用平均比热计算
7.把
 的经验公式代入
的经验公式代入 积分。
积分。
适用于理想气体的一切热力过程或者实际气体的定压过程,用真实比热公式计算
8.
由理想气体组成的混合气体的焓等于各组成气体焓之和,各组成气体焓又可表示为单位质量焓与其质量的乘积。
9.热力学第一定律能量方程

适用于任何工质,任何热力过程。
10.
适用于任何工质,稳态稳流热力过程
11.
适用于任何工质稳态稳流过程,忽略工质动能和位能的变化。
12.
适用于任何工质可逆、稳态稳流过程,忽略工质动能和位能的变化。
13.
适用于任何工质可逆、稳态稳流绝热过程,忽略工质动能和位能的变化。
14.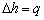
适用于任何工质可逆、稳态稳流定压过程,忽略工质动能和位能的变化。
15.
适用于任何工质等焓或理想气体等温过程。
熵的变化:
1.
适用于任何气体,可逆过程。
2.
 为熵流,其值可正、可负或为零;
为熵流,其值可正、可负或为零;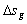 为熵产,其值恒大于或等于零。
为熵产,其值恒大于或等于零。
3. (理想气体、可逆定容过程)
(理想气体、可逆定容过程)
4. (理想气体、可逆定压过程)
(理想气体、可逆定压过程)
5.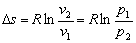 (理想气体、可逆定温过程)
(理想气体、可逆定温过程)
6. (定熵过程)
(定熵过程)

适用于理想气体、任何过程
功量:
膨胀功(容积功):
1. 或
或
适用于任何工质、可逆过程
2.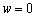
适用于任何工质、可逆定容过程
3.
适用于任何工质、可逆定压过程
4.
适用于理想气体、可逆定温过程
5.
适用于任何系统,任何工质,任何过程。
6.
适用于理想气体定温过程。
7.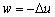
适用于任何气体绝热过程。
8.
适用于理想气体、绝热过程
9.

适用于理想气体、可逆绝热过程
10.
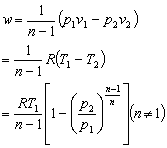
适用于理想气体、可逆多变过程
流动功:

推动1kg工质进、出控制体所必须的功。
技术功:
1.
热力过程中可被直接利用来作功的能量,统称为技术功。
2.
适用于稳态稳流、微元热力过程
3.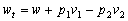
技术功等于膨胀功与流动功的代数和。
4.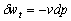
适用于稳态稳流、微元可逆热力过程
5.
适用于稳态稳流、可逆过程
热量:
1.
适用于任何工质、微元可逆过程。
2.
适用于任何工质、可逆过程
3.
适用于mkg质量任何工质,开口、闭口,可逆、不可逆过程
4.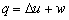
适用于1kg质量任何工质,开口、闭口,可逆、不可逆过程
5.
适用于微元,任何工质可逆过程。
6.
适用于任何工质可逆过程。
7
适用于任何工质,任何系统,任何过程。
8. 
适用于微元稳态稳流过程
9.
适用于稳态稳流过程
10.
适用于任何工质定容过程
11.
适用于理想气体定容过程。
12.
适用于任何工质定压过程
13.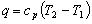
适用于理想气体、定压过程
14. 
适用于任何工质、绝热过程
15. 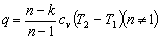
适用于理想气体、多变过程

干度:

湿蒸汽的参数:
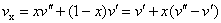
 (当p不太大,x不太小时)
(当p不太大,x不太小时)



过热蒸汽的焓:

其中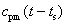 是过热热量,t为过热蒸汽的温度,cpm为过热蒸汽由t到ts的平均比定压热容。
是过热热量,t为过热蒸汽的温度,cpm为过热蒸汽由t到ts的平均比定压热容。
过热蒸汽的热力学能:

过热蒸汽的熵:

水蒸气定压过程:


 或
或


水蒸气定容过程:
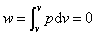



水蒸气定温过程:


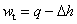

水蒸气绝热过程:




湿空气的总压力 :
:
湿空气的平均分子量:M=28.97-(28.97-18.02)Pv/B
湿空气的气体常数:

绝对湿度:
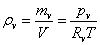
饱和绝对湿度 :
: 
相对湿度 :
: 
含湿量(或称比湿度) d: 

饱和度D: 
湿空气比体积: 



湿空气的焓: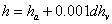 (kJ/kg(a))
(kJ/kg(a))


第二篇:工程热力学概念公式
第一部分 (第一章~第五章)
一、概念
(一)基本概念、基本术语
1、工程热力学:工程热力学是从工程的观点出发,研究物质的热力性质、能量转换以及热能的直接利用等问题。
2、热力系统:通常根据所研究问题的需要,人为地划定一个或多个任意几何面所围成的空间作为热力学研究对象。这种空间内的物质的总和称为热力系统,简称系统。
3、闭口系统:没有物质穿过边界的系统称为闭口系统。系统内包含的物质质量为一不变的常量,所以有时又称为控制质量系统。
4、开口系统:有物质流穿过边界的系统称为开口系统。开口系统总是一种相对固定的空间,故又称开口系统为控制体积系统,简称控制体。
5、绝热系统:系统与外界之间没有热量传递的系统,称为绝热系统。
6、孤立系统:系统与外界之间不发生任何能量传递和物质交换的系统,称为孤立系统。
7、热力状态:我们把系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。
8、状态参数:我们把描述工质状态特性的各种物理量称为工质的状态参数。
9、强度性状态参数:在给定的状态下,凡系统中单元体的参数值与整个系统的参数值相同,与质量多少无关,没有可加性的状态参数称为强度性参数。
10、广延性状态参数:在给定的状态下,凡与系统内所含物质的数量有关的状态参数称为广延性参数。
11、平衡状态:在不受外界影响(重力场除外)的条件下,如果系统的状态参数不随时间变化,则该系统所处的状态称为平衡状态。
12、热力过程:把工质从某一状态过渡到另一状态所经历的全部状态变化称为热力过程。
13、准静态过程:理论研究可以设想一种过程,这种过程进行得非常缓慢,使过程中系统内部被破坏了的平衡有足够的时间恢复到新的平衡态,从而使过程的每一瞬间系统内部的状态都非常接近平衡状态,于是整个过程就可看作是由一系列非常接近平衡态的状态所组成,并称之为准静态过程。
14、可逆过程:当系统进行正、反两个过程后,系统与外界均能完全回复到初始状态,而不留下任何痕迹,这样的过程称为可逆过程。
15、热力循环:把工质从某一初态开始,经历一系列状态变化,最后又回复到初始状态的全部过程称为热力循环,简称循环。
16、循环热效率:正循环中热转换功的经济性指标用循环热效率表示,循环热效率等于循环中转换为功的热量除以工质从热源吸收的总热量。
17、卡诺循环:由两个可逆定温过程与两个可逆绝热过程组成的,我们称之为卡诺循环。
18、卡诺定理:卡诺定理可表达为:①所有工作于同温热源与同温冷源之间的一切热机,以可逆热机的热效率为最高。②在同温热源与同温冷源之间的一切可逆热机,其热效率均相等。
19、孤立系统熵增原理:孤立系统的熵只能增大(不可逆过程)或不变(可逆过程),决不可能减小,此为孤立系统熵增原理,简称熵增原理。
(二)与工质性质有关的概念
1、温度:把这种可以确定一个系统是否与其它系统处于热平衡的物理量定义为温度。
2、压力:流体单位面积上所受作用力的法向分量称为压力(又称压强)。
3、比容:单位质量工质所占有的容积称为工质的比容。
4、理想气体:理想气体是一种经过科学抽象的假想气体模型,它被假设为:气体分子是一些弹性的、不占有体积的质点,分子相互之间没有作用力(引力和斥力)。
5、比热:单位物量的物体,温度升高或降低1 所吸收或放出的热量,称为该物体的比热,即
所吸收或放出的热量,称为该物体的比热,即 。
。
6、定容比热:在定容情况下,单位物量的气体,温度变化 所吸收或放出的热量,称为该气体的定容比热,即
所吸收或放出的热量,称为该气体的定容比热,即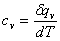 。
。
7、定压比热:气体加热在压力不变的情况下进行,加入的热量部分用于增加气体的内能,使其温度升高,部分用于推动活塞升高而对外作膨胀功。即: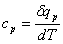 。
。
(三)与能量有关的概念
1、功:在热力学里,我们这样来定义功:“功是物系间相互作用而传递的能量。当系统完成功时,其对外界的作用可用在外界举起重物的单一效果来代替。”
2、膨胀功:由于系统容积发生变化(增大或缩小)而通过界面向外界传递的机械功称为膨胀功,也称容积功。
3、轴功:系统通过机械轴与外界传递的机械功称为轴功。
4、流动功:开口系统因工质流动而传递的功。
5、技术功:技术上可资利用的功,它是稳定流动系统动能、位能的增量与轴功三项之和。
6、热量:热量学的热量定义是,在温差作用下系统与外界传递的能量称为热量。
7、系统储存能:系统储存的能量称为储存能,它有内部储存能和外部储存能之分。
8、内部储存能:储存于系统内部的能量,它与系统内工质的分子结构及微观运动形式有关,称为内能(或内储存能)。
9、外部储存能:与系统整体运动以及外界重力场有关的能量,称为外储存能。
10、焓:焓的定义式为 。对于流动工质,焓具有能量意义,它表示流动工质向流动前方传递的总能量(共四项)中取决于热力状态的那部分能量。对于不流动工质,因
。对于流动工质,焓具有能量意义,它表示流动工质向流动前方传递的总能量(共四项)中取决于热力状态的那部分能量。对于不流动工质,因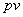 不是流动功,焓只是一个复合状态参数,没有明确的物理意义。
不是流动功,焓只是一个复合状态参数,没有明确的物理意义。
11、熵:熵是一种广延性的状态参数。熵的定义式 ,即熵的变化等于可逆过程中系统与外界交换的热量与热力学温度的比值。
,即熵的变化等于可逆过程中系统与外界交换的热量与热力学温度的比值。
1-5章 公式
(一)基本定律、基本方程
1、理想气体状态方程
① (
( 物量表示的状态方程式) ②
物量表示的状态方程式) ② (
( 物量表示的状态方程式)
物量表示的状态方程式)
③ (
( 物量表示的状态方程式)④
物量表示的状态方程式)④ (
( 物量表示的状态方程式)
物量表示的状态方程式)
2、热力学第一定律
(1)闭口系统能量方程
①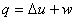 (任何工质,任何过程)②
(任何工质,任何过程)② (任何工质,任何过程)
(任何工质,任何过程)
③ (可逆过程) ④
(可逆过程) ④ (可逆过程)
(可逆过程)
(2)开口系统能量方程

(3)开口系统稳态稳流能量方程
① (任何工质,任何过程)②
(任何工质,任何过程)②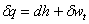 (任何工质,任何过程)
(任何工质,任何过程)
③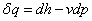 (可逆过程) ④
(可逆过程) ④ (可逆过程)
(可逆过程)
3、热力学第二定律
① (循环过程)②
(循环过程)② (闭口系统)
(闭口系统)
③ (闭口系统)④
(闭口系统)④ (孤立系统或闭口绝热系统)
(孤立系统或闭口绝热系统)
(二)基本公式
1、温度

2、循环效率
①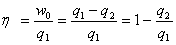 ②
②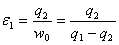 ③
③
3、理想气体比热
① ②
② ③
③ ④
④ (梅耶公式)
(梅耶公式)
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨
⑨
4、系统总储存能
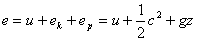
5、理想气体内能变化
① (理想气体,任何过程) ②
(理想气体,任何过程) ② (理想气体,任何过程)
(理想气体,任何过程)
6、理想气体焓变计算① (理想气体,任何过程) ②
(理想气体,任何过程) ② (同)
(同)
7、理想气体熵变计算① ②
② ③
③ 8.膨胀功 ①
8.膨胀功 ① ②
② (仅适用于可逆过
(仅适用于可逆过
9、流动功① ②
② (移动
(移动 工质进、出控制体净流动功)
工质进、出控制体净流动功)
10、技术功
① (任何工质,任何过程) ②
(任何工质,任何过程) ② (任何工质,任何过程)
(任何工质,任何过程)
③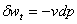 (可逆过程) ④
(可逆过程) ④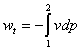 (可逆过程)
(可逆过程)
11、热量① ②
② 12、多变指数
12、多变指数  13、多变比热
13、多变比热 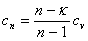
14、活塞式压气机余隙百分比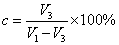 15、多级压气机每级升压比
15、多级压气机每级升压比 
16、卡诺循环热效率
①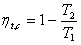 ②
② ③
③
17、作功能力损失 ① ②
②
18、熵方程
① (闭口系统) ②
(闭口系统) ② (稳态稳流的开口系统)
(稳态稳流的开口系统)
(三)导出公式
1、多变过程的过程方程式

2、多变过程初、终状态参数间的关系
① (
( )②
)② (
( )
)
③ (
( )
)
3、膨胀功
 4、技术功
4、技术功 
5.热量

第二部分 水蒸气
一、概念
1、汽化:物质由液相转变为气相的过程,称为汽化。气化有蒸发和沸腾两种形式。蒸发是指液体表面的汽化过程,通常在任何温度下都可以发生,沸腾是指液体内部的汽化过程,它只能在达到沸点温度时才会发生。
2、凝结:物质由气相转变为液相的过程,称为凝结。
3、水蒸气的饱和状态:液体汽化和气体凝结的动态平衡状况称为水蒸气的饱和状态。
4、汽化潜热:将 饱和液体转变成同温度的干饱和蒸汽所需要的热量。
饱和液体转变成同温度的干饱和蒸汽所需要的热量。
5、干度:单位质量湿蒸汽中所含干饱和蒸汽的质量叫作湿饱和蒸汽的干度。
6、临界点:当温度超过一定值 时,液相不可能存在,而只可能是气相。
时,液相不可能存在,而只可能是气相。 称为临界温度,与临界温度相对应的饱和压力
称为临界温度,与临界温度相对应的饱和压力 称为临界压力。所以,临界温度和压力是液相与气相能够共存时的最高值。当压力高于临界压力时,液-汽两相的转变不经历两相平衡共存的饱和状态,在定压下液-汽两个相区不存在明显的、确定的界线。临界参数是物质的固有常数。 公式
称为临界压力。所以,临界温度和压力是液相与气相能够共存时的最高值。当压力高于临界压力时,液-汽两相的转变不经历两相平衡共存的饱和状态,在定压下液-汽两个相区不存在明显的、确定的界线。临界参数是物质的固有常数。 公式
1.干度 2、湿饱和蒸汽的参数值 ①
2、湿饱和蒸汽的参数值 ①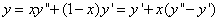
② 3、汽化潜热
3、汽化潜热 
一、概念 第三部分 湿空气
1、未饱和空气:由干空气与过热水蒸气(状态点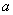 )所组成的湿空气称为未饱和空气。
)所组成的湿空气称为未饱和空气。
2、饱和空气:由干空气与饱和水蒸气组成的湿空气称为饱和空气。
3、干球温度:指用普通温度计(又称干球温度计)测得的温度就是干球温度。
4、露点温度:露点温度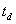 是对应于水蒸气分压力
是对应于水蒸气分压力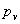 下的饱和温度,简称露点。
下的饱和温度,简称露点。
5、绝热饱和温度:在绝热的条件下对湿空气加入水分,并尽其蒸发而使湿空气达到饱和状态时所对应的温度。
6、湿球温度:指用湿纱布包裹的湿球温度计测得的湿纱布中水的温度。
7、绝对湿度:每立方米湿空气中所含有的水蒸气质量,称为湿空气的绝对湿度。
8、相对湿度:湿空气的绝对湿度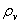 与同温度下饱和空气的饱和绝对湿度
与同温度下饱和空气的饱和绝对湿度 的比值,称为相对湿度。
的比值,称为相对湿度。
9、含湿量:在含有 干空气的湿空气中,所混有的水蒸气质量称为湿空气的含湿量(或称比湿度)。
干空气的湿空气中,所混有的水蒸气质量称为湿空气的含湿量(或称比湿度)。
10、饱和度:湿空气的含湿量 与同温下饱和空气的含湿量
与同温下饱和空气的含湿量 ,的比值称为饱和度。
,的比值称为饱和度。
11、湿空气的容积:湿空气的容积是 干空气为基准定义的,它表示在一定温度
干空气为基准定义的,它表示在一定温度 和总压力
和总压力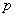 下,
下, 干空气和
干空气和 水蒸气所占有的容积,即
水蒸气所占有的容积,即 干空气的湿空气容积。
干空气的湿空气容积。
12、湿空气的焓值:湿空气的焓是以 干空气为基准来表示的,它是
干空气为基准来表示的,它是 干空气的焓和
干空气的焓和 水蒸气的焓的总和。
水蒸气的焓的总和。
13、热湿比:为了说明过程中焓和含湿量的变化,可以用状态变化前后的焓差和含湿量差的比值来描绘过程。它反映了过程的方向与特征。这个比值称为热湿比。其定义式是 。热湿比
。热湿比 在
在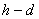 图上反映了过程线的倾斜度,因此,也称角系数。
图上反映了过程线的倾斜度,因此,也称角系数。
二、公式
1、湿空气的总压力 
2、湿空气的分子量及气体常数 
3、绝对湿度 ①
 ②
②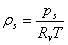

4、相对湿度  5、含湿量(比湿度)
5、含湿量(比湿度) 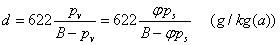
6饱和度 7、湿空气的容积
7、湿空气的容积
8、湿空气的密度 9、湿空气的焓值
9、湿空气的焓值 
10、湿空气中干空气的质量 
 8单位
8单位
11、热湿比
-
工程热力学总结
?试卷题型:一、判断对错:对,说明原因;错,进行改正7个左右,约20分?二、简答、分析及证明:5个左右,约25分?三、计算题:5个…
-
工程热力学知识总结
第一章基本概念1基本概念热力系统用界面将所要研究的对象与周围环境分隔开来这种人为分隔的研究对象称为热力系统简称系统边界分隔系统与外…
-
工程热力学总结
工程热力学总结第一章基本概念工质实现热能和机械能相互转化的媒介物质热源高温热源工质从中吸取热能的物系冷源低温热源接受工质排出热能的…
-
工程热力学总结
工程热力学复习总结第1页共17页第一部分第一章第五章一概念一基本概念基本术语1工程热力学工程热力学是从工程的观点出发研究物质的热力…
- 工程热力学知识总结
-
工程热力学总结
?试卷题型:一、判断对错:对,说明原因;错,进行改正7个左右,约20分?二、简答、分析及证明:5个左右,约25分?三、计算题:5个…