工程热力学基础课后答案
第一章
1.闭口系统与外界没有质量交换,系统内质量保持恒定的热力系统一定是闭口系统,这种说法是否正确。
答:不一定是闭口系统,也可能是不稳定流动敞开系统。
2.开系与闭系是可以相互转变,系统的选择对问题的分析有无影响?
答:随着研究者所关心的问题不同,系统的选取可不同,系统所包含的内容也可不同,以方便解决问题为原则。系统选取的方法对研究问题的结果并无影响,只是解决问题时的繁杂程度不同
3.系统处于热力学平衡,是否温度和压力必须处处相等?
答:平衡状态是指在没有外界影响的条件下,系统的宏观状态不随时间而改变。在平衡状态,系统中没有不平衡的势(或驱动力)存在。温差的存在,系统就有热量的传递,力差的存在,系统就有力的传递,有位移的存在,所以要系统处于热力学平衡,就必须使温度和压力处处相等。
4.状态参数有什么特点?
答:状态参数是整个系统的特征量,它不取决于系统状态如何变化,只取决于最终的系统状态。因此,状态参数是状态的的单值函数,状态一定,状态参数也随之确定;若状态发生变化,则至少有一种状态参数发生变化。换句话说,状态参数的变化只取决于给定的初始状态和终了状态,而与变化过程中所经历的一切中间状态或途径无关。因此,确定状态参数的函数为点函数,则具有积分特性和微分特性
5.平衡状态与稳定状态有何区别与联系?平衡状态与均匀状态有何区别与联系?
答:稳定状态是指状态参数不随时间改变,但这种不变可能是靠外界影响来维持的。平衡状态是指不受外界影响时状态参数不随时间变化。两者既有区别,又有联系,平衡必稳定,稳定未必平衡。
均匀状态是指不受外界影响时不但状态参数不随时间变化,而且状态参数不随空间变化。均匀必平衡,平衡未必均匀。当然对于由单相物质组成的系统,均匀必平衡,平衡也必均匀
6.什么是准平衡过程?引入这一概念在工程上有什么好处?
答:在过程进行中系统随时保持无限接近平衡状态,就称为准静态过程或准平衡过程。
在实际的热力过程中,由于不平衡势差的作用必将经历一系列非平衡态。这种非平衡状态实际上无法用少数状态参数描述。为此,研究热力过程时,需要对实际过程进行简化,建立某些理想化的物理模型。准静态过程和可逆过程就是两种理想化的物理模型,从而使得对问题的分析与计算大为简化。
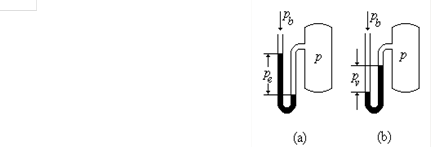
7.容器内压力不变,测该容器压力的压力表的读数是否会改变?
答:容器上压力表的读数是表压力,它除了与工质的绝对压力有关外,还与它所处的环境压力有关,因此,当压力表处于不同的环境时,压力表读数会不同。容器内工质的压力计算公式为:
① 当工质绝对压力大于大气压力时,压力计的示值称为表压力,以符号 表示,则
② 当工质绝对压力小于大气压力时,压力计的示值称为真空度,以 表示。则
大气压力 是地面上空气柱的重量所造成的,它随着各地的纬度、高度和气候条件而有些变化,可用气压计测定。由此可见,即使工质的绝对压力不变,表压力和真空度仍有可能变化。
8.经历一不可逆过程后,系统和外界能否恢复原来的状态?
答:能。只是必须在环境留下痕迹
9.实现可逆过程的基本条件是什么?可逆过程与准静态过程有何不同?
答:实现可逆过程的充分条件是:①过程是准静态过程,即过程所涉及到的有相互作用的各物体之间的不平衡势差为无限小;②过程中不存在耗散效应,即不存在由于摩擦、非弹性变形、电流流经电阻等使功不可逆地转变为热的现象。
它们的区别在于,准静态过程着眼于平衡,耗散效应对它无影响,而可逆过程不但强调平衡,而且强调能量传递效果。可逆过程中不存在任何能量损耗,因而它是衡量实际过程效率高低的一个标准,也是实际过程的理想极限。
10.表压力或真空度为什么不能当作工质压力?工质的压力不变,测量它的压力表或真空度的读数是否会变化? 看7题
11.平衡状态是不随时间改变的,所以一定是均匀状态,对吗? 看5题
习题
用刚性壁将容器分割成两部分,如图1—2所示。
压力表A和C位于大气环境中,它们分别测量室2和室1的压力,压力表B位于室2中,测量室1的压力。
(1)若pB=0.25MPa,pC=0.32MPa, 大气压力为0.1MPa,试计算压力表A的读数及室1、室2的绝对压力。
(2)若A为真空计,其读数为0.05MPa,压力表B的读数为0.06MPa,则压力表C的读数为多少?
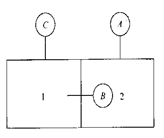
解:
(1)p1=pC+p0=0.32+0.1=0.42MPa p1=pB+p2
p2=p1一pB=0.42—0.25=0.17MPa
pA=p2一p0=0.17—0.1=0.07MPa
(2)p2=p0一pA=0.1—0.05=0.05MPa
pl=p2十pB=0.05+0.06=0.11MPa
pC=pl一p0=0.11—0.1=0.01MPa
第三章
例题1:150℃的液态水放在一密封容器内,试问水可能处于什么压力?
解:查饱和蒸汽表, t1=150℃时ps=476kPa
因此水可能处于p?476kPa,若p<476kPa
则容器内150℃的水必定要变成过热汽。
习题14:已知水蒸气的压力为p=0.5MPa,比体积
v=0.35m3/kg.问这是不是过热蒸汽?如果不是,那么是干饱和蒸汽还是湿蒸汽?用水蒸气表求出其他参数
解:利用水蒸气表,p=0.5MPa时查得

所以该水蒸气不是过热蒸汽而是饱和湿蒸汽
思考题
4.气体的比热容c、cv、cp是否是状态参数?
C不是状态参数,cv、cp是状态参数.
5.如果比热容只是温度的单调递增函数,当t2>t1时,平均比热容 、 、 的大小关系如何?
6.对于理想气体 , ,它们的适用条件是什么?
理想气体的一切过程
实际气体定容、或定压过程
8.理想气体的热力学能的基准点是以压力还是温度或是两者同时为基准规定的?
是以温度为基准
9.试说明理想气体热力学能和焓的特点
理想气体热力学能和焓只与温度有关
10.绝热容器内盛有一定气体,外界通过容器内叶轮向空气加入wkJ的功.若气体视为理想气体,试分析气体热力学能、焓、温度、熵的变化。
热力学能增大、焓增大、温度增高、熵增大。
11.迈耶公式 是否适用于理想气体混合物,是否适用于实际气体?
适用于理想气体混合物,不适用于实际气体
12.由A、B两种气体组成的混合气体,如果摩尔分数 ,是否必有质量分数?
不一定,与分子量有关.
14.压缩因子的物理意义是什么?
反映实际气体与理想气体的偏离程度;反映气体压缩性的大小.
15.理想气体状态方程用于实际气体时产生偏离的原因是什么?
实际气体分子本身占有一定的体积,实际气体分子间有相互吸引力.
18.水的三相点的比体积为定值吗?为什么?
三相点的比体积随固、液、气三相的混合比例不同而异
19.水在定压汽化过程中温度维持不变,因此有人认为过程中热量等于膨胀功,即 ,对不对?为什么?
不对.因为在湿蒸气阶段 ,随着吸热,干度x变大,则湿蒸汽热力学能增大,所以
第二篇:工程热力学思考题及答案 第 五 章
沈维道、将智敏、童钧耕《工程热力学》课后思考题答案
工程热力学思考题及答案
第 五 章 热力学第二定律
1.热力学第二定律能否表达为:“机械能可以全部变为热能,而热能不可能全部变为机械能。”这种说法有什么不妥当?
答:不能这样表述。表述不正确,对于可逆的定温过程,所吸收的热量可以全部转化为机械能,但是自身状态发生了变化。所以这种表述不正确。
2.自发过程是不可逆过程,非自发过程必为可逆过程,这一说法是否正确?
答:不正确。自发过程是不可逆过程是正确的。非自发过程却不一定为可逆过程。
3.请给“不可逆过程”一个恰当的定义。热力过程中有哪几种不可逆因素?
答:一切非准静态过程都是不可逆过程。不可逆因素有:摩擦、不等温传热和不等压做功。
4.试证明热力学第二定律各种说法的等效性:若克劳修斯说法不成立,则开尔文说也不成立。
?→是一的,只要答:热力学第二定律的两种说法反映的是同一客观规律——自然过程的方向性?
一种表述可能,则另一种也可能。
假设热量Q2能够从温度T2的低温热源自动传给温度为T1的高温热源。现有一循环热机在两热源间工作,并且它放给低温热源的热量恰好等于Q2。整个系统在完成一个循环时,所产生的唯一效果是热机从单一热源(T1)取得热量Q1-Q2,并全部转变为对外输出的功W。低温热源的自动传热Q2给高温热源,又从热机处接受Q2,故并未受任何影响。这就成了第二类永动机。?违反了克劳修斯说法,?必须违反了开尔文说法。反之,承认了开尔文说法,克劳修斯说法也就必然成立。
5.(1)循环净功Wnet愈大则循环效率愈高;(×) (2)不可逆循环的热效率一定小于可逆循环Tηt=1?2
T1(× ) 的热效率;( ×) (3)可逆循环的热效率都相等,
q1?q2T?Tηt=12
q1和T1是否完全相同?各适用于哪些场合? 6. 循环热效率公式
q?qT?Tηt=12ηt=12
q1适用于任何工质,任何循环。T1适用于任何工质,答:这两个公式不相同。ηt=
卡诺循环。
7.与大气温度相同的压缩空气可以膨胀做功,此事实是否违反了热力学第二定律?
答:不违反热力学第二定律,对于理想气体的定温过程,从单一热源吸热并膨胀做功,工质的状态发生了变化,所以不违反热力学第二定律。
1
8.下列说法是否正确:(1)熵增大的过程必定为吸热过程 (×);(2)熵减小的过程必为放热过程 (×);(3)定熵过程必为逆绝热过程 (×)。
9.下列说法是否有错误:
(1) 熵增大的过程必为不可逆过程(×)
(2)使系统熵增大的过程必为不可逆过程(×)
(3)熵产sg>0的过程必为不可逆过程(√)
(4)不可逆过程的熵变Δs无法计算(×)
(5)如果从同一初始态到同一终态有两条途径,一为可逆,另一为不可逆,则ΔS不可逆>ΔS可逆,Sf,不可逆>Sf,可逆Sg,不可逆>Sg,可逆,是否正确?
答:ΔS不可逆=ΔS可逆、Sf,不可逆<Sf,可逆、Sg,不可逆>Sg,可逆
(6)不可逆绝热膨胀的终态熵大于初态熵,S2>S1,不可逆绝热压缩的终态熵小于初态熵S2<S1? 答:不可逆绝热膨胀的终态熵大于初态熵S2>S1不可逆绝热压缩的终态熵也大于初态熵S2>S1。 δq>0,dsTr<0(7)工质经过不可逆循环有?
δqds = 0, Tr<0答:工质经过不可逆循环有。
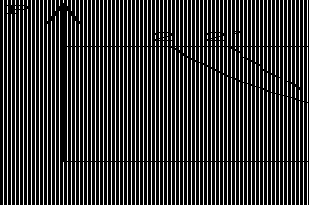
10.从点a开始有两个可逆过程:定容过程a-b和定压过程a-c,b、c两点在同一条绝热线上,问qa?b和qa?c哪个大?并在T-s上表示过程a-b、a-c及qa?b、qa?c
答:由图5-2可知qa?b>qa?c 知qa?b>qa?c
qa?b
为1-a-b-2-1的面积;qa?c为1-a-c -2-1的面积
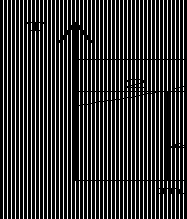
11.某种理想气体由同一初态经可逆绝热压缩和不可逆绝热压缩两种过程将气体压缩到相同的终压,在p-v图和T-s图上画出两过程,并在T-s图上画出两过程的技术功及不可逆过程的用损失。 答:由同一初态经可逆绝热压缩和不可逆绝热压缩两种过程到相同终压如5-3图示。
q=Δh+wt
绝热过程q=0,所以wt=?Δh
Δh=cp(T2?T1)=cp(T2''?T1)=qp,1?2
2
不可逆绝热压缩过程的技术功为面由5-4图可知,可逆绝热压缩过程的技术功为面积1-2T-j-m-1,
积1-2’
T-f-m-1,不可逆过程的用损失为面积1-g-n-m-1
12. 对于一个孤立系统,其内部若进行了可逆过程则孤立系统的总能不变,总熵不变总火用也不变?
答:若系统内进行的是不可逆过程则系统的总能不变,总熵增加,总火用减小。
3
-
基础工程课程总结
7浅基础71地基基础设计原则对防止地基土体剪切破坏和丧失稳定性方面应具有足够的安全度应控制地基变形量使之不超过建筑物的地墓变形允许…
-
土木工程施工课程总结
施工课程总结第一章土石方工程质量事故由于建设勘察设计施工监理等单位违反工程质量有关法律法规和工程建设有关标准使工程产生结构安全重要…
-
基础工程期末总结
名词解释1地基承担建筑物荷载的地层2基础介于上部结构与地基之间的部分即建筑物最底下的一部分3刚性基础指抗压性能较好而抗拉抗剪性能较…
-
基础工程课程设计
1设计任务某建筑物双向板式片筏基础上部传来的总轴力为学号412120xx基础埋置深度18m修正地基承载力特征值混凝土强度等级为C2…
-
基础工程总结
1浅基础埋深d5m或埋深与基础底面宽度之比db10的基础为浅基础2深基础而埋深d5m通常需要较特殊方法施工的基础称为深基础3人工地…
-
工程热力学总结
?试卷题型:一、判断对错:对,说明原因;错,进行改正7个左右,约20分?二、简答、分析及证明:5个左右,约25分?三、计算题:5个…