有机化学实验实验报告四
Grignard试剂反应制备三苯甲醇
一. 实验目的
1. 初步学会无水操作的原理和方法
2. 掌握无水乙醚的制备方法
3. Grignard试剂反应
4. 水蒸气蒸馏操作和重结晶操作
二. 实验试剂要求和实验装置图
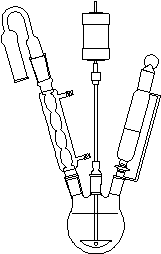
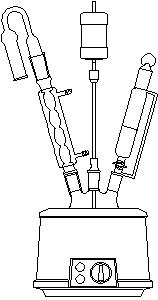
简单无水Grignard反应装置 稍热冷凝回流装置
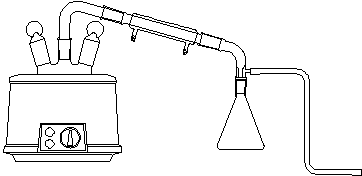
简单蒸馏装置和水蒸气蒸馏装置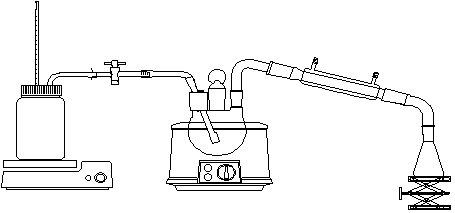
试剂要求:
镁屑、新蒸溴苯、苯甲酸甲酯、无水乙醚、氯化铵、乙醇(各试剂用量根据实验过程需要计算)
三. 实验原理和实验步骤
本实验的主要目的是学习无水条件下的Grignard反应实验操作,因此贯穿整个实
验的核心是无水条件。
Grignard反应必须在无水、无氧和无二氧化碳条件下进行,最好要在氮气保护下进
行实验。
1. 苯基溴化镁的制备:
基本反应原理:
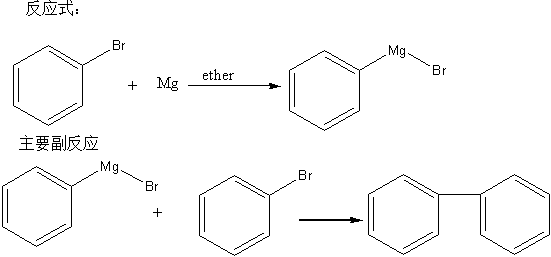 从主要副反应来看,如果反应温度过高,会提高副反应的产率,但反应温度过低,又会使主要反应的反应完成时间延长,因此,此步骤控制温度很重要(反应本身放热)。如课本所说,“滴加无水乙醚和溴苯的速率控制在使溶液微微沸腾和微热”。
从主要副反应来看,如果反应温度过高,会提高副反应的产率,但反应温度过低,又会使主要反应的反应完成时间延长,因此,此步骤控制温度很重要(反应本身放热)。如课本所说,“滴加无水乙醚和溴苯的速率控制在使溶液微微沸腾和微热”。
反应完成后,水浴回流0.5小时,由于反应已经完毕,此步温度控制并不重要,但也不要太高,防止产物分解。
2. 三苯甲醇的制备:
 Grignard试剂的进攻反应是放出热量的。
Grignard试剂的进攻反应是放出热量的。
(Question:此步反应为什么要在冷水浴的冷却条件下进行?如果是为了防止副反应,那防止的又是什么副反应?)
控制滴加苯甲酸甲酯速度,使反应保持平稳地进行,滴加完毕后同样水浴回流0.5小时,使反应完全。
此步反应完毕后,在冰水浴中进一步冷却,在搅拌下慢慢滴加NH4Cl饱和溶液:
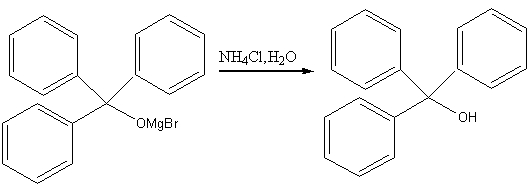 Grignard试剂与Carbonyl group形成加合物后,在酸性条件下进行水解(放热,冷却),对遇酸极易脱水的醇或容易发生卤代反应的醇,最好用饱和氯化铵进行水解。
Grignard试剂与Carbonyl group形成加合物后,在酸性条件下进行水解(放热,冷却),对遇酸极易脱水的醇或容易发生卤代反应的醇,最好用饱和氯化铵进行水解。
3. 产物后处理:
将反应装置改为蒸馏装置,蒸去乙醚,再将残余物进行水蒸气蒸馏,蒸至瓶中固体成松散的颗粒状,瓶中水已变清不再混浊(如有大块固体凝结,可以捣碎,以加快反应速度)。抽滤收集,去离子水洗涤,得到粗产物。粗产物质量为46.95-42.12=4.83g,淡黄色棱状晶体。
4. 重结晶操作:
本次实验采用水和乙醇的混合溶剂进行重结晶,之所以采用混合溶剂是因为单纯的乙醇溶剂溶解度很大,在常温或冷却条件下无法析出大量三苯甲醇,导致回收率很低,而单纯的水的溶解度有很小,所以采用混合溶剂进行重结晶操作。采用混合溶剂进行重结晶时,可先将待纯化物质在接近良溶剂的沸点时溶于良溶剂中,用活性碳脱色,乘热滤去(单纯的良溶剂溶解度很大,过滤是晶体不会析出)。再加热过滤后的溶剂,用水回滴,直至所出现的浑浊恰好不再消失,再加入少量良溶剂使溶液透明,自然冷却析出晶体。
未干燥的产物质量为:46。95-42。12=4。83g
干燥后的产物质量为:46。27-42。12=4。15g
重结晶后的产物质量为:43。25g-42。12=1。13g
产率为:27。23%(急于求成,大量晶体析出于漏斗和操作不当漏出)
熔程:159。8℃~160。4℃
95%乙醇:水=37。4:8(乙醇量有一部分在加热时挥发损失)
必须承认,我所做的有机实验很失败。我为此感到痛苦。
5. 红外光谱表征:(见附页)
四. 实验讨论
1. 本实验中为什么要用饱和氯化铵溶液分解产物?还可以用什么试剂替代?
对遇酸极易脱水的醇或容易发生卤代反应的醇,最好用饱和氯化铵进行水解。可以用pKa值更小的酸,如sodium borohydride NaBH4.
2. 本实验中溴苯滴加速度太快有什么不好?
由于反应本身是放热反应,滴加速度过快会使用反应瓶温度升高,提高了主要副产物联苯的生成率。
3. 苯基溴化镁试剂与下列化合物的反应式:
(a): 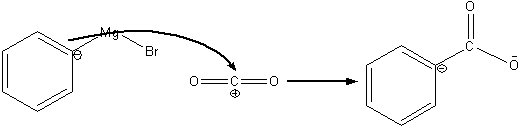 (b):
(b): 
(c): 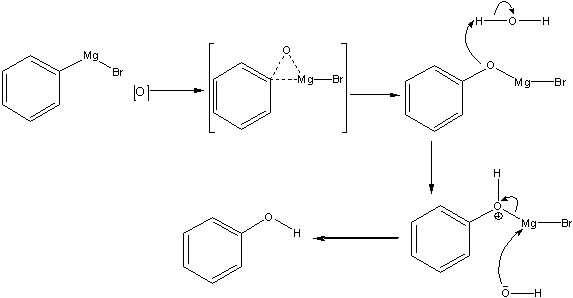 (d):
(d): 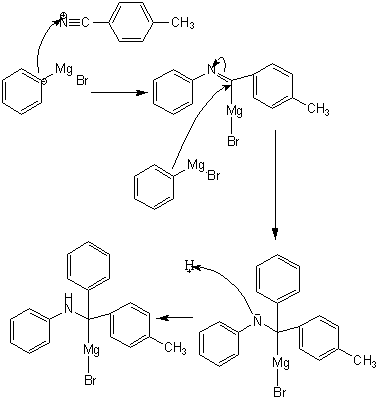
(e): 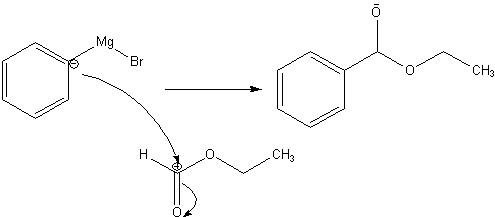
(f):
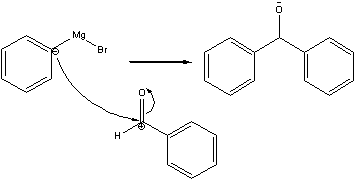
4. 用混合溶剂进行重结晶时,何时加入活性碳脱色?能否加入大量的不良溶剂,使产物全部析出?抽滤后的晶体应该用什么溶剂洗涤?
用良溶剂把晶体完全溶解后,加热沸腾,拿下稍冷,再加入活性碳。加入大量不良溶剂,使的其他副产物也大量地析出,这样就没有了重结晶的意义。抽滤后的晶体用混合溶剂进行洗涤,但注意少量。
5. 抽滤出的重结晶三苯甲醇固体,是否可马上放入100℃干燥箱中干燥,为什么?
我所做的实验中,抽滤后马上就放入真空干燥箱中干燥,如果题意也是说真空干燥箱,我不知道为什么。
第二篇:有机化学实验报告---肥皂之制备
肥皂之製備
食二丙
第十二組
梅婉如
肥皂之製備
一、 實驗目的:
瞭解油脂的物理性質及化學性質、瞭解肥皂之製備及其性質、本實驗是用牛油和氫氧化鈉合成肥皂。也可使用回鍋油製作皂基這樣也不會造成嚴重的環境污染,若把回鍋油製成肥皂就可解決廢油問題。
二、 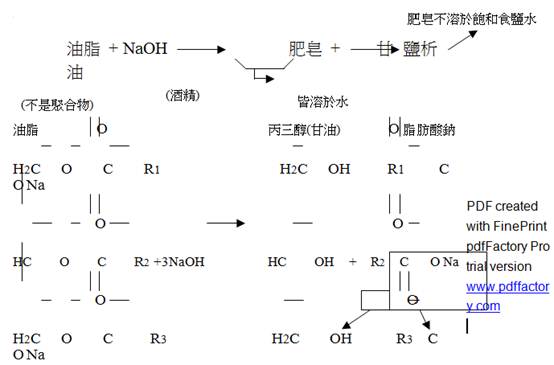 實驗原理:
實驗原理:
油脂與鹼(NaOH 或 KOH)共熱生成肥皂和甘油的反應,稱為皂化反應。
肥皂是(soap)為長鏈脂肪酸之鹼金屬鹽類。肥皂可用 RCOONa 或 RCOOK 表示。例如:C17H35COONa(硬脂酸鈉)、C15H31COONa(軟脂酸鈉)等
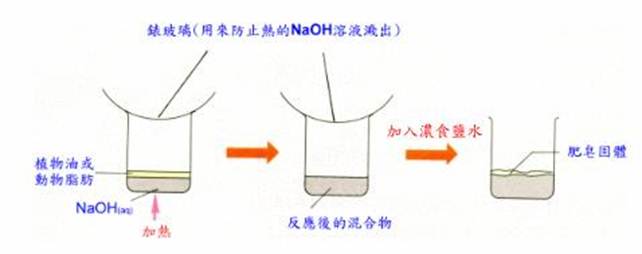
這是一個皂化反應,由於牛油是脂類,所以與氫氧化鈉生成硬脂酸鈉,這是肥皂的一種。加入濃食鹽水的目的只是令肥皂溶解度降低,令它浮在溶液上,易於收集。
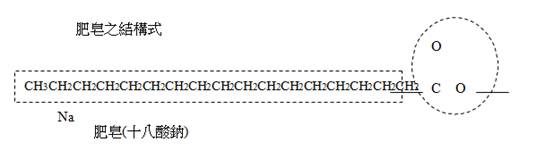
自然界中脂肪酸(Fatty acid)和甘油(Glycerol)
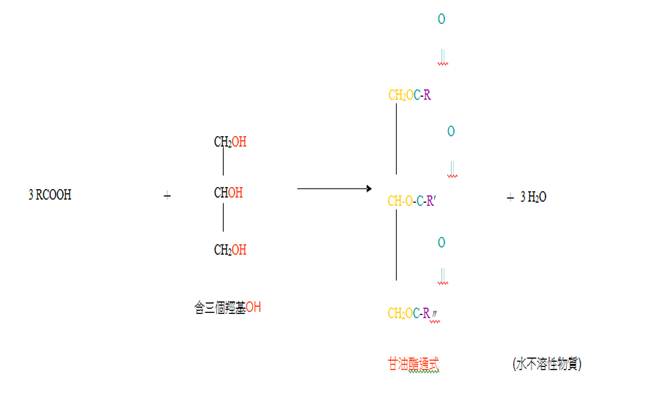 會形成脂肪酸之甘油酯(Glycerides;Glycerin esters)
會形成脂肪酸之甘油酯(Glycerides;Glycerin esters)
常溫下
因此若
R = R' = R" 簡單甘油脂
R ≠ R'≠ R" 混甘油脂
簡單甘油酯有:
(1)軟酯Palmitin(三軟脂酸甘油酯)﹣﹣(C15H31COO)3C3H5
(2)硬酯Stearin(三硬脂酸甘油酯)﹣﹣(C17H35COO)3C3H5
(3)月桂酯Laurin(三月桂脂酸甘油酯)﹣﹣(C11H23COO)3C3H5
(4)肉豆蔻酯Myristin (三肉豆蔻脂酸甘油酯) ﹣﹣(C13H27COO)3C3H5
(5)花生酯Arachidin(三花生脂酸) ﹣﹣(C19H39COO)3C3H5
上述為飽和酸酯
(6)油酯Olein(三油酸甘油酯)﹣﹣(C17H32COO)3C3H5
(7)亞油酯Linolein(三亞麻仁油酸甘油酯)﹣﹣(C17H30COO)3C3H5
(8)次亞油酯Linolenin(三次亞麻仁油酸甘油酯)-- (C17H28COO)3C3H5
(9)花生油酯Arachidonin(三花生油酸甘油酯)--(C19H30COO)3C3H5
上述為不飽和酸酯
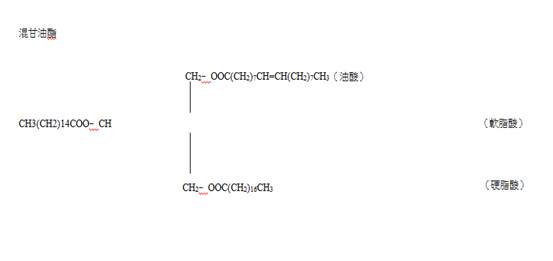
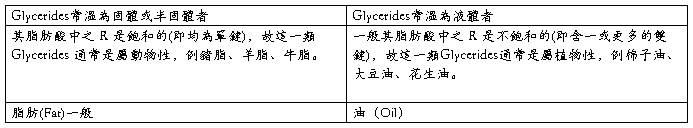
依在空氣中之乾燥性,油脂分類可分為:
1. 乾性油:含高級不飽和脂肪酸脂較多之油脂,此類油脂含不飽和鍵較多,易和空氣行漸次氧化而凝結固化,故塗於物體表面在空氣中具乾燥性。例桐油、亞麻仁油。
2. 不乾性油:含少量雙鍵或不含雙鍵的高級酸酯,在空氣中不能乾燥。例豬酯、蓖、麻油。
3.半乾性油:介於上述兩者之間的。例大豆油。

所得產物中有油脂、NaOH、甘油及肥皂,此時可加入食塩溶液將肥皂塩析而出,浮於液面。(因肥皂不溶於塩水,又較塩水之比重為小)肥皂應是中性的,但如鹼太多或皂化不全,則會有游離鹼呈鹼性,或因皂化不全而有游離酸呈酸性。
肥皂游離鹼(以NaOH計)最大容許量在0.05~1.1%之間,純皂份(以Na皂計)最小在70%以上,pH<9,水份10~15%。
三、實驗器材及藥品
牛脂、NaOH、酒精、NaCl、甘油、色料、香料、燒杯、模型、錶玻璃
四、實驗步驟:
(一)皂基之製作:
1.水相-----NaOH sol'n (15 ml R.O.水 + 5 g NaOH)
2.油相-----秤12 g牛脂於250ml的燒杯中
3.將水相加入油相中,並加入20 ml乙醇(幫助得均相溶液,因油與NaOH sol'n 不互溶,乙醇可溶於水也可與油互溶,增加油脂溶解度及提高沸點,達到增加反應速率的目的,進而增加皂化速度) 。
4.於熱水浴中加熱,用錶玻璃蓋著,並不時攪拌(如體積變少或變黏稠,則加入乙醇和水 1 :1 之溶液,以保持一定體積)。
5.準備一食塩溶液,做塩析(300 ml水溶解100 g NaCl)
6.皂化約40分鐘即可完成(表面無油珠狀也無油味時)(此皂化混合物包含肥皂、甘油、過量的NaOH 、乙醇)
7.倒入準備好之食塩水,輕輕攪拌數下即可(因生成的肥皂溶液在食塩水中,溶解度會降低,故可加入飽和食塩水,使肥皂析出,進而得到肥皂粗產品即皂基)
8.抽氣過濾,收集沉澱物(用冰水沖洗沉澱物)
9.再度倒入熱食塩 溶液(溫度約70℃) ,攪拌此混合物幾下就好?(可將皂基洗的更白,鹼性變弱形成皂漿)
10.抽氣過濾,收集沉澱物(用冰水沖洗沉澱物)
11.皂基,壓乾
(二)精製:
 1.10 g肥皂 + 10 ml酒精 + 9 ml甘油 (留5ml作消泡用)
1.10 g肥皂 + 10 ml酒精 + 9 ml甘油 (留5ml作消泡用)
2.至澄清,體積減少為1/2~2/3
3.待溫度降至50℃,加色料1 ml 及2~3滴香料
4.倒入模型中(模型先塗甘油)
Ps.甘油作為保濕劑及增加肥皂透明度

五、實驗結果:
計算產率?
六、問題與討論
1.使用皂基製作之手工香皂.成為固體後是當下可以使用?還是需靜置多久才可以使用?
「皂基」本身就是成皂,己經可以用了,故採用皂基做材料的手工皂,在成為固體時就可以用了。
「冷製皂」係用油與鹼來製成的,需靜置一~二個月才可以使用。
2.肥皂之乳化作用?
形成的肥皂分子結構是由許多碳與氫原子(c.H)形成一條長鏈,
長鍊的一端為親油性,另一邊的頂端在水中會解離成帶有正電 的離子而形成親水性;上述之親油性端非常極端,所以利用物 質具有『極性溶於極性』與『非極性溶於非極性』的特性,因 此,肥皂分子會利用親油端溶在油漬的污垢中,而形成『乳化 作用』
3.為何Ca(OH)2不能代替NaOH用於製備肥皂?
使用Ca(OH)2製備肥皂時,所產生的脂酸鈣,無法溶於水中而沉澱,因此無法用於一般的洗滌
4.肥皂之去汙原理?
肥皂分子具有親油性(長鏈狀碳氫部份~容於油不容水)和親水性(帶電原子團部分~容於水不容於油)2端在水中衣物上的油污被親油性的一端吸附 油污被包住後再由親水性一端牽入水中 使油汙與衣物分離 達到清潔效果
-
有机化学实验实验报告
实验一有机化学实验基本操作实验目的:1、使学生明白进入有机化学实验学习,必须阅读有机化学实验的一般知识的内容及安全实验是有机化学实…
-
有机化学实验报告模板
有机化学实验报告专业班级学号姓名实验名称实验时间年月日学生姓名同组人姓名第一部分实验预习报告一实验目的二实验原理包括实验装置简图三…
-
有 机 化 学 实 验 报 告
学院:化学工程学院专业:化学工程与工艺班级:姓名:李云龙学号104020xx224指导教师:肖勋文王冠南日期:20xx年x月x日实…
-
有机化学实验报告格式
实验学专班姓指导日机化学实验报告业化学工程与工艺教有一二三主要试剂及物理性质四试剂用量规格五仪器装置六实验步骤及现象七实验结果八实…
-
有机化学实验报告
实验学专班姓指导日机化学实验报告名称熔点测定院化工学院业化学工程与工艺级名学号教师房江华李颖期有一实验目的1了解熔沸点测定的意义2…
-
有机化学实验报告模板
有机化学实验报告专业班级学号姓名实验名称实验时间年月日学生姓名同组人姓名第一部分实验预习报告一实验目的二实验原理包括实验装置简图三…
-
有机化学实验预习报告模板
有机化学专业实验预习报告模板带气体吸收的回流装置分液蒸馏装置及操作四主要仪器及装置如回流装置加热套100mL圆底单口烧瓶球形冷凝管…
-
环己酮的制有机化学实验报告
实验学专班姓指导日机化学实验报告名称环己酮的制备业化学工程与工艺级名学号教师房江华李颖期有一实验目的1学习次氯酸氧化法制环己酮的原…
- 四川理工学院有机化学实验预习报告
-
丙酮与甲苯溶液的分离有机化学实验报告
丙酮与甲苯溶液的分离一实验目的1少量的丙酮与甲苯混合物的分离2掌握蒸馏和分馏的基本操作二实验原理1蒸馏纯粹的液态物质在大气压下都有…
-
20xx高中有机化学实验总结最全
(一)烃1.20xx有机化学基础实验甲烷的氯代(必修2、P56)(性质)实验:取一个100mL的大量筒(或集气瓶),用排水的方法先…