金属钠的性质与应用教案
金属钠的性质与应用教案
姓名:陈小妹 学号:2009364255 班别:09化本2班 学院:化学院
【教学目标】
1、通过实验探究,了解钠的物理性质,掌握钠的化学性质。 2、了解钠的存在、用途及制备方法。
3、通过实验操作及观察,培养学生根据对实验现象的分析形成结论的能力。 【教学重点】 1、钠的化学性质 【教学难点】
1、对钠与水反应实验现象的观察与分析,探究学习。 2、实验的设计、正确操作和现象分析。 【教学方法】
情景设计、实验探究、分析、归纳 【教学用具】
1、实验仪器:玻璃片、小刀、镊子、滤纸、燃烧匙。金属钠、酒精灯、滤纸、
石棉网、铁架台、胶头滴管、火柴、烧杯、洗气瓶、
2、实验药品:金属钠、酚酞、硫酸铜溶液,蒸馏水 3、其他用具:U盘、多媒体
板书版面设计:
专题2 第二单元
第一节 金属钠的性质与应用
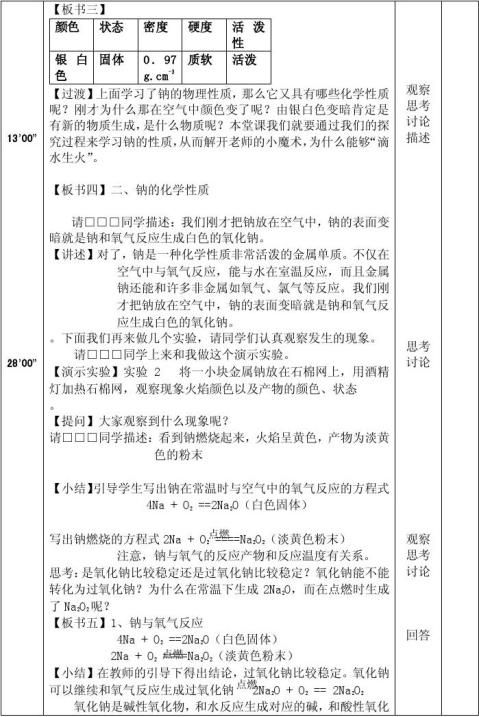
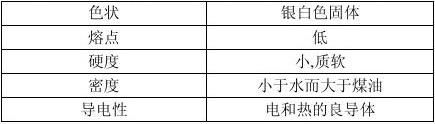
一、物理性质

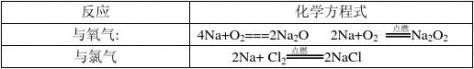
二、化学性质 1.Na与O2的反应
(1) 常温:4Na+O2=2Na2O (白色)
(2) 加热:2Na+O2= Na2O2(淡黄色)(2)化学方程式 2Na2O2 + 2H2O == 4NaOH + O2↑2O = 2NaOH + H2↑ 2Na2O2 + 2CO2 == 2Na2CO3 + O2↑
与其他物质反应
2Na + 2H2O === 2NaOH + H2↑
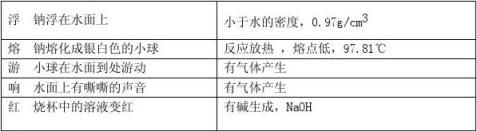
2. Na与H2O的反应 (1)现象
①浮——密度比水小
②熔——熔点低,放热 ③游—
有氢气生成
④响
⑤红——有碱性物质生成
2NaOH + CuSO4 === Cu(OH)2↓ + Na2SO4
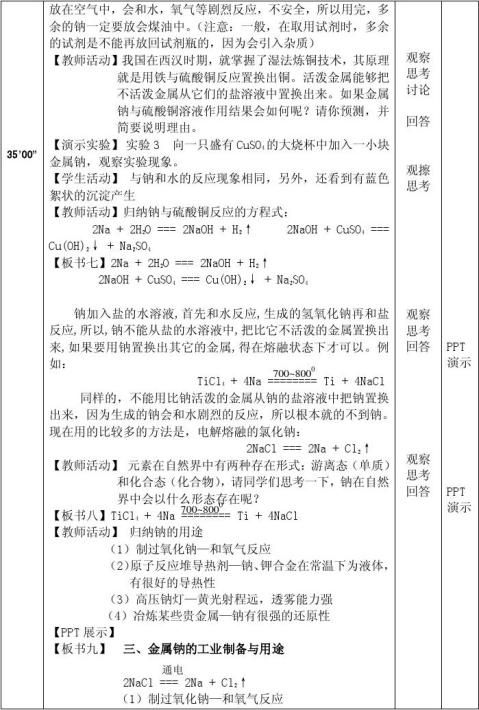
700~800 TiCl + 4Na ======== Ti + 4NaCl
4
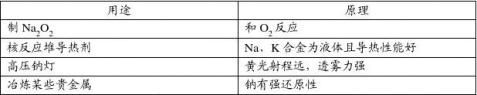
三、金属钠的工业制备与用途
通电
2NaCl === 2Na + Cl2↑ (1)制过氧化钠—和氧气反应
(2)原子反应堆导热剂—钠、钾合金在常温下为液体,有很好的导热性 (3)高压钠灯—黄光射程远,透雾能力强
(4)冶炼某些贵金属—钠有很强的还原性
课堂教学过程的设计与实施:




第二篇:金属钠的性质及应用(教案).doc

专题二:第二单元 钠镁及其化合物
金属钠的性质与应用
(精彩教案)
课时安排:1课时
教学目标:
1、 知识技能目标:了解钠的物理性质,初步掌握钠的化学性质,认识钠是一种很活泼
的金属。
2、 能力方法目标:培养学生的实验探究能力,观察描述能力和思维能力。
3、 情感态度目标:培养学生重视实验的科学态度和对学科实验的兴趣,培养与人合作
的精神。
教学重难点
重点:通过实验认识钠的化学性质。
难点:对实验现象的观察与分析,促进学生探究学习。
实验准备:
学生实验用品:小烧杯、玻璃片、滤纸、镊子、酚酞、蒸馏水、钠、硫酸铜溶液。
教师演示用品:小烧杯、玻璃片、滤纸、酚酞、硫酸铜溶液、镊子、蒸馏水、钠、1瓶氯气、酒精灯、铁架台(铁圈、铁夹)、石棉网、燃烧管。
多媒体课件
教学方法:实验法、问题探究法、讲解法
教学过程:
【引入】人们常说,水能灭火,水火不相容。下面我们做一个有趣的实验:请一个同学上来到讲台上用玻璃棒蘸取水点燃酒精灯。
【教师引导】在刚才的小魔术中奇妙现象产生的原因就是金属钠引起的。金属钠具有哪些性质和用途,这就是我们本节课所要研究的重点。
【板书】金属钠的性质和应用(课题)
【叙述】同学们,我们要研究一种物质,需要从以下几个方面研究:
物质的物理性质 物质的化学性质 制备方法 用途(保存方法)
【实验探究】 出示金属钠保存在煤油中的样品
1
(学生观察现象,得出结论:钠的密度大于煤油的密度且钠与煤油不反应)
【实验探究1】用镊子取一小块金属钠,并用滤纸吸干表面的煤油,用小刀切去一端的表层,观察表面的颜色;将其放置在空气中,观察表面颜色的变化。(一个同学上讲台做,一个同学观察并说出现象,以及能得到哪些结论?)
【结论】钠质软,银白色。
放置在空气中后表面会变暗(钠在空气中表面为什么会变暗呢?)
【学生活动】学生思考、交流与讨论。
【师生归纳】常温下,钠与空气中的氧气反应生成白色的氧化钠(Na2O)覆盖在银白色的钠表面,使金属失去光泽,看起来变暗。(让学生写出方程式:4Na+O2===2Na2O)
【教师设问】钠在常温下跟氧气生成氧化钠,那么在加热或者点燃的条件下又如何呢?
【实验探究2】将一小块金属钠放在一支硬质玻璃管中,用酒精灯对其加热,观察实验现象
【现象】钠熔化成银白色小球,剧烈燃烧,产生黄色火焰,生成淡黄色固体
【归纳】淡黄色固体为过氧化钠(Na2O2),过氧化钠是重要的化工原料。(让学生写出方程式 2Na+O

2Na2O2)
【问题探究2】氧化钠能否变成过氧化钠呢?
【结论】能。氧化钠可以被继续氧化,生成过氧化钠。(让学生写:2Na2O+O2 ===2Na2O2)
【设问】钠与非金属单质氧气能发生反应,那钠能跟其他非金属单质反应吗?
【实验探究3】将一小块金属钠放置在石棉网上,对其加热至熔化,迅速将一瓶氯气倒扣在钠上,观察实验现象
【现象】冒白烟(让学生写出方程式2Na+Cl)
【结论】通过以上的探究,钠不但能跟氧气、氯气等反应,还能跟很多非金属单质反应,比如硫(S)、溴(Br2)、碘〔I2〕等分别生成:硫化钠(Na2S)、溴化钠(NaBr)、碘化钠(NaI)等。
【引入】钠除了能跟非金属反应外,还能和什么样的物质发生反应呢?
【实验探究4】(分组实验)向一只盛有水的大烧杯中滴加几滴酚酞试液,然后将一小块
(引导学生从元素化合价变化的角度分析反应产物有氢气)【问题探究3】钠为什么要保存在煤油当中?
【讨论归纳】钠保存在煤油中是为了防止钠与氧气、水等物质接触而发生反应。所以必须用煤油覆盖住以隔绝空气。
2
【问题探究4】为什么取用钠时要用镊子呢?
【讨论归纳】钠对皮肤有很强的腐蚀性(皮肤表面有水),所以不能用手拿 【问题探究5】在取用钠时,多余的钠能否放回煤油中呢?
【讨论归纳】对块状或粒状固体取用后可以放回原试剂瓶中,但对于粉末状或者溶液等则不能放回原试剂瓶中,金属钠必须放回煤油中。
【问题探究6】我国在西汉时期,就掌握了湿法炼铜技术,其原理就是用铁与硫酸铜反应置换出铜。活泼金属能够把不活泼金属从它们的盐溶液中置换出来。如果金属钠与硫酸铜溶液作用结果会如何呢?请你预测,并简要说明理由。
【学生实验探究5】向一只盛有CuSO4的大烧杯中加入一小块金属钠,观察实验现象。 【现象】生成无色气体和蓝色沉淀:2Na+CuSO4+2H2O=Cu(OH)2 【动画演示】微观角度解释
【讨论归纳】常温下能与水反应的活泼金属与盐溶液反应时应先考虑金属与水的反应。但活泼金属与无水的盐在熔化状态下可以发生置换反应。如工业上制钛。方程式为: TiCl4
【总结】钠很活泼既能跟非金属反应,也能跟水等反应。但钠如何制取呢?
【叙述】19世纪初,科学家戴维解开了这个谜团。在实验室中首先制得了金属钠。也就是电解熔融的氯化钠。方程式为:2NaCl 2Na+Cl2
【叙述】以上讨论了钠的物理性质、化学性质、保存方法以及制法。那么金属钠有哪些700-800°C
【叙述】这节课我们跟大家一起讨论了钠的物理性质、化学性质、保存方法、制取方法和用途。总结如下:
1.物理性质:
2.化学性质:
3
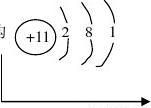
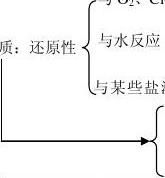


【课堂小结】
从以上探究中知道钠很活泼,它的结构是
、S等非金属反应
决定
存在形态-----化合态
用 途
【例题巩固】
1.下列液体可以用来保存金属钠的是 ( )
A.水 B.浓NaOH溶液 C.煤油 D.CCl4(d>1g/cm3)
2.钠与水反应时的现象与钠的下列性质无关的是 ( )
A.钠的熔点低 B.钠的密度小 C.钠的硬度小 D.钠有强还原性
3.下列关于金属钠的叙述,错误的是 ( )
A.很软,具有银白色光泽 B.是电和热的良导体
C.比水轻,比煤油重,熔点低于100℃ D.和FeCl3溶液反应可以置换出单质铁
4.将一小块金属钠投入氯化铁溶液中的化学反应方程式为
5.金属钠着火时,能用来灭火的是( )
A.水 B.湿抹布盖灭 C.干沙 D.泡沫灭火剂
讨论:宝应中学高一化学备课组
主备人:梁鸿
复备人:王飞
审核人:杨宝林
5 2005-11-22于高邮中学
-
高中化学金属钠的性质知识点总结
一金属钠2钠的化学性质钠原子最外层只有一个电子在化学反应中钠原子容易失去最外层的一个电子具有很强的还原性是一种活泼的金属元素12钠…
-
金属钠的性质和非金属氯的性质总结
重要的元素及其化合物之间相互转化氯钠篇1请写出Cl2和ClI和I2的之间相互转化每个转化之间至少不少于4条方程式Br和Br2至少1…
-
《金属钠的性质》的教学反思
金属钠的化学性质教学反思高中化学教材中金属钠的化学性质的第一节这一节课内容不难理解主要是记忆增强活泼金属还原性的理解对金属镁和金属…
-
金属钠的性质
金属的物理性质和化学性质一金属的物理性质及其用途二常见金属的化学性质1金属与氧气反应2金属与水发生反应3金属与酸发生反应4金属与某…
-
金属钠的性质与应用
第三届全国高等院校化学专业师范生教学素质大赛教学设计姓名学号课题顾佳萍08090146金属钠的性质与应用1金属钠的性质与应用设计课…
-
高中化学金属钠的性质知识点总结
一金属钠2钠的化学性质钠原子最外层只有一个电子在化学反应中钠原子容易失去最外层的一个电子具有很强的还原性是一种活泼的金属元素12钠…
-
金属钠的性质和非金属氯的性质总结
重要的元素及其化合物之间相互转化氯钠篇1请写出Cl2和ClI和I2的之间相互转化每个转化之间至少不少于4条方程式Br和Br2至少1…
-
金属钠的性质与应用
第三届全国高等院校化学专业师范生教学素质大赛教学设计姓名学号课题顾佳萍08090146金属钠的性质与应用1金属钠的性质与应用设计课…
-
《金属钠的性质》的教学反思
金属钠的化学性质教学反思高中化学教材中金属钠的化学性质的第一节这一节课内容不难理解主要是记忆增强活泼金属还原性的理解对金属镁和金属…
-
金属钠的性质教学设计
金属钠的性质与应用教学设计设计罗银先福建师大附中点评王晓聪厦门湖里区教师进修学校一概述本节课是高一化学必修1专题二从海水中获得的化…