物理化学实验报告
电导法测定乙酸乙酯皂化反应的速率常数
一.实验目的
1.掌握电导法测定反应速率常数的原理和方法;
2.了解二级反应的特点,学会用图解计算法求取二级反应的速率常数;
3.用电导法测定乙酸乙酯皂化反应的速率常数,了解反应活化能的测定方法。
二.实验原理
乙酸乙酯皂化是一个二级反应,其反应式为:

反应速率方程为:
在反应过程中,各物质的浓度随时间而变。测定该反应体系组分浓度的方法很多,例如,可用标准酸滴定测出不同时刻OH-离子的浓度。本实验使用电导率仪测量皂化反应进程中体系电导值G随时间的变化,从而达到跟踪反应物浓度随时间变化的目的,进而可求算反应的速率常数。
若反应物 和NaOH的初始浓度相同(均设为c),设反应时间为t时,反应所产生的
和NaOH的初始浓度相同(均设为c),设反应时间为t时,反应所产生的 和
和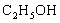 的浓度为x,若逆反应可忽略,则反应物和产物的浓度时间的关系为:
的浓度为x,若逆反应可忽略,则反应物和产物的浓度时间的关系为:

t=0 c c 0 0
t=t c-x c-x x x
t=∞ →0 →0 →c →c
上述二级反应的速率方程可表示为:
 (1)
(1)
积分得:
 或
或  (2)
(2)
显然,只要测出反应进程中任意时刻t时的x值,再将已知浓度c代入上式,即可得到反应的速率常数k值.
因反应物是稀水溶液,故可假定 全部电离。则溶液中参与导电的离子有Na+、OH-和
全部电离。则溶液中参与导电的离子有Na+、OH-和 等,Na+在反应前后浓度不变,OH-的迁移率比
等,Na+在反应前后浓度不变,OH-的迁移率比 的大得多.随着反应时间的增加,OH-不断减少,而
的大得多.随着反应时间的增加,OH-不断减少,而 不断增加,所以体系的电导值不断下降。在一定范围内,可以认为体系电导值的减少量与
不断增加,所以体系的电导值不断下降。在一定范围内,可以认为体系电导值的减少量与 的浓度x的增加量成正比,即:
的浓度x的增加量成正比,即:
t=t x=β(G0 - Gt) (3)
t=∞ c=β(G0 - G∞) (4)
式中,G0和Gt分别是溶液起始和t时的电导值, G∞为反应终了时的电导值,β是比例系数。将(3)、(4)代入(2)得:
 (5)
(5)
据上式可知,只要测出G0、G∞和一组Gt值,据(5)式,由 对t作图,应得一直线,从其斜率即可求得速率常数k值,k的单位为min-1·mol-1·L。
对t作图,应得一直线,从其斜率即可求得速率常数k值,k的单位为min-1·mol-1·L。
三.仪器与试剂
DDSJ-308型数字电导率仪 1台 双管电导池 1个
移液管(10 mL) 2支 DJS-1型铂黑电极 1支
洗耳球 1只 NaOH(分析纯)
CH3COONa(分析纯) CH3COOC2H5(分析纯)
四.实验步骤
1.开启电导仪电源,预热。
2. G0的测定
(1)将洗净的电导池用0.0100mol/L的NaOH溶液润洗三次后,倒入适量0.0100 mol/L NaOH溶液(以能浸没铂黑电极并高出1cm为宜)。
(2)用电导水洗涤铂黑电极,再用0.0100 mol/L 溶液淋洗,然后插入电导池中。
(3)在室温下测量溶液的电导值,每隔2 min测量一次,共3次,取平均值。
3.G∞的测定
实验测定中,不可能等到t → ∞,且反应也并不完全不可逆,通常将0.01 00mol/L 的CH3COONa溶液的电导值作为G∞,测量方法与G0的测量方法相同。但必须注意,每次更换测量溶液时,须用电导水淋洗电极和电导池,再用被测溶液淋洗三次。
4.Gt的测定
(1)将双管电导池用电导水洗净后烘干,用待测溶液润洗电导池三次。
(2)用移液管量准确取20 mL 0.0200 mol/L NaOH溶液放入洗净并干燥的电导池的A管, 用另一支移液管吸取20 mL 0.0200 mol/L CH3COOC2H5溶液注入电导池的B管中。
(3)将CH3COOC2H5溶液快速倒入A管中,溶液倒入一半时,开始计时,并继续将剩余的溶液全部倒入A管,再将A管中的溶液倒入B管,如此反复几次,使溶液混合均匀,并立即测量溶液的电导值。
(4)记录第一个数据,然后每隔2 min测量一次,直至电导值基本不变为止。
(5)实验结束,关闭电导仪电源,洗净电导池和电极,将电极浸没在蒸馏水中。
5.反映活化能的测定
按上述操作步骤测定另一个温度时的反应速率常数,并按阿仑尼乌斯公式计算活化能。
ln(k2/k1)= 
式中k1.k2分别为温度T1,T2时测得的反应速率常数,R是摩尔气体常数,E为反应的活化能。
五.实验数据记录与处理
1、数据记录表


由实验所得直线的斜率为kc=0.0003,求得反应的速率常数k=0.03 L·mol-1·min-1
2、活化能的计算


R=8.314J/(molK);活化能E=20280J/mol
六.误差分析
实验所得反应速率常数与理论值有较大偏差,分析可能产生误差的原因有:
(1)由于空气中的CO2会溶入电导水和配制的NaOH溶液中,使溶液浓度发生改变,从而导致测得的实验数据有误差。
(2)CH3COOC2H5溶液和NaOH溶液故不是新鲜配制的,浓度可能发生变化而导致误差。
(3)实验计时不准确、仪器灵敏度下降或仪器示数不稳定时读数也可造成误差。
七.思考题
1、为何本实验要在恒温条件下进行,且NaOH和CH3COOC2H5溶液在混合前还要预先恒温?
答:因为反应的速率常数与温度有关,如果温度不恒定,则速率常数不是定值,实验无法测定。
2、若氢氧化钠溶液和乙酸乙酯的起始浓度不相等,应如何计算k值?
答:需要重新推导其动力学方程式。设氢氧化钠溶液和乙酸乙酯溶液的起始浓度分别为a和b则其动力学方程式为 式中x为t时刻产物的浓度。
式中x为t时刻产物的浓度。
3、如果两溶液均为浓溶液,能否用相同的方法求k值?为什么?
答:不能。因为实验原理成立的先决条件是电导与浓度成正比例关系,如果为浓溶液,则电导很低,试验将无法进行。
4、为什么氢氧化钠和乙酸乙酯的浓度必须足够低?
答:实验原理成立的先决条件是电导与浓度成正比例关系,而其中的比例系数K=∧m/Kcell,若使K成为与浓度无关的常数,需将∧m以∧m∞代替,则要求电解质的浓度足够稀。
第二篇:物理化学实验报告-蔗糖水解
 化学化工学院
化学化工学院
学生姓名:刘纪磊
学 号: 14101700483
指导老师:张建策
专业班级:10级化学师范班
实验三 蔗糖水解反应速度常数的测定
一、 实验目的
1、 根据物质的光学性质研究蔗糖水解反应,测定其反应速度常数。
2、 了解旋光仪的基本原理,掌握其使用方法。
二、实验原理
蔗糖在水中转化成葡萄糖与果糖,其反应为:
C12H22O11 + H2O C6H12O6 + C6H12O6
C6H12O6 + C6H12O6
(蔗糖) (葡萄糖) (果糖)
速率方程可由下式表示:
—
c为时间t时的反应物浓度,k为反应速率常数。
积分可得:
lnc=-kt + lnc0
c0为反应开始时反应物浓度。
反应的半衰期为:t1/2=
蔗糖及其转化产物,都具有旋光性,而且它们的旋光能力不同,故可以利用体系在反应进程中旋光度的变化来度量反应进程。
当其它条件均固定时,旋光度α与反应物浓度c呈线性关系,即
α=Kc
设最初系统的旋光度为 α0=K反cA,0 (t=0,蔗糖尚未水) (1)
最终系统的旋光度为 α∞=K生cA,0 (t=∞,蔗糖已完全水解)(2)
当时间为t时,蔗糖浓度为cA,此时旋光度为αt
αt= K反cA+ K生(cA,0-cA) (3)
联立(1)、(2)、(3)式可得:
cA,0= =K′(α0-α∞) (4)
=K′(α0-α∞) (4)
cA= = K′(αt-α∞) (5)
= K′(αt-α∞) (5)
将(4)、(5)两式代入速率方程即得:
ln(αt-α∞)=-kt+ln(α0-α∞)
我们以ln(αt-α∞)对t作图可得一直线,从直线的斜率可求得反应速率常数k,进一步也可求算出t1/2。
三、 仪器和试剂
仪器:型号为WZZ-1的自动指示旋光仪一台;移液管(25ml)2支;烧杯(150ml)2个;吸耳球1个;秒表1块;容量瓶(50ml)1个;锥形瓶(100ml)2个;
试剂:蔗糖(AR);HCl溶液。
四、 实验步骤
1、 配制溶液
配制蔗糖溶液:用天平称取10克蔗糖放入烧杯中,加蒸馏水溶解后转移到50ml容量瓶中,稀释至刻度。
配制2mol/LHCl溶液:用移液管吸取一定量的浓HCl,加水稀释至2mol/L.
2、αt 的测定
用25ml移液管移取25ml蔗糖水溶液注入一锥形瓶,将HCl溶液倾倒至蔗糖溶液中,边放边振荡,当HCl溶液倒下同时按下秒表计时(注意:秒表一经启动,勿停直至实验完毕)。然后用两锥形瓶互相倾倒,使溶液混合均匀。用反应混合液将旋光管洗涤2-3次后,将反应混合液装满旋光管,擦净后放入旋光仪,测定规定时间的旋光度。分别记录从混合起4min、6min、8min、10min、15min、20min、30min、40min、50min、60min的旋光度。
3、α∞的测定
将剩余的反应混合物放入60-70℃恒温槽中加热30min,使反应充分后,冷却至室温后测定体系的旋光度。
4、试验结束后切记将旋光管内外用蒸馏水洗净,擦干,防止酸对旋光管和仪器的腐蚀。
五、数据处理
1、将实验数据记录与下表
室温: 24℃;大气压:998.6Kpa ;HCl浓度: 2mol/L ;反应温度: 25℃ ;α∞: -1.697 。

2、以ln(αt—α∞)对t作图

Y = A + B * X
Parameter Value Error
------------------------------------------------------------
A 3.19689 0.0143
B -0.01066 4.6545E-4
------------------------------------------------------------
R SD N P
--------------- --------------------------------------------
-0.99246 0.02768 10 <0.0001
3.由直线斜率求蔗糖水解反应的速率常数,并计算半衰期。
由拟合直线可得直线的斜率为-0.01066,即k=0.01066s¹.
t1/2= =0.693/0.01066=65.0232s
=0.693/0.01066=65.0232s
据文献参考值可知k298=0.01116,所以实验存在误差
相对偏差=|0.01066-0.01116|/0.01116=4.48%
-
大学物理化学实验报告
物理化学实验报告年月日评定姓名学号年级专业室温大气压一实验名称BET容量法测定固体的比表面积二实验目的三实验原理四实验数据及处理五…
-
物理化学实验报告
《大学化学基础实验2》实验报告课程:物理化学实验专业:环境科学班级:学号:学生姓名:指导教师:实验日期:5月24日实验一、溶解焓的…
-
物理化学实验报告
物理化学实验报告院系班级学号姓名1实验一计算机联用测定无机盐溶解热日期20xxXX同组者姓名XXXXX成绩一实验目的1用量热计测定…
-
物理化学实验实验报告四
二组分完全互溶系统的气液平衡相图一实验目的1学习测定气液平衡数据及绘制二元系统相图的方法加深理解相律和相图等概念2掌握正确测量纯液…
-
物理化学实验总结报告.
物理化学实验总结报告班级11精化学号311120xx30实验1二组分金属相图的绘制11实验的操作关键要点1用电炉加热样品时温度要适…
-
物理化学实验心得
物理化学实验总结姓名徐燕霞学号311120xx18一、物理化学实验的目的与要求(一)物理化学实验教学的目的:1.通过物理化学实验,…
-
物理化学实验结课总结
物理化学实验总结报告物理化学实验结课了,在本学期中,我们总共做了8个实验,应当说收获颇丰。首先由于实验室条件所限,所以我们采用了两…
-
物理化学实验总结
闽江学院化学与化学工程系10级应化(2)班柳泽玲120xx1202240通过这个学期的大学物化实验,我体会颇深。首先,我通过做实验…
-
物理化学实验心得
物理化学实验心得09级化学师范朱健这次的实验都是以我们学生自己为核心,强调的是学生的主动性,我们的每一个实验都是认认真真的完成,一…
-
物理化学学习心得(合工大)
新能源11—1杨雨峰20xx1886物理化学学习心得《物理化学》作为一门物理与化学的交叉学科,其内容涉及物理、化学知识及两者知识的…
-
化学实验报告格式
化学实验报告格式例一定量分析实验报告格式(以草酸中h2c2o4含量的测定为例)实验题目:草酸中h2c2o4含量的测定实验目的:学习…