化学选修五前三章公式总结
甲烷燃烧
CH4+2O2→CO2+2H2O(条件为点燃)
甲烷隔绝空气高温分解
甲烷分解很复杂,以下是最终分解。CH4→C+2H2(条件为高温高压,催化剂)
甲烷和氯气发生取代反应
CH4+Cl2→CH3Cl+HCl
CH3Cl+Cl2→CH2Cl2+HCl
CH2Cl2+Cl2→CHCl3+HCl
CHCl3+Cl2→CCl4+HCl (条件都为光照。 )
实验室制甲烷
CH3COONa+NaOH→Na2CO3+CH4(条件是CaO 加热)
乙烯燃烧
CH2=CH2+3O2→2CO2+2H2O(条件为点燃)
乙烯和溴水
CH2=CH2+Br2→CH2Br-CH2Br
乙烯和水
CH2=CH2+H20→CH3CH2OH (条件为催化剂)
乙烯和氯化氢
CH2=CH2+HCl→CH3-CH2Cl
乙烯和氢气
CH2=CH2+H2→CH3-CH3 (条件为催化剂)
乙烯聚合
nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)
氯乙烯聚合
nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)
实验室制乙烯
CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)
乙炔燃烧
C2H2+3O2→2CO2+H2O (条件为点燃)
乙炔和溴水
C2H2+2Br2→C2H2Br4
乙炔和氯化氢
两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2
乙炔和氢气
两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6 (条件为催化剂)
实验室制乙炔
CaC2+2H2O→Ca(OH)2+C2H2↑
以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
CaCO3 === CaO + CO2 2CaO+5C===2CaC2+CO2
CaC2+2H2O→C2H2+Ca(OH)2
C+H2O===CO+H2-----高温
C2H2+H2→C2H4 ----乙炔加成生成乙烯
C2H4可聚合
苯燃烧
2C6H6+15O2→12CO2+6H2O (条件为点燃)
苯和液溴的取代
C6H6+Br2→C6H5Br+HBr
苯和浓硫酸浓硝酸
C6H6+HNO3→C6H5NO2+H2O (条件为浓硫酸)
苯和氢气
C6H6+3H2→C6H12 (条件为催化剂)
乙醇完全燃烧的方程式
C2H5OH+3O2→2CO2+3H2O (条件为点燃)
乙醇的催化氧化的方程式
2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这是总方程式)
乙醇发生消去反应的方程式
CH3CH2OH→CH2=CH2+H2O (条件为浓硫酸 170摄氏度)
两分子乙醇发生分子间脱水
2CH3CH2OH→CH3CH2OCH2CH3+H2O (条件为催化剂浓硫酸 140摄氏度)
乙醇和乙酸发生酯化反应的方程式
CH3COOH+C2H5OH→CH3COOC2H5+H2O
乙酸和镁
Mg+2CH3COOH→(CH3COO)2Mg+H2
乙酸和氧化钙
2CH3COOH+CaO→(CH3CH2)2Ca+H2O
乙酸和氢氧化钠
CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH
乙酸和碳酸钠
Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑
甲醛和新制的氢氧化铜
HCHO+4Cu(OH)2→2Cu2O+CO2↑+5H2O
乙醛和新制的氢氧化铜
CH3CHO+2Cu→Cu2O(沉淀)+CH3COOH+2H2O
乙醛氧化为乙酸
2CH3CHO+O2→2CH3COOH(条件为催化剂或加温)
烯烃,炔烃与高锰酸钾发生氧化还原反应,褪色(方程式不作要求) 烯烃,炔烃与Br2水,Br2-CCl4,液Br2发生加成反应:
CH2=CH2+Br2===CH2Br-CH2Br
CH≡CH+Br2===CHBr=CHBr
苯与高锰酸钾,溴水(萃取出Br2),溴-CCL4不反应;而与液溴在FeBr3作催化剂下反应,生成溴苯!
C6H6+Br2==FeBr3===C6H5Br+HBr(遇到空气变成白雾,是蓝色石蕊试纸变红)
苯系物与高锰酸钾溶液反应,生成苯甲酸(紫色退去);与溴水(萃取出Br2),溴-CCL4不反应;而与液溴在FeBr3作催化剂下反应,生成溴苯类物质!
实验室制甲烷
CH3COONa+NaOH→Na2CO3+CH4 (条件是CaO 加热)
实验室制乙烯
CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)
实验室制乙炔
CaC2+2H2O→Ca(OH)2+C2H2↑
工业制取乙醇:
C2H4+H20→CH3CH2OH (条件为催化剂)
乙醛的制取
乙炔水化法:C2H2+H2O→C2H4O(条件为催化剂,加热加压)
乙烯氧化法:2 CH2=CH2+O2→2CH3CHO(条件为催化剂,加热)
乙醇氧化法:2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂,加热) 乙酸的制取
乙醛氧化为乙酸 :2CH3CHO+O2→2CH3COOH(条件为催化剂和加温) 加聚反应:
乙烯聚合
nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)
氯乙烯聚合
nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)
氧化反应:
甲烷燃烧
CH4+2O2→CO2+2H2O(条件为点燃)
乙烯燃烧
CH2=CH2+3O2→2CO2+2H2O(条件为点燃)
乙炔燃烧
C2H2+3O2→2CO2+H2O (条件为点燃)
苯燃烧
2C6H6+15O2→12CO2+6H2O (条件为点燃)
乙醇完全燃烧的方程式
C2H5OH+3O2→2CO2+3H2O (条件为点燃)
乙醇的催化氧化的方程式
2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)
乙醛的催化氧化:
CH3CHO+O2→2CH3COOH (条件为催化剂加热)
第二篇:《化工原理》公式总结
第一章 流体流动与输送机械
1. 流体静力学基本方程:
2. 双液位U型压差计的指示:  )
)
3. 伯努力方程: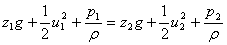
4. 实际流体机械能衡算方程: +
+
5. 雷诺数:
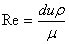
6. 范宁公式: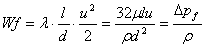
7. 哈根-泊谡叶方程: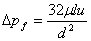
8. 局部阻力计算:流道突然扩大: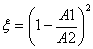 流产突然缩小:
流产突然缩小: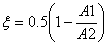
第二章 非均相物系分离
1. 恒压过滤方程:
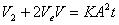
令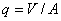 ,
,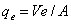 则此方程为:
则此方程为: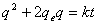
第三章 传热
1. 傅立叶定律: ,
,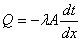
2. 热导率与温度的线性关系: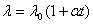
3. 单层壁的定态热导率: ,或
,或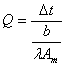
4. 单层圆筒壁的定态热传导方程:  或
或
5. 单层圆筒壁内的温度分布方程: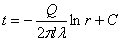 (由公式4推导)
(由公式4推导)
6. 三层圆筒壁定态热传导方程: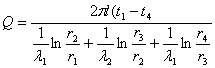
7. 牛顿冷却定律: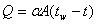 ,
,
8. 努塞尔数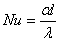 普朗克数
普朗克数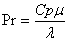 格拉晓夫数
格拉晓夫数
9. 流体在圆形管内做强制对流:
 ,
,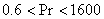 ,
,
 ,或
,或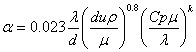 ,其中当加热时,k=0.4,冷却时k=0.3
,其中当加热时,k=0.4,冷却时k=0.3
10. 热平衡方程: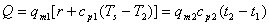
无相变时: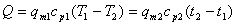 ,若为饱和蒸气冷凝:
,若为饱和蒸气冷凝: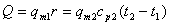
11. 总传热系数:
12. 考虑热阻的总传热系数方程: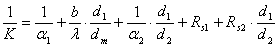
13. 总传热速率方程:
14. 两流体在换热器中逆流不发生相变的计算方程: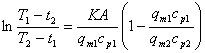
15. 两流体在换热器中并流不发生相变的计算方程: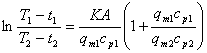
16. 两流体在换热器中以饱和蒸气加热冷流体的计算方程:
第四章 蒸发
1. 蒸发水量的计算: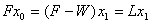
2. 水的蒸发量: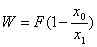
3. 完成时的溶液浓度: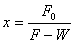
4. 单位蒸气消耗量: ,此时原料液由预热器加热至沸点后进料,且不计热损失,r为加热时的蒸气汽化潜热r’为二次蒸气的汽化潜热
,此时原料液由预热器加热至沸点后进料,且不计热损失,r为加热时的蒸气汽化潜热r’为二次蒸气的汽化潜热
5. 传热面积: ,对加热室作热量衡算,求得
,对加热室作热量衡算,求得 ,
, ,T为加热蒸气的温度,t1为操作条件下的溶液沸点。
,T为加热蒸气的温度,t1为操作条件下的溶液沸点。
6. 蒸发器的生产能力: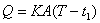
7. 蒸发器的生产强度(蒸发强度):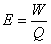
第六章 蒸馏
1. 乌拉尔定律: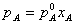 ,
,
2. 道尔顿分定律:
3. 双组分理想体系气液平衡时,系统总压、组分分压与组成关系: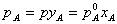 ,
,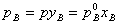
4. 泡点方程: ,露点方程:
,露点方程:
5. 挥发度: ,
,
6. 相对挥发度: 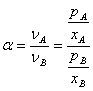 ,或
,或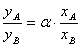
7. 相平衡方程: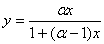
8. 全塔物料衡算: ,
,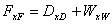
9. 馏出液采出率: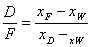
10. 釜液采出率: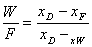
11. 精馏段操作线方程: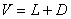 ,
,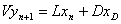 ,
,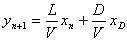
令 (回流比),则
(回流比),则
12. 提馏段操作线方程: 总物料衡算: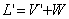 ,易挥发组分的物料衡算:
,易挥发组分的物料衡算: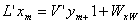
即
13. 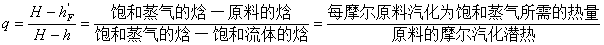
14. q线方程(进料方程):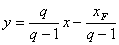
15. 芬斯克方程:
第七章 干燥
1. 湿度: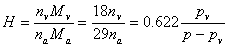
2. 相对温度: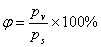
3. 湿比热容: ,在0~120℃时,
,在0~120℃时, 
4. 湿空气焓: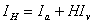 ,具体表达式为:
,具体表达式为:
5. 湿比体积: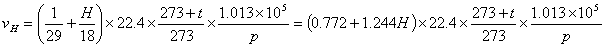
6. 露点温度: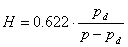 ,即
,即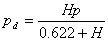
7.
-
数学必修五知识点总结归纳
必修五知识点总结归纳一解三角形1正弦定理在C中abc分别为角C的对边R为C的外abc2RsinsinsinC正弦定理的变形公式a2…
-
高中数学必修五(人教版)知识点总结。
高中数学必修5知识点一解三角形1正弦定理在C中abc分别为角C的对边R为C的外接圆的半径则有asinbsina2RcsinC2R正…
-
高中数学必修五公式
读史使人明智读诗使人灵秀数学使人周密培根高中数学必修五公式第一章三角函数abc2RR为三角形外接圆半径一正弦定理sinAsinBs…
-
人教版数学必修五知识点总结
第一章解三角形1、内角和定理:(1)三角形三角和为?,任意两角和与第三个角总互补,任意两半角和与第三个角的半角总互余.(2)锐角三…
-
高中数学必修五公式整理
高中数学必修五公式声明本文非原创由于界面阅读感不好而本人进行重新排版第一章三角函数abc2RR为三角形外接圆半径一正弦定理sinA…
-
【人教版】高中化学选修5知识点总结:第二章烃和卤代烃
第二章烃和卤代烃课标要求1.以烷、烯、炔和芳香烃的代表物为例,比较它们在组成、结构和性质上的差异。2.了解天然气、石油液化气和汽油…
-
高中化学有机化学实验总结
高中化学有机化学实验总结(必修二加选修五)1、石油的分馏(1)两种或多种相差较大且的液体混合物,要进行分离时,常用这种分离方法。(…
-
高中化学选修五 实验提纲
高三总复习选修四实验提纲1.实验1-1含有杂质的工业乙醇的蒸馏【知识迁移:无水乙醇的制备】2.实验1-2苯甲酸的重结晶【知识迁移:…
-
高中化学选修三、选修五部分易错点、细节知识总结
高中化学选修三、选修五部分易错点、细节知识总结回归教材1.芳香烃没有官能团。注意醚的官能团的碳碳单键。2.范霍夫——勒贝尔碳价四面…
-
高中化学必修1、2选修3、4、5实验总结
必修11、P5粗盐的提纯2、P6SO42-检验3、P7蒸馏水的制取4、P9萃取与分液5、P13电解水6、P16配制一定物质的量浓度…