《原毁》知识点总结
[原毁]
1、实词及短语:
原毁 重以周 轻以约 艺人 即其新 究其旧 恐恐然 有得 已廉 不足称 怠 忌 懦者
2、通假:有本有原(源)强者必说(悦)于言,懦者必说(悦)于色 难已(矣)
3、词类活用:人乐为善(意动)即其新,不究其旧(形名)外以欺于人,内以欺于心(名状)惟惧其人之有闻(动名)吾未见其尊己也(意动)必其人之与也(动名)而望名誉之光(名动 发扬光大)
4、一词多义:
闻 闻古之人有舜者(动 听说)惟惧其人之有闻也(名 名声)以久特闻(使动 为人所知)博闻强志(名 听闻 知识 )
善 能善事,是足为艺人矣(动 擅长)其人不得为善之利(名 善事)我善是,是亦足矣(名 好的行为,指优点)
病 吾之病也(名 毛病,缺点)饥冻虽切,违己交病(形 身心感到痛苦)
已 不亦待其身者已廉乎(副 太)学不可以已(动 停止)汤之问棘也是已(通“矣”)
原 原毁(推论本原) 有本有原(根源)
与 必其人之与也(动作名,指结交的人)怠与忌之谓也(连 和)不与同其利者也(介 和)吾与点也 (动 赞同)其可怪也与(语气助词 吗)
廉 其待己也廉(形 少)其行廉,故死而不容(形 正直)物美价廉(形 价格低)
用 彼虽善事,其用不足称也(名 指才能)用心一也(动 上心) 凡用兵之法,全国为上,破国次之(动 采用)物尽其用(名 用途)
5、虚词:
以 重以周 轻以约(连 并列)早夜以思(连 修饰)外以欺于人 内以欺于心(连 用来)不以众人待其身 而以圣人望于人(介 用)
而 彼能是,而我乃不能是(连 转)未少有得而止矣(连 承接 就)
之 古之君子(结助 的)恐恐然惟惧其人之不得为善之利(结助 取独; 的)怠与忌
之谓也(结助 提宾)
其 其责己也重以周(代 他们)恐恐然惟惧其人之不得为善之利(代 那些)其国家可几而理欤(语气副词 大概 )
6、句式:
(1)判断句 其为人也,仁义人也 舜,大圣人也
(2)宾语前置 怠与忌之谓也
(3)定语后置 古之人有舜者
(4)介宾后置 是不亦责于身者重以周乎尝试语于众曰
三、结构及简析
? 第一部分(1至4)古代君子对人对己标准
? 第一段:提出古代君子对己对人的标准,即对己“重以周”,对人“轻以约”。 ? 第二、三段:具体说明古代的舜、周公都是对自己“重以周”的人,他们对
自己标准很高,看到的是自己的不足。
? 第四段:具体说明舜、周公这样的人对人都能“轻以约”,看到别人每一点
优点,看到别人的进步,担心别人的优点不被人看到。
? 第二部分(5至8)今之君子对人详对己廉的错误态度。
? 第五段:今之君子对己廉的原因是对自己优点看的多,对自己很满足。 ? 第六段:今之君子对人详的原因是看不起别人的优点,却抓住别人的某一
缺点不顾其他。
? 第七段:指出今之君子对人对己的不正确态度,实际是对自己的不尊重。 ? 第八段:作者用自己的亲身体验来说明今之君子党同伐异、嫉贤妒能的恶
劣作风。
? 第三部分(9):总结全文,指出作者写本文的目的,希望引起当权者的重
视。
? 韩愈的论说文一般都具有结构严谨、说理透辟、逻辑严密的特点,本文亦
如此。由古到今、由正到反,进行对比论证是本文又一突出特点。《古文观止》评价说它“全用重周、轻约、详廉、怠忌八字立说”,目的在于指出“毁”之本原。此外文章还运用一些反复句式,回环迂曲,增强了表达效果。
第二篇:原电池章节知识点总结
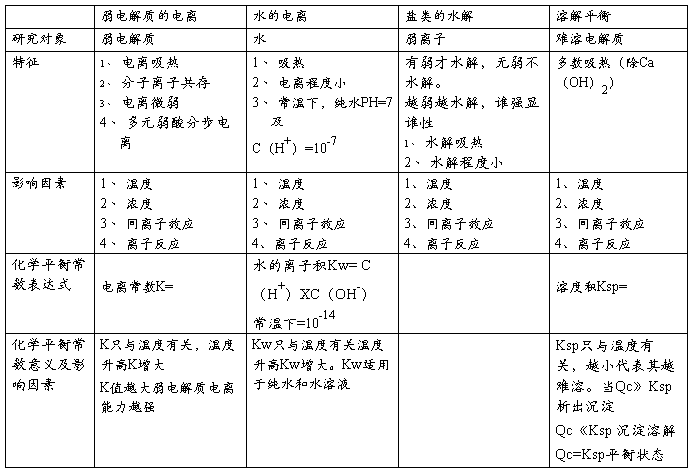
第四章电化学基础知识点整理
1.原电池和电解池的比较:
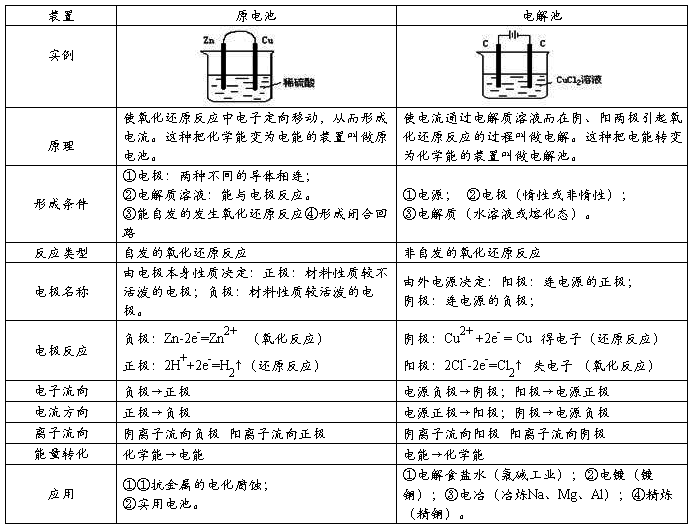
2、原电池正负电极的判断
1)根据电极材料:较活泼一极为负,较不活泼的一极为正(与电解质反应得失电子)2)根据两极发生的反应:发生氧化反应的一极为负,还原反应的一极为正
3)根据电极增重还是减重:溶解或减轻的一极为负,增加或放出气泡的一极为正
4)根据电子或电流流动方向:电流方向:正→负 电子流向:负→正
5)根据溶液中离子运动方向:阴离子移向的一极为负,阳离子移向的一极为正
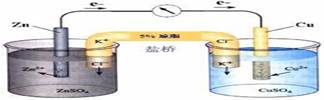
3.正确书写原电池电极反应式
(1)列出正负电电极上的反应物质,在等式的两边分别写出反应物和生成物(2)在反应式左边写出得失电子数,使得失电子 数目相等 。(得失电子守恒)
(3)使质量守恒。电极反应式书写时注意:负极反应生成物的阳离子与电解质溶液中的阴离子是否共存。若不共存,则该电解质溶液中的阴离子应该写入负极反应式;若正极上的反应物质是O2则得电子生成O2-,而其极不稳定在中性或碱性的电解质溶液中结合H2O生成OH-,若电解液为酸性,则结合H+生成H2O。电极反应式的书写必须遵循离子方程式的书写要求。
(4)正负极反应式相加得到 总反应式 。若能写出总反应式,可以减去较易写出的电极反应式,从而写出较难书写的电极方程式
4.电解池的阴阳极判断:
⑴由外电源决定:阳极:连电源的正极; 阴极:连电源的负极;
⑵根据电极反应: 氧化反应→阳极 ;还原反应→阴极
⑶根据阴阳离子移动方向:阴离子移向→阳极;阳离子移向→阴极,
⑷根据电子几点流方向:电子流向: 电源负极→阴极;阳极→电源正极
电流方向: 电源正极→阳极;阴极→电源负极
5.电解时电极产物判断:
⑴阳极:如果电极为活泼电极,则电极失电子,被氧化被溶解,例如Zn-2e-=Zn2+
如果电极为惰性电极,C、Pt、Au、Ag、Ti等,则溶液中阴离子失电子,例如4OH-- 4e-= 2H2O+ O2 阴离子放电顺序S2->I->Br->Cl->OH->含氧酸根>F-
⑵阴极:(.阴极材料(金属或石墨)总是受到保护)根据电解质中阳离子活动顺序判断,阳离子得电子顺序 — 金属活动顺序表的反表金属活泼性越强,则对应阳离子的放电能力越弱,既得电子能力越弱。 离子得电子顺序:K+ <Ca2+ < Na+ < Mg2+ < Al3+< (H+) < Zn2+ < Fe2+ < Sn2+ < Pb2+ < Cu2+ < Hg2+ < Ag+
6.电解原理的应用
A、电解饱和食盐水(氯碱工业)
⑴反应原理 阳极: 2Cl- - 2e-== Cl2↑
阴极: 2H+ + 2e-== H2↑
总反应:2NaCl+2H2O电解====H2↑+Cl2↑+2NaOH
B、电解冶炼铝(电解熔融氧化铝)
⑵ 原理
 阳极 2O2- - 4e- =O2↑
阳极 2O2- - 4e- =O2↑
阴极 Al3++3e- =Al 总反应:4Al3++6O2ˉ电解====4Al+3O2↑
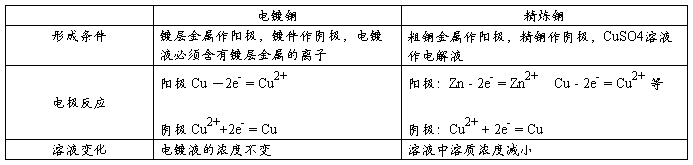
C、电镀:用电解的方法在金属表面镀上一层金属或合金的过程。
⑴镀层金属作阳极,镀件作阴极,电镀液必须含有镀层金属的离子。电镀铜原理:
 阳极 镀层金属 Cu-2eˉ = Cu2+
阳极 镀层金属 Cu-2eˉ = Cu2+
阴极 被镀件表面 Cu 2++2eˉ= Cu
E、电解精炼铜:粗铜作阳极,精铜作阴极,电解液含有Cu2+。铜前金属先反应但不析出,铜后金属不反应,形成 “阳极泥”。
7、电镀铜、精炼铜比较
8、电解方程式的实例(用惰性电极电解):
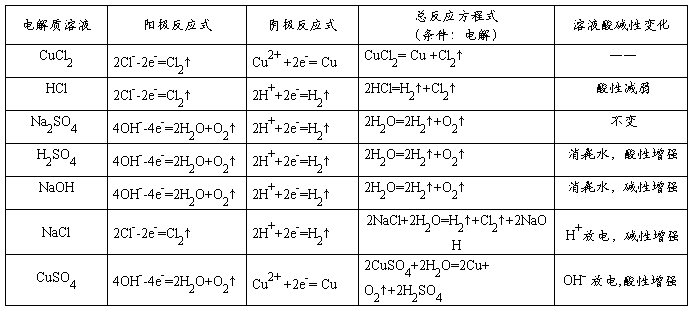
9、化学腐蚀和电化腐蚀的区别

10.吸氧腐蚀和析氢腐蚀的区别

金属腐蚀速度:电解池阳极>原电池负极>普通化学腐蚀>原电池正极>电解池阴极
(3)燃料电池
①氢氧燃料电池 当用碱性电解质时,电极反应为:
负极:2H2+40H—-4e—=4H20;正极:02+2H20+4e—=40H— 总反应:2H2+02=2H2O
当用酸性电解质时,电极反应为:
负极:2H2-4e—=4H+;正极:02+4H++4e—=2H2O 总反应:2H2+02=2H2O
②甲烷燃料电池
该电池用金属铂片插入KOH溶液中作电极,在两极上分别通甲烷和氧气;
负极:CH4+10OH--8e-=CO32-+7H2O;正极:2O2+4H2O+8e-=8OH-
总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O
第二章 反应速率与化学平衡
一、化学反应速率
1.概念:用单位时间内反应物浓度的减少或生成物浓度的增大来表示化学反应速率
计算公式: 单位:mol·L-1·s-1
2.应用中应注意的问题
①反应速率是平均反应速率,不是瞬时速率
②对同一化学反应来说,用不同物质表示化学反应速率时所得数值往往不同,在比较速率大小时一定要转化到同一物质来比较
③、无论用任何物质来表示,无论浓度的变化是增加还是减少,都取正值,反应速率都为正数(没有负数)。
④、固体或纯液体的浓度是恒定不变的,一般不用纯液体或固体来表示化学反应速率
⑤、物质表示的化学反应速率数值之比等于化学方程式中各物质的系数之比
二,影响化学反应速率的因素
㈠、内因:物质本身的结构和性质是化学反应速率大小的决定因素,反应类型不同有不同的化学反应速率,反应类型相同但反应物不同,化学反应速率也不同。
㈡、外界条件对化学反应速率的影响
1、浓度对化学反应速率的影响。 结论:其他条件不变时,增大反应物的浓度,可以增大反应速率;减小反应物的浓度,可以减小化学反应的速率。
注意:a、此规律只适用于气体或溶液的反应,对于纯固体或液体的反应物,一般情况下其浓度是常数,因此改变它们的量不会改变化学反应速率。
2、压强对反应速率的影响。
结论:对于有气体参加的反应,若其他条件不变,增大压强,反应速率加快;减小压强,反应速率减慢。
3、温度对化学反应速率的影响。
结论:其他条件不变,升高温度,可以增大反应速率,降低温度,可以减慢反应速率。
原因:(1)浓度一定时,升高温度,分子的能量增加,从而增加了活化分子的数量,反应速率增大。
(2)温度升高,使分子运动的速度加快,单位时间内反应物分子间的碰撞次数增加,反应速率也会相应的加快。前者是主要原因。
4、催化剂对化学反应速率的影响。
结论:催化剂可以改变化学反应的速率。正催化剂:能够加快反应速率的催化剂。负催化剂:能够减慢反应速率的催化剂。 如不特意说明,指正催化剂。
原因:在其他条件不变时,使用催化剂可以大大降低反应所需要的能量,会使更多的反应物分子成为活化分子,大大增加活化分子百分数,因而使反应速率加快。
5、其他因素:如光照、反应物固体的颗粒大小、电磁波、超声波、溶剂的性质等,也会对化学反应的速率产生影响
6、有效碰撞:能够发生化学反应的碰撞。
活化分子:能量较高、有可能发生有效碰撞的分子。 化能:活化分子的平均能量与所有分子平均能量之差。 分子百分数: (活化分子数/反应物分子数)×100%
二.可逆反应
(1)可逆反应:在相同条件下,能同时向正、逆反应方向进行的反应。
不可逆反应:在一定条件下,进行得很彻底或可逆程度很小的反应。
(2)可逆反应的普遍性:大部分化学反应都是可逆反应。
(3)可逆反应的特点:
①相同条件下,正反应和逆反应同时发生②反应物、生成物共同存在
③可逆反应有一定的限度(反应不能进行到底)
三、化学平衡
1.定义:指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态
2化学平衡状态的标志
(1)υ正 = υ逆 (本质特征)
① 同一种物质:该物质的生成速率等于它的消耗速率。
② 不同的物质:速率之比等于方程式中各物质的计量数之比,但必须是不同方向的速率。
(2)反应混合物中各组成成分的含量保持不变(外部表现):
① 各组成成分的质量、物质的量、分子数、体积(气体)物质的量浓度均保持不变。
② 各组成成分的质量分数、物质的量分数、气体的体积分数均保持不变。
③ 若反应前后的物质都是气体,且总体积不等,则气体的总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)均保持不变。
④ 反应物的转化率、产物的产率保持不变。
3化学平衡常数
(1)定义:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度系数之幂的积与反应物浓度系数之幂的积比值是一个常数,这个常数就是该反应的化学平衡常数。用 K 表示。
(2) 表达式: aA(g)+bB(g) = cC(g)+ dD(g) K=
[注意] (1)K 的意义: K 值越大,说明达到平衡时反应物的转化率也越大。因此,平衡常数的大小能够衡量一个化学反应进行的程度。
(2)一定温度时,同一反应,其化学方程式书写方式、配平计量数不同,平衡常数表达式不同。
(3)在平衡常数的表达式中,物质的浓度必须是平衡浓度(固体、纯液体不表达)。在稀溶液中进行的反应,水的浓度可以看成常数,不表达在平衡常数表达式中,但非水溶液中的反应,如果反应物或生成物中有水,此时水的浓度不能看成常数。
(4)K只与温度有关,与反应物或生成物浓度变化无关,与平衡建立的途径也无关,在使用时应标明温度。温度一定时, K 值为定值。
4、平衡转化率
(1) 表达式: 物质在反应中已转化的量/该物质总量 产品的转化率研究对象是反应物
化学平衡的移动
一、化学平衡的移动
(1)定义:可逆反应中旧化学平衡的破坏,新化学平衡的建立过程
(2)移动的原因:外界条件发生变化。
移动的方向:由v正和v逆的相对大小决定。
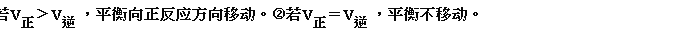

(3)平衡移动的标志: 各组分浓度与原平衡比较发生改变。
二、影响化学平衡的条件
(1)增大反应物或减小生成物的浓度化学平衡向正反应方向移动
减小反应物或增大生成物的浓度化学平衡向逆反应方向移动
(2) A:温度升高,会使化学平衡向着吸热反应的方向移动;
B:温度降低,会使化学平衡向着放热反应的方向移动。
(3) A:增大压强,会使化学平衡向着气体体积缩小的方向移动;
B:减小压强,会使化学平衡向着气体体积增大的方向移动。
[注意]①对于反应前后气体总体积相等的反应,改变压强不能使化学平衡移动;
②对于只有固体或液体参加的反应, 改变压强不能使化学平衡移动;
(4)催化剂只能使正逆反应速率等倍增大,不能使化学平衡移动。
三、勒夏特列原理∶
如果改变影响平衡的条件之一(如温度,压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。
第三章 水溶液中的离子平衡
电解质:在水溶液或熔融状态下能导电的化合物
非电解质:在水溶液或熔融状态下不能导电的化合物
强电解质:在水溶液中全部电离的电解质 包括:强酸 强碱 和大部分盐
弱电解质:在水溶液中部分电离的电解质 包括:水 弱酸H3PO4 HF、甲酸 、醋酸、 H2CO3 、 H2S 、 HClO、 H2SiO3 HCN 弱碱Fe(OH)3Cu(OH)2等不溶性碱NH3.H2O
一、电解质与非电解质判断注意点
1、电解质与非电解质都是化合物,所以单质和混合物既不是电解质也不是非电解质
2、电解质的本质要求是自身能电离出离子,有些物质溶于水时所得溶液能导电,但这些物质自身不电离而是生成了一些电解质,则这些物质不属于电解质,如 CO2 SO3
二、电离方程式的书写原则
1、强电解质:完全电离符号用=
2、弱电解质:部分电离符号可逆符号
①、多元弱酸的电离:分步书写 例:H2S的电离H2S H+ + HS- ; HS- H+ + S2-
注意:第一步为主,第二步一般相当微弱。
②、多元弱碱的电离:一步书写 例:Al3+ + 3H2O Al(OH)3 + 3H+
三、几类化学平衡