20xx版GMP原料药供应商审计报告
供应商质量体系评估报告

第二篇:制药厂GMP供应商审计培训课件
供应商审计方面的培训课件
一、药品包装材料相关知识:
分类:
Ⅰ类药包材指直接接触药品且直接使用的药品包装用材料、容器。
Ⅱ类药包材指直接接触药品,但便于清洗,在实际使用过程中,经清洗后需要并可以消毒灭菌的药品包装用材料、容器。
Ⅲ类药包材指Ⅰ、Ⅱ类以外其它可能直接影响药品质量的药品包装用材料、容器。
注册年限:《药包材注册证书》有效期为五年,期满前六个月按规定申请换发。
批准部门:生产Ⅰ类药包材,须经国家药品监督管理局批准注册,并发给《药包材注册证书》。生产Ⅱ、Ⅲ类药包材,须经所在省、自治区、直辖市药品监督管理部门批准注册,并发给《药包材注册证书》。
注册证号编制方法:药包材注册按产品核、换发《药包材注册证》,一个产品为一张证书,同一品种不同规格的产品符合注册条件的为同一证。《药包材注册证》统一编号格式,Ⅰ类产品编号为:国药包字XXXXXXXX, Ⅱ、 Ⅲ产品编号为:X(省、自治区和直辖市的简称)药包字XXXXXXXX;《进口药包材注册证》编号为JXXXXXXXX(J为进口的代号,前四位数字为公元年号,后四位数字年内顺序号)。
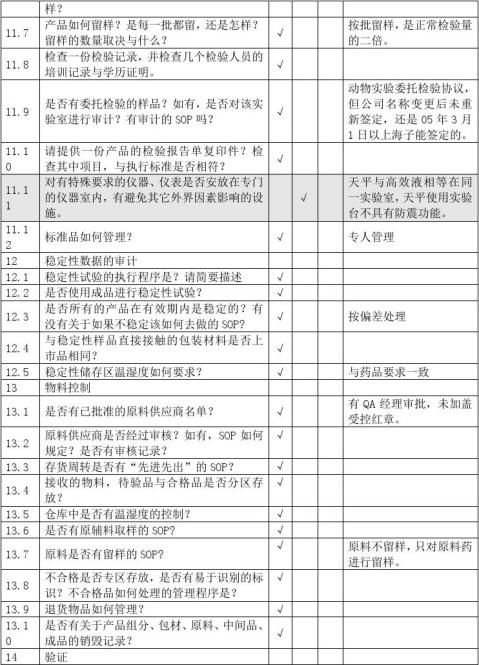
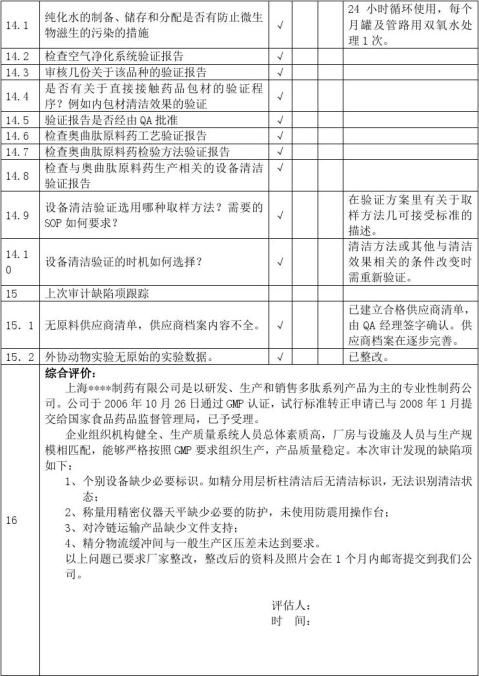
以上内容,物料管理部在购货、审计前应仔细核对。例如:(所有资料均加盖供应商红色公章)


以下为外包材,要求分两类:
1、带文字内容的纸质材料:
①瓶签、纸盒、说明书,则至少要提供营业执照、生产/印刷许可证、条形码印刷资格证、包材质量标准、质量管理体系组织机构图以及主要负责人、主要生产设备和检测仪器、主要负责人的基本情况、厂家的联系方式、产品质量回馈、退回等处理办法(可提供合同,在内体现);随货提供本批产品的检验报告书和送货单、合同、#5@p之类的真实交易凭证。最后是供应商审计表。如有可能,提供各种信誉证明(如证书、称号)
②泡沫、合格证、封口证、纸箱、红背心袋等,则要求稍低,但印有本公司的相关信息,也应注意,至少要提供营业执照、生产/印刷许可证、包材质量标准、厂家的联系方式、产品质量回馈、退回等处理办法(可在合同内体现);随货提供本批产品的送货单、合同、#5@p之类的真实交易凭证。最后是供应商审计表。如有可能,提供检验报告书。
2、不带文字内容,或文字内容无关要紧的包材:吸塑垫、纸卡、收缩膜、包装带、封箱胶带等,至少要提供营业执照、生产许可证;随货提供本批产品的送货单、合同、#5@p之类的真实交易凭证。可不做供应商审计,但需提供资料,方便进行质量追踪,如有可能,提供质量标准和检验报告书。
二、药用辅料的基础知识:
生产、进口和使用的药用辅料,必须符合国家药用辅料标准,依据标准生产药用辅料的厂家具有《药用辅料注册证》。新的药用辅料、进口药用辅料由国家食品药品监督管理局批准注册。已有国家标准的药用辅料(除按标准管理的药用辅料外)由省、自治区、直辖市(食品)药品监督管理部门批准注册。色素、添加剂、香精和试剂类药用辅料
实行标准管理。
药用辅料批准证明文件,是指《新的用辅料注册证》、《进口药用辅料注册证》、《新的药用辅料证书》、《药用辅料补充申请批件》及《国家药用辅料标准颁布件》等相关文件。
药品批准文号格式:国药准字+1位字母+8位数字。化学药品使用字母“H”,中药使用字母“Z”,通过国家药品监督管理局整顿的保健药品使用字母“B”,生物制品使用字母“S”,体外化学诊断试剂使用字母“T”,药用辅料使用字母“F”,进口分包装药品使用字母“J”。 数字第1、2位为原批准文号的来源代码,其中“10”代表原卫生部批准的药品,“19”、“20”代表20xx年1月1日以前国家药品监督管理局批准的药品,其它使用各省行政区划代码前两位的,为原各省级卫生行政部门批准的药品。第3、4位为换发批准文号之年公元年号的后两位数字,但来源于卫生部和国家药品监督管理局的批准文号仍使用原文号年号的后两位数字。数字第5至8位为顺序号。
药品批准文号采用的中华人民共和国行政区划代码


例如:(所有资料均加盖供应商红色公章)
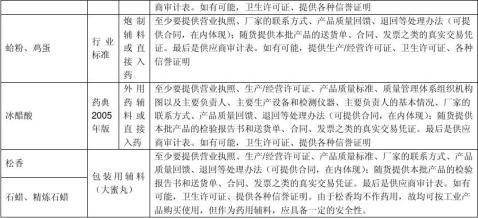
随货提供本批产品的检验报告书和送货单、合同、#5@p之类的真实交易凭证。最后是供应商审计表。如有可能,卫生许可证、提供各种信誉证明。
其他物料(如化验室试剂、消毒剂、洁净区使用的工具和衣服等)的供应商,也应该提供供应商的基本资料:营业执照、生产/经营许可证、货物的基本资料(查看是否有瓶签等);随货送货单、合同、#5@p之类的真实交易凭证。
三、药品的基础知识:
GMP要求:药品生产所用的中药材,应按质量标准购入,其产地应保持相对稳定。
中药材必须满足20xx年版药典要求,如无药典标准的,参照当地的药品标准或饮片标准。
中药材验收的基本内容及方法:①检查核对来货的品名、规格、产地、数量。检查包装的完整性,清洁程度,观察有无水迹、霉变或其它物质污染等异常情况;②取样:药材取样的数量,药材总包数100件以下取5件;100-1000件取5%;超过1000件,不足5件,逐件取样,一般来讲,体积大的中药材取样量多,体积小的中药材取样量小,贵细药材酌情取样,毒剧药材参照贵细药材的取样方法。药材取样应按2005版药典一部附录II药材取样法规定的要求执行;③注意事项:药材取样后,首先应当鉴别药材的真伪,观察药材的水分是否正常,药材是否有霉变、走油、虫蛀、变色等异常情况,贵细药材应逐件打开检查;市场紧俏的药材也要注意加强检查,观察时否有掺杂使假的现象。 龟甲胶、鹿角胶、冰片、人工牛黄等属于药品,并执行药典标准;广东神曲,执行部颁标准,均有“国药准字”标示。另外,既然属于药品,要注意有效期、OTC标识、包装状态(是否双层密封包装)
中药饮片必须从具有中药炮制资格的饮片厂购进,特别是毒性药材,注意检查“中药饮片GMP证书”的认证范围。 药品经营单位必须通过“药品经营质量管理规范”(GSP)认证,注意检查GSP证书的认证范围。
药品、药材需提供的资料(所有资料均加盖供应商红色公章)有:营业执照、药品生产/经营许可证、GSP证书、质量管理体系组织机构图以及主要负责人,主要生产设备和检测仪器,主要负责人的基本情况、厂家的联系方式、产品质量回馈、退回等处理办法(可提供合同,在内体现)、销售员应有单位授权销售委托书。
注:药材供应商应尽量选择较大的医药公司,如有特殊原因需要在某些小药商、药铺、当地药农处购买,则提供下列资料:主要负责人的身份证复印件、联系方式、购销合同、#5@p或收据等证明性材料。
供应商提供的审计资料以身份证明和质量控制为原则,即供应商是合法单位、守法企业;有能力保证生产或销售的产品、商品是合格、合法的!
质量管理部制定
-
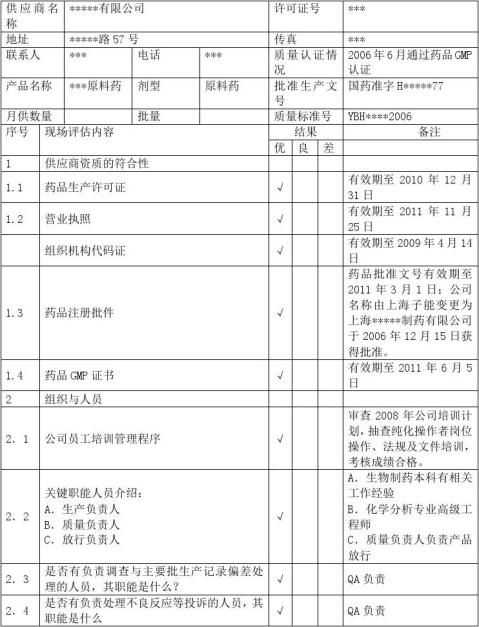
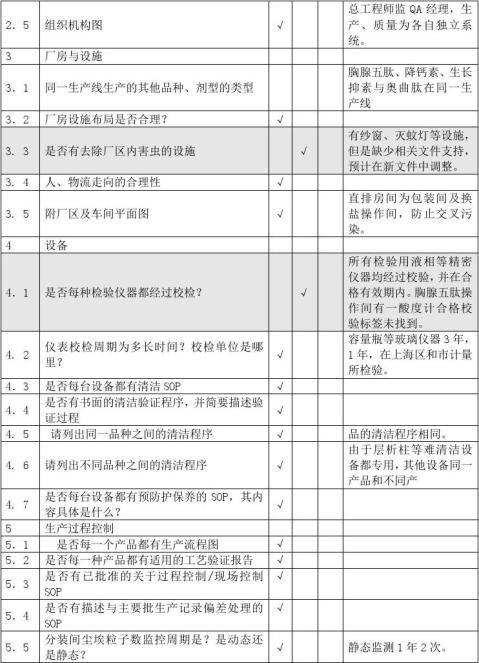
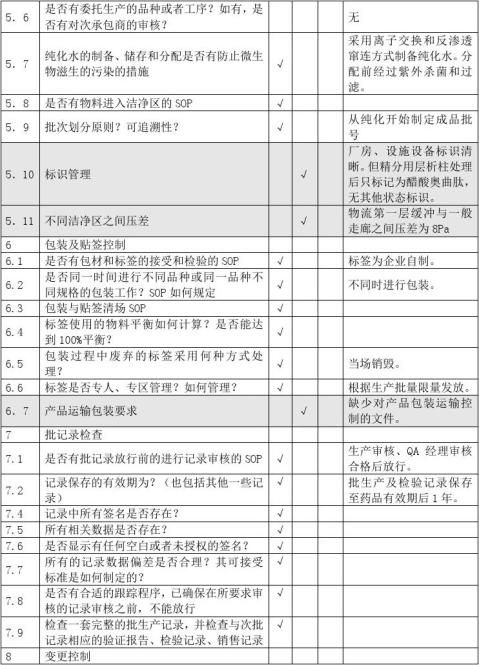
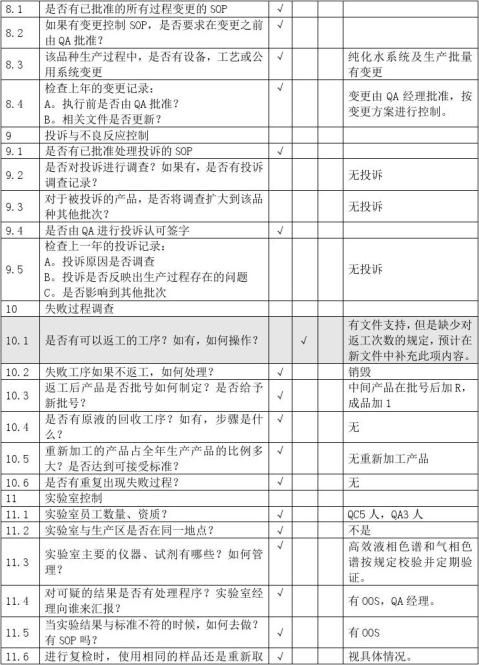
供应商审计报告
A类原料审计内容营业执照生产许可证GMP证书GSP证书原料药生产批件质量标准经营授权书业务员资料进口物料的进口批件样品检验报告书包…
-
供应商审核报告(新)
深圳市飞马国际供应链股份有限公司供应商考察报告一供应商基本资料深圳市飞马国际供应链股份有限公司供应商资料审核报告日期NO深圳市飞马…
-
供应商评价报告
供应商评价报告供应商名称:供应商地址:审核结论:A级(90分)□B级(75分)□C级(60分)□D级(<60分)□审核覆盖产品:是…
-
物料供应商质量审计及报告表
物料供应商质量审计及报告表关键物料供应商现场审计记录关于确定物料定点供应商的通知各职能部门质检处和供应处等有关部门对生产车间所用物…
-
供应商审核报告
供应商质量体系及产品质量审核报告被审核方公司审核员陈水治付春水张冬菜审核方厦门三圈电池有限公司审核日期20xx126审核结果综述厦…
-
_供应商稽核报告
深圳市诚誉兴光电有限公司供应商稽核报告稽核判定本次供应商稽核是以ISO条文为基础分物流体系管理产品和过程设计开发控制质量管理体系要…
-
供应商审核报告(新)
深圳市飞马国际供应链股份有限公司供应商考察报告一供应商基本资料深圳市飞马国际供应链股份有限公司供应商资料审核报告日期NO深圳市飞马…
-
供应商现场审核报告
VENDOR39SPLANTVISITREPORT供应商现场审核报告VENDOR39SPLANTVISITREPORT供应商现场审…
-
供应商审核报告
供应商质量体系及产品质量审核报告被审核方公司审核员陈水治付春水张冬菜审核方厦门三圈电池有限公司审核日期20xx126审核结果综述厦…
-
供应商审查报告
xxxxxx玩具有限公司供应商审核报告SupplierAuditReport档案编号SAR20xx初审重审供应商概况公司名称电话生…
-
供应商评价报告
供应商评价报告供应商名称:供应商地址:审核结论:A级(90分)□B级(75分)□C级(60分)□D级(<60分)□审核覆盖产品:是…