高中化学物质的状态和颜色·常见物质颜色、俗名、用途总汇
推断题用
高中化学物质的状态和颜色
一、固液气
1 、黑色固体:石墨、炭粉、铁粉、FeS、CuS、CuO、MnO2、Fe3O4
2 、红色固体:Cu、Cu2O、Fe2O3 、HgO、红磷 3 、淡黄色固体 :S、 Na2O2、 AgBr
4 、紫黑色固体:KMnO4、 5 、黄色固体: AgI 、Ag3PO4 6 、绿色固体: Cu2(OH)2CO3 7 、蓝色晶体:CuSO4·5H2O 8 、蓝色沉淀 Cu(OH)2 9 、红褐色沉淀: Fe(OH)3 10、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、
无水CuSO4;铁、镁为银白色(汞为银白色液态)
11、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;
凡含Fe3+的溶液呈棕黄色,MnO4-溶液为紫红色,其余溶液一般无色。
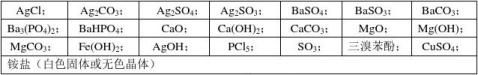
12、不溶于酸的白色沉淀: BaSO4 、AgCl
13、不溶于水的白色沉淀 CaCO3 (溶于酸)、BaCO3(溶于酸)、Al(OH)3、 Mg(OH)2 等 14、(1) 具有刺激性气体的气体:NH3、SO2、HCl(皆为无色 (2) 无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒) (3) 红棕色气体: Br2(气体)、 NO2 (4) 黄绿色气体: Cl2 (5) 臭鸡蛋气味气体:H2S
15、具有刺激性气味的液体:盐酸、硝酸、醋酸、酒精 16、有毒的:
(1)气体:CO SO2 H2S (2)液体:CH3OH
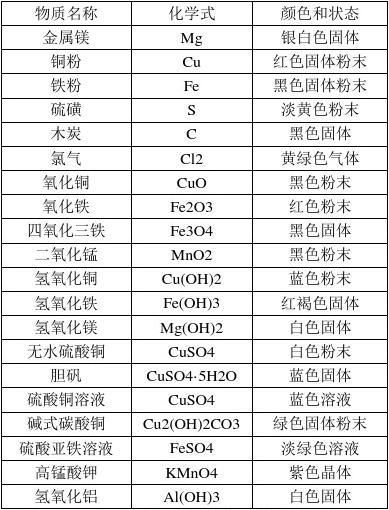
(3)固体:NaNO2 CuSO4(可作杀菌剂 ,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液) 中学常见物质颜色归纳
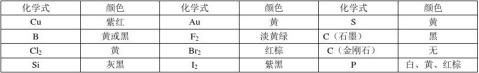
四、氧化物的水化物
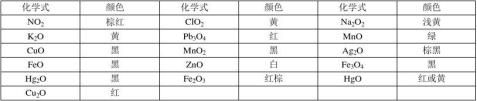


1



一、各种颜色的总结
1、黄色:AgI、Ag3PO4、P4(黄磷)、溴水(黄--橙)、FeS2、Al2S3、甲基橙在弱酸性、中性或碱
性环境中、某些蛋白质加硝酸。
2、淡黄色:S、Na2O2、TNT、PCl5、AgBr、浓HNO3(混有NO2)、浓HCl(混有Fe3+)、硝基
苯(溶有NO2)。
3、灰黄色:Mg3N2
4、棕黄色:FeCL3溶液、碘水(深黄--褐)
5、黑色:CuS、Ag2S、Cu2S、PbS、HgS(黑色或红色)、FeS、FeO、Fe3O4、MnO2、CuO、
Ag2O、I2(紫黑)、Si(灰黑)、C、Ag、KMnO4(紫黑)、石油
6、绿色:CuCl2溶液、Cu2(OH)2CO3、FeSO4/7H2O(浅绿)、F2(浅黄绿)、Cl2(黄绿)、
氯水(浅黄绿)
7、红色:CuO、Cu、Fe(SCN)2+、甲基橙在酸性环境中、紫色石蕊试液在酸性环境中、酚酞在碱
性环境中、品红试液、红磷(暗红)、Br2(深红棕)、Br2在CCl4溶液中(紫红)、苯酚 被空气氧化(粉红)
8、棕色:固体FeCl3、固体CuCl2、NO2(红棕)、Fe2O3(红棕) 9、紫色:KMnO4溶液、I2在CCl4溶液中 10、灰色:As、Sn、Fe3C
11、褐色:碘酒、2Fe2O3/3H2O、Fe(OH)3(红褐)
12、蓝色:CuSO4/5H2O、Cu(OH)2、淀粉遇碘、紫色石蕊试液在碱性环境中,Cu2+的稀溶液 二、有色反应
1、产生的沉淀有颜色
(1)红褐色絮状沉淀:Fe(OH)3 (2)浅绿色沉淀:Fe(OH)2 (3)蓝色絮状沉淀:Cu(OH)2
(4)白色沉淀:CaCO3,BaCO3,AgCl,BaSO4,(其中BaSO4、AgCl是不溶于HNO3的白色沉淀,
2
CaCO3,BaCO3是溶于HNO3的白色沉淀),Mg(OH)2.
(5)淡黄色沉淀(水溶液中)----S
(6)微溶于水------------Ca(OH)2,CaSO4,
2、生成的溶液或气体有颜色
(1)水溶液中含有Fe3+的为黄色. 如:Fe2(SO4)3、FeCl3 、Fe(NO3)3溶液
(2)水溶液中含有Cu2+为蓝色,如:CuCl2、 Cu(NO3)2、 CuSO4溶液;但是,
CuSO4·5H2O是蓝色,无水CuSO4是白色
(3)棕色液体:Br2
(4)红棕色的气体:NO2;
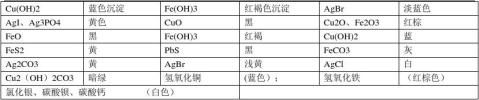
①沾上铜离子,就记住蓝绿色(铜溶液)铜的沉淀也是蓝色
②沾上亚铁离子,就记住钱绿色(亚铁溶液)氢氧化亚铁是白色
③沾上铁离子,就记住黄褐色(铁溶液)三价铁沉淀也是红棕色的
④二价铁沉淀暴露在空气中会被氧化成三价铁沉淀(例如氢氧化亚铁在空气中会被氧化成氢氧化铁,颜色有浅绿色变成灰色在变成棕黄色)
⑤黑色固体有二氧化锰,铁粉,高锰酸钾(紫黑色),四氧化三铁
⑥红色固体有氧化铁(铁锈)
⑦红褐色固体有三价铁离子沉淀
⑧淡黄色固体有硫单质(还有过氧化钠,不记得是初中还是高中学的了)
⑨蓝色固体一般就是沾着铜的,例如孔雀石,碱式碳酸铜等
⑩Cu2+蓝色(稀)绿色(浓) FE3+黄色 FE2+浅绿 MNO4-紫色,紫红色
沉淀的颜色
(一)
Mg(OH)2 ,Al(OH)3 ,AgCl,BaSO4,BaCO3,BaSO3,CaSO4等均为白色沉淀
3
2Hg+O2点燃或Δ=2HgO 银白液体、生成红色固体 拉瓦锡实验 2Cu+O2点燃或Δ=2CuO 红色金属变为黑色固体 4Al+3O2点燃或Δ=2Al2O3 银白金属变为白色固体
3Fe+2O2点燃 =Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe + 3O2高温2Fe2O3 C+O2 点燃=CO2 剧烈燃烧、白光、放热、使石灰水变浑浊
S+O2 点燃=SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰 2H2+O2 点燃=2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水) 高能燃料 4P+5O2 点燃=2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体 证明空气中氧气含量
CH4+2O2点燃=2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水) 甲烷和天然气的燃烧
2C2H2+5O2点燃=2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水
CuSO4变蓝的液体(水) 氧炔焰、焊接切割金属
2KClO3MnO2 Δ=2KCl +3O2↑ 生成使带火星的木条复燃的气体 实验室制备氧气
2KMnO4Δ = K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体 实验室制备氧气 2HgOΔ=2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体 拉瓦锡实验 2H2O通电=2H2↑+O2↑ 水通电分解为氢气和氧气 电解水
Cu2(OH)2CO3Δ=2CuO+H2O+CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体 铜绿加热
NH4HCO3Δ=NH3↑+ H2O +CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体 碳酸氢铵长期暴露空气中会消失 Zn+H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解 实验室制备氢气 Fe+H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解 Mg+H2SO4 =MgSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解 2Al+3H2SO4=Al2(SO4)3+3H2↑ 有大量气泡产生、金属颗粒逐渐溶解
Fe2O3+3H2 Δ= 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体 冶炼金属、利用氢气的还原性 Fe3O4+4H2 Δ=3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体 冶炼金属、利用氢气的还原性 WO3+3H2Δ= W +3H2O 冶炼金属钨、利用氢气的还原性 MoO3+3H2 Δ=Mo +3H2O 冶炼金属钼、利用氢气的还原性
2Na+Cl2Δ或点燃==2NaCl 剧烈燃烧、黄色火焰 离子化合物的形成、
H2+Cl2 点燃或光照== 2HCl 点燃苍白色火焰、瓶口白雾 共价化合物的形成、制备盐酸 CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液 质量守恒定律实验 2C +O2点燃==2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因 2C O+O2点燃==2CO2 蓝色火焰 煤气燃烧
C + CuO 高温==2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体 冶炼金属 2Fe2O3+3C 高温==4Fe+ 3CO2↑ 冶炼金属 Fe3O4+2C高温==3Fe + 2CO2↑ 冶炼金属 C + CO2 高温==2CO
CO2 + H2O == H2CO3 碳酸使石蕊变红 证明碳酸的酸性 H2CO3 Δ==CO2↑+ H2O 石蕊红色褪去
Ca(OH)2+CO2= =CaCO3↓+ H2O 澄清石灰水变浑浊 应用CO2检验和石灰浆粉刷墙壁
4
CaCO3+H2O+CO2 = =Ca(HCO3)2 白色沉淀逐渐溶解 溶洞的形成,石头的风化
Ca(HCO3)2Δ== CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体 水垢形成.钟乳石的形成 2NaHCO3Δ==Na2CO3+H2O+CO2↑ 产生使澄清石灰水变浑浊的气体 小苏打蒸馒头
CaCO3 高温==CaO+ CO2↑ 工业制备二氧化碳和生石灰
CaCO3+2HCl==CaCl2+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 实验室制备二氧化碳、除水垢 Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 泡沫灭火器原理
Na2CO3+2HCl=2NaCl+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 泡沫灭火器原理
MgCO3+2HCl=MgCl2+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体
CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体 冶炼金属
Fe2O3+3CO高温== 2Fe+3CO2 冶炼金属原理
Fe3O4+4CO高温==3Fe+4CO2 冶炼金属原理
WO3+3CO高温==W+3CO2 冶炼金属原理
CH3COOH+NaOH=CH3COONa+H2O
2CH3OH+3O2点燃==2CO2+4H2O
C2H5OH+3O2点燃==2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热 酒精的燃烧
Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质 湿法炼铜、镀铜
Mg+FeSO4= Fe+ MgSO4 溶液由浅绿色变为无色 Cu+Hg(NO3)2=Hg+ Cu (NO3)2
Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质 镀银
Zn+CuSO4= Cu+ZnSO4 青白色金属表面覆盖一层红色物质 镀铜
Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色 铁器除锈
Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解
Na2O+2HCl=2NaCl+H2O 白色固体溶解
CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色
ZnO+2HCl=ZnCl2+ H2O 白色固体溶解
MgO+2HCl=MgCl2+ H2O 白色固体溶解
CaO+2HCl=CaCl2+ H2O 白色固体溶解
NaOH+HCl=NaCl+ H2O 白色固体溶解
Cu(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解
Mg(OH)2+2HCl=MgCl2+2H2O 白色固体溶解
Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解 胃舒平治疗胃酸过多
Fe(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色
Ca(OH)2+2HCl=CaCl2+2H2O
HCl+AgNO3= AgCl↓+HNO3 生成白色沉淀、不溶解于稀硝酸 检验Cl—的原理
Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色 铁器除锈
Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解
CuO+H2SO4=CuSO4+H2O 黑色固体溶解、溶液呈蓝色
ZnO+H2SO4=ZnSO4+H2O 白色固体溶解
MgO+H2SO4=MgSO4+H2O 白色固体溶解
2NaOH+H2SO4=Na2SO4+2H2O
Cu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解
Ca(OH)2+H2SO4=CaSO4+2H2O
Mg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解
2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解
2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解、溶液呈黄色
Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸 检验SO42—的原理
BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸 检验SO42—的原理
5
Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 生成白色沉淀、不溶解于稀硝酸 检验SO42—的原理
Na2O+2HNO3=2NaNO3+H2O 白色固体溶解
CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解、溶液呈蓝色
ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解
MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解
CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解
NaOH+HNO3=NaNO3+ H2O
Cu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解
Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解
Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解
Ca(OH)2+2HNO3=Ca(NO3)2+2H2O
Fe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解、溶液呈黄色
3NaOH + H3PO4=3H2O + Na3PO4
3NH3+H3PO4=(NH4)3PO4
2NaOH+CO2=Na2CO3+ H2O 吸收CO、O2、H2中的CO2、
2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)
FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成
AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成
MgCl2+2NaOH = Mg(OH)2↓+2NaCl
CuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成
CaO+ H2O = Ca(OH)2 白色块状固体变为粉末、 生石灰制备石灰浆
Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成 初中一般不用
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成 工业制烧碱、实验室制少量烧碱
Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成
Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成
CuSO4+5H2O= CuSO4?H2O 蓝色晶体变为白色粉末
CuSO4?H2OΔ== CuSO4+5H2O 白色粉末变为蓝色 检验物质中是否含有水
AgNO3+NaCl = AgCl↓+Na NO3 白色不溶解于稀硝酸的沉淀(其他氯化物类似反应) 应用于检验溶液中的氯离子BaCl2 + Na2SO4 = BaSO4↓+2NaCl 白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应) 应用于检验硫酸根离子 CaCl2+Na2CO3= CaCO3↓+2NaCl 有白色沉淀生成
MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓ 有白色沉淀生成
CaCO3+2HCl=CaCl2+H2O+CO2 ↑
MgCO3+2HCl= MgCl2+H2O+ CO2 ↑
NH4NO3+NaOH=NaNO3+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体 应用于检验溶液中的铵根离子 NH4Cl+ KOH= KCl+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气
高中化学物质颜色、俗名、用途总汇
-、丰富多彩的颜色
1.红色:
Fe(SCN)3(红色溶液) Cu2O(红色固体) Fe2O3(红棕色固体)
红磷(暗红色固体) 液溴(深红棕色) Fe(OH)3(红褐色固体)
Cu(紫红色固体) 溴蒸气、NO2(红棕色) 品红溶液(红色)
在空气中久置的苯酚(粉红) 石蕊遇酸性溶液(红色) 酚酞遇碱性溶液(红色)
2.紫色:
石蕊在中性溶液中(紫色) Fe3+与苯酚反应产物(紫色) I2(有金属光泽紫黑色固体)
KMnO4固体(紫黑色) MnO4—(紫红色溶液) 钾的焰色反应(紫色)
I2蒸气、I2在非极性溶剂中(紫色)
6
3.橙色:溴水(橙色) K2Cr2O7溶液(橙色)
4.黄色:
AgI(黄色固体) AgBr(淡黄色固体) Ag3PO4(黄色固体) FeS2(黄色固体)
Na2O2(淡黄色固体) S(黄色固体) Au(金属光泽黄色固体)
I2的水溶液(黄色) 碘酒(黄褐色) 久置的KI溶液(黄色)(被氧化为I2)
Na的焰色反应(黄色) TNT(淡黄色针状) 工业浓盐酸(黄色)(含有Fe3+)
NaNO2(无色或浅黄色晶体) Fe3+的水溶液(黄色) 硝基苯中溶有浓硝酸分解的NO2时(黄色)
久置的浓硝酸(黄色)(溶有分解生成的NO2) 浓硝酸粘到皮肤上(天然蛋白质)(显黄色)
5.绿色:
Cu2(OH)2CO3(绿色固体) Fe2+的水溶液(浅绿色) FeSO4·7H2O(绿矾)
Cl2、氯水(黄绿色) F2(淡黄绿色) CuCl2的浓溶液(蓝绿色)
7.棕色:FeCl3固体(棕黄色) CuCl2固体(棕色)
6.蓝色:
Cu(OH)2、CuSO4·5H2O、Cu2+在水溶液中(蓝色) 石蕊遇碱性溶液(蓝色)
硫、氢气、甲烷、乙醇在空气中燃烧(淡蓝色火焰) 一氧化碳在空气中燃烧(蓝色火焰)
淀粉遇I2变蓝色 Cu(OH)2溶于多羟基化合物(如甘油、葡萄糖等)的水溶液中(绛蓝色)
7.黑色:
FeO; Fe3O4; FeS; CuO; CuS; Cu2S; MnO2; C粉;Ag2S;Ag2O;PbS;
AgCl、AgBr、AgI、AgNO3光照分解均变黑; 绝大多数金属在粉末状态时呈黑色或灰黑色。
Fe(OH)2沉淀在空气中的现象:白色→(迅速)灰绿色→(最终)红褐色
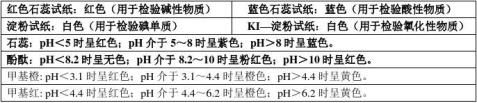
pH试纸:干燥时呈黄色;中性时呈淡绿色;酸性时呈红色,酸性越强,红色越深;碱性时呈蓝色,碱性越强,
蓝色越深。
二、重要物质的俗名
1.生石灰(主要成份是CaO); 消石灰、熟石灰[主要成份是Ca(OH)2];
水垢[主要成份是CaCO3和Mg(OH)2];
石灰石、大理石、白垩、蛋壳、贝壳、骨骼中的无机盐(主要成份是CaCO3);
波尔多液(石灰水与硫酸铜溶液的混合物); 石硫合剂(石灰水与硫粉的悬浊液)。
碱石灰[由NaOH、Ca(OH)2的混合液蒸干并灼烧而成,可以看成是NaOH和CaO的混合物];
2.烧碱、火碱、苛性钠(NaOH); 苛性钾(KOH)
3.苏打、纯碱、口碱(Na2CO3); 小苏打(NaHCO3); 大苏打、海波(Na2S2O3)
纯碱晶体(Na2CO3·10H2O); 泡花碱、水玻璃、矿物胶(Na2SiO3的水溶液)
4.芒硝(Na2SO4·10H2O) 重晶石(BaSO4)
石膏(CaSO4·2H2O) 熟石膏(2CaSO4·H2O)
5.胆矾、蓝矾(CuSO4·5H2O); 明矾[KAl(SO4)2·12H2O或K2 SO4·Al2(SO4)3·24H2O];
绿矾(FeSO4·7H2O) 皓矾(ZnSO4·7H2O)
7
6.菱镁矿(主要成份是MgCO3) 菱铁矿(主要成份是FeCO3)
磁铁矿(主要成份是Fe3O4) 赤铁矿、铁红(主要成份是Fe2O3)
黄铁矿、硫铁矿(主要成份是FeS2)
7.磷矿石[主要成份是Ca3(PO4)2] 重过磷酸钙、重钙 [主要成份是Ca(H2PO4)2]
过磷酸钙、普钙 [主要成份是Ca(H2PO4)2和CaSO4]
8.光卤石(KCl·MgCl2·6H2O)
9.铜绿、孔雀石[Cu2(OH)2CO3 ]
10.萤石(CaF2); 电石(CaC2); 冰晶石(Na3AlF6)
水晶(SiO2); 玛瑙(主要成份是SiO2); 石英(主要成份是SiO2);
硅藻土(无定形SiO2) 宝石、刚玉(Al2O3); 金刚砂(SiC)。
11.草酸HOOC—COOH 硬脂酸C17H35COOH 软脂酸C15H31COOH
油酸C17H33COOH 石炭酸C6H5OH 蚁酸HCOOH
蚁醛HCHO 福尔马林(HCHO的水溶液) 木精CH3OH
酒精CH3CH2OH 醋酸、冰醋酸CH3COOH 甘油(CH2OHCHOHCH2OH)
硝化甘油(三硝酸甘油酯)TNT(三硝基甲苯) 肥皂(有效成份是C17H35COONa)
火棉——纤维素与硝酸完全酯化反应、含氮量高的纤维素硝酸酯。用于制造无烟火药和枪弹的发射药。
胶棉——纤维素与硝酸不完全酯化反应、含氮量低的纤维素硝酸酯。用于制造赛璐珞和油漆。
粘胶纤维——由植物的秸秆、棉绒等富含纤维素的物质经过NaOH和CS2等处理后,得到的一种纤维状物质。其中长纤维俗称人造丝,短纤维俗称人造棉。
12.尿素CO(NH2)2 硫铵(NH4)2SO4 碳铵NH4HCO3
13.硫酐SO3 硝酐N2O5 碳酐、干冰、碳酸气CO2
14.王水(浓硝酸和浓盐酸按体积比...1 : 3的混合物)
三、重要物质的用途
1.干冰、AgI晶体——人工降雨剂 2.AgBr——照相感光剂
3.K、Na合金(l)——原子反应堆导热 4.铷、铯——光电效应
5.钠——很强的还原剂,制高压钠灯
6.NaHCO3、Al(OH)3——治疗胃酸过多,NaHCO3还是发酵粉的主要成分之一
7.Na2CO3——广泛用于玻璃、制皂、造纸、纺织等工业,也可以用来制造其他钠的化合物
8.皓矾——防腐剂、收敛剂、媒染剂
9.明矾——净水剂
10.重晶石——“钡餐”
11.波尔多液——农药、消毒杀菌剂
12.SO2——漂白剂、防腐剂、制H2SO4
13.白磷——制高纯度磷酸、燃烧弹
14.红磷——制安全火柴、农药等
15.氯气——漂白(HClO)、消毒杀菌等
16.Na2O2——漂白剂、供氧剂、氧化剂等
17.H2O2——氧化剂、漂白剂、消毒剂、脱氯剂、火箭燃料等
18.O3——漂白剂(脱色剂)、消毒杀菌剂、吸收紫外线(地球保护伞)
19.石膏——制模型、水泥硬化调节剂、做豆腐中用它使蛋白质凝聚(盐析);
20.苯酚——环境、医疗器械的消毒剂、重要化工原料
21.乙烯——果实催熟剂、有机合成基础原料
22.甲醛——重要的有机合成原料;农业上用作农药,用于制缓效肥料;杀菌、防腐,35%~40%的甲醛溶液用于
浸制生物
23.苯甲酸及其钠盐、丙酸钙等——防腐剂
24.维生素C、E等——抗氧化剂
8
25.葡萄糖——用于制镜业、糖果业、医药工业等
26.SiO2纤维——光导纤维(光纤),广泛用于通讯、医疗、信息处理、传能传像、遥测遥控、照明等方面。
27.高分子分离膜——有选择性地让某些物质通过,而把另外一些物质分离掉。广泛应用于废液的处理及废液中
用成分的回收、海水和苦咸水的淡化、食品工业、氯碱工业等物质的分离上,而且还能用在各种能量的转换上等等。
28.硅聚合物、聚氨酯等高分子材料——用于制各种人造器官
29.氧化铝陶瓷(人造刚玉)——高级耐火材料,如制坩埚、高温炉管等;制刚玉球磨机、高压钠灯的灯管等。
30.氮化硅陶瓷——超硬物质,本身具有润滑性,并且耐磨损;除氢氟酸外,它不与其他无机酸反应,抗腐蚀能力强,高温时也能抗氧化,而且也能抗冷热冲击。常用来制造轴承、汽轮机叶片、机械密封环、永久性模具等机械构件;也可以用来制造柴油机。
31.碳化硼陶瓷——广泛应用在工农业生产、原子能工业、宇航事业等方面。
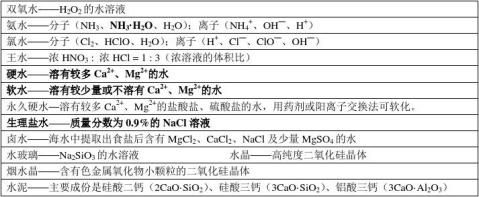
五、各种“气”汇集
爆鸣气——H2与O2 水煤气——CO与H2 笑气——N2O 碳酸气——CO2
高炉气(高炉煤气)——CO、CO2、N2 空气—— N2、O2、稀有气体、少量CO2、水蒸气以及其它杂质气体: 天然气——主要成分为CH4。通常含有H2S等有毒气体杂质。※又名沼气、坑气、瓦斯气。
裂化气——C1~C4的烷烃、烯烃。
裂解气——主要是CH2=CH2 、CH3CH=CH2、CH2=CH—CH=CH2、H2等。
木煤气、焦炉气——H2、CH4、CO等。 炼厂气——C1~C4的气态烃 ※又名石油气、油田气。
电石气——CH≡CH,通常含有H2S、PH3等。
水煤气——H2 、 CO
9
-
高中化学物质颜色总结
高中化学物质颜色总结1红色世界1基态Fe2O3红褐色FeOH3红棕色FeSCN2血红色Cu紫红色Cu2O砖红色NO2红棕色P红磷暗…
-
高中化学物质颜色总结
高中化学物质颜色总结20xx-02-1612:15太多了,我都看不下,先弄到空间里先。1、黑色固体:石墨、炭粉、铁粉、FeS、Cu…
-
高中化学常见物质颜色归纳
中学化学常见物质颜色归纳一.常见的物质颜色1.红色部分含三价铁的化合物:Fe(OH)3红褐色(胶体或沉淀),Fe(SCN)n3?n…
-
高中化学物质颜色总结
初中化学常见物质的颜色一固体的颜色1红色固体铜氧化铁2绿色固体碱式碳酸铜3蓝色固体氢氧化铜硫酸铜晶体4紫黑色固体高锰酸钾5淡黄色固…
-
高中化学物质颜色总结
高中化学物质颜色总结1、红色世界(1)基态:Fe2O3(红褐色)、Fe(OH)3(红棕色)、[Fe(SCN)]2+(血红色)、Cu…
-
20xx.3高中化学基础知识专题总结——物质的颜色
20xx.4.26高中化学物质的颜色(每年高考都考)1.红色:Fe(SCN)3(红色溶液)Cu2O(红色固体)Fe2O3(红棕色固…
-
高中化学物质颜色总结
高中化学物质颜色总结20xx-02-1612:15太多了,我都看不下,先弄到空间里先。1、黑色固体:石墨、炭粉、铁粉、FeS、Cu…
-
高中化学物质颜色总结
高中化学物质颜色总结1、红色世界(1)基态:Fe2O3(红褐色)、Fe(OH)3(红棕色)、[Fe(SCN)]2+(血红色)、Cu…
-
高中化学常见物质性质小结之颜色篇
常见物质性质小结之颜色篇写在前面曾经有一位学弟朋友问我:“你都高考结束了,还写这些高中的学习资料做什么?”我当时回答他说:“我只不…
-
高中化学物质的颜色总结
化学物质颜色总结1.红色:Fe(SCN)]2+(血红色);Cu2O(砖红色);Fe2O3(红棕色)红磷(红棕色);液溴(深红棕色)…
-
高中化学实验汇总与总结
化学实验中的先与后22例1.加热试管时,应先均匀加热后局部加热。2.用排水法收集气体时,先拿出导管后撤酒精灯。3.制取气体时,先检…