新人教版高一化学知识归纳
必修一 知识归纳
第一章 从实验学化学
第一节化学实验基本方法
1.实验安全:标志(爆炸品、易燃物、剧毒、腐蚀品、回收)、安全操作
2.混合物的分离和提纯操作
不加热的:过滤(固—液)、洗气(气—气)、萃取分液(液—液)、渗析(溶—胶)
加热的:蒸发(挥发性差别大)、蒸馏(沸点差大)、分馏、结晶(溶质—溶剂)
(蒸发结晶、冷却热饱和溶液/重结晶、在HCl气氛中加热)
除杂提纯原则:不增(新杂质);不减(有用成分)。
一般方法:①生成↓或↑,②除杂试剂一般要稍过量,③最后再用易挥发性酸处理
操作须注意:①判断某离子已除完——上层清液 ②洗涤沉淀 ③烘干、称量固体
3.检验溶液中的离子(粗略确定)
CO32—(滴加CaCl2溶液/滴加HCl溶液)
Cl—(加入AgNO3溶液)、SO42—(加入BaCl2溶液)
如检验Na2CO3、Na2SO4两溶液
鉴定溶液中的离子
Cl—(先加入HNO3溶液-无现象、再加AgNO3溶液-有沉淀)、
SO42—(加入HCl溶液-无现象、再加BaCl2溶液-有沉淀)
其中酸的作用是排除其它离子(OH—、CO32—、SO32—)的干扰
如鉴定明矾[KAl(SO4)2·12H2O]溶液中含有SO42—离子
4.粗盐(含泥沙、Fe3+、Ca2+、Mg2+、SO42—等)的提纯
①过滤 ②NaOH溶液 ③BaCl2溶液 ④Na2CO3溶液 ⑤过滤 ⑥盐酸 ⑦蒸发结晶
第二节化学计量在实验中的应用
1.公式

①结构微粒:10e粒子:(分子)Ne、HF、H2O、NH3、CH4;
(离子)Na+、Mg2+、Al3+、NH4+、OH-、NH2-、F-、O2-;
14e_ 粒子:Si、N2、CO、C22-、CN-;
18e_ 粒子:(分子)Ar、HCl、H2S、PH3、SiH4;F2、H2O2、N2H4、C2H6、HOF、CH3OH、CH3NH2等(离子)K+、Ca2+、Cl-、S2-、O22-、HS-等
 ②物质状态:常态或标况下为液体的有H2O、C2H5OH、CH3COOH、汽油等
②物质状态:常态或标况下为液体的有H2O、C2H5OH、CH3COOH、汽油等
(2)标准状况下的气体:M=22.4L·mol—1×ρ标气=22.4L·mol—1×
(3)溶液c= =
= V溶液=
V溶液=
溶液稀释前后,溶质的质量(或物质的量)不变
理解公式的要求: m1×ω1=m2×ω2 或 c1V1=c2V2
①符号的含义 ②适合的条件及状态 ③常数 ④单位 ⑤运用时有效数据的处理
2.配制一定物质的量浓度的溶液
步骤:计算、称量、溶解、转移、洗涤、振荡、定容、摇匀
用固体配制溶液用称:天平、药匙 用浓溶液配稀溶液用量:量筒、滴管
判断所配溶液的浓度偏差依据:c= =
=
偏小的:计算和称量时溶质的量偏小,损失溶质、没有进行洗涤;实际所量溶液体积偏大;偏大的:清洗量筒中的溶质,实际所量的溶液体积偏小,温度高于室温
不变的:容量瓶中有蒸馏水
第二章 化学物质及其变化
1.分类
根据物质的特征对物质进行分类(分类法有:单一性、分枝性、交叉性),写出分类依据。

氧化物:金属氧化物(碱性氧化物Fe2O3、两性~ Al2O3、酸性~ Mn2O7、特殊~ Na2O2);
非金属氧化物(两性氧化物SeO3;酸性氧化物SO3 ;不成盐氧化物NO、CO)
(2)物质之间可以发生各种各样的化学反应,依据一定的标准可以对化学变化进行分类:

2.电离:化合物在水(或熔融液)中离解成离子的过程。但不能发生化学变化、生成新物质
可用导电实验来验证(程度与离子浓度有关)。用电离方程式表示
3.离子反应:(1)环境:水溶液 (2)必备条件:①有↓、↑或水 ②有氧化性或还原性差异
(3)溶液中离子的共存(即不反应):熟记溶解性表;HSO3—、HCO3—不与H+、OH—共存
(4)溶液中离子的推断思维:逐一分析、假设验证、抓突破口、统计法
4.离子方程式:定义、意义、书写步骤、判断正确的原则
5.氧化还原反应
(1)判断反应类型的依据(2)判断反应物(3)判断物质发生的半反应
(4)表示方法:单线桥、双线桥
(5)定量:电子转移的数目N(e—)=N(氧化剂)×价变数=N(还原剂)×价变数
电子转移的物质的量:n(e—)=n(氧化剂)×价变数=n(还原产物)×价变数
6.常见氧化剂有:(1) 活泼的非金属单质:O3、O2、Cl2、Br2、I2 ;
(2) 含高价态元素的化合物:KMnO4、HNO3、FeCl3、H2SO4
常见还原剂有:(1) 金属单质:Na、Al、Zn、Fe
(2) 含较低价态元素的化合物:CO、NH3、H2S
当物质中某元素既能生升高又能降低时,该物质性质是:SO2、H2SO3、FeCl2
第三章金属及其化合物
(地球上元素的质量分数:O>Si>Al>Fe>Ca>Na)
金属单质物理性质(金属通性):导电性、导热性、延展性、金属光泽
化学性质:(不加热且在水溶液进行的反应应写出其离子方程式)
1、钠元素
4Na+O2=2Na2O 2Na+O2 Na2O2 2Na+Cl2
Na2O2 2Na+Cl2 2NaCl
2NaCl
2Na+2H2O=2NaOH+H2↑ 2Na+2H2O=2Na++2OH—+H2↑
2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2H2O=4Na++4OH—+O2↑
2Na2O2+2CO2=2Na2CO3+O2 (固体颜色黄变白) 2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
NaHCO3+HCl=NaCl+CO2↑+H2O HCO3—+H+=CO2↑+H2O
Na2CO3+2HCl=2NaCl+CO2↑+H2O CO32—+2H+=CO2↑+H2O
纯碱(苏打)Na2CO3 小苏打NaHCO3
焰色反应为多数金属元素(除Fe、Pt外)在灼烧时火焰的颜色,记住:K浅紫Na黄色
区别Na2CO3、NaHCO3固体(或同浓度溶液)逐滴加入稀HCl
2、铝元素
4Al+3O2 2Al2O3 2Al+6HCl=2AlCl3+3H2↑ 2Al+6H+=2Al+3H2↑
2Al2O3 2Al+6HCl=2AlCl3+3H2↑ 2Al+6H+=2Al+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2Al+2OH—+2H2O=2AlO2—+3H2↑
Al2O3+6H+=2Al3++3H2O Al2O3+2OH—=2AlO2—+H2O
Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4 Al3++3NH3·H2O=Al(OH)3↓+3NH4+
Al(OH)3+3H+=Al3++3H3O Al(OH)3+OH—=AlO2—+2H2O
耐火材料MgO、Al2O3(熔点较高) 铝槽能耐浓HNO3、浓H2SO4的腐蚀
验证溶液中含Al3+(或AlO2—)的方法是:逐滴加入NaOH(或HCl)溶液
3、铁元素
3Fe+2O2 Fe3O4 4Fe+3O2+6H2O=4Fe(OH)3(铁生锈)
Fe3O4 4Fe+3O2+6H2O=4Fe(OH)3(铁生锈)
Fe+H2SO=FeSO4+H2↑ Fe+2H+=Fe2++H2↑
Fe+CuSO4=FeSO4+Cu Fe+Cu2+=Fe2++Cu FexOy+yCO xFe+yCO2
xFe+yCO2
FeO+2H+=Fe+H2O Fe2O3+6H+=2Fe3++3H2O
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4 Fe2++2OH—=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
2FeCl3+Fe=3FeCl2 2Fe3++Fe=3Fe2+
2FeCl2+Cl2=2FeCl3 2Fe2++Cl2=2Fe3++2Cl—
FeCl3+3KSCN=Fe(SCN)3+3KCl Fe3++3SCN—=Fe(SCN)3(难电离物)
第四章 非金属及化合物
1、硅元素
SiO2+4HF=SiF4↑+2H2O SiO2+ CaO  CaSiO3
CaSiO3
SiO2+2NaOH=Na2SiO3(有粘性)+H2O SiO2+2OH—=SiO32—+H2O
Na2SiO3+H2O NaHSiO3+NaOH(使酚酞变红) SiO32—+H2O
NaHSiO3+NaOH(使酚酞变红) SiO32—+H2O HSiO3—+OH—
HSiO3—+OH—
Na2SiO3+2HCl+H2O=H4SiO4↓ SiO32—+2H++H2O=H4SiO4↓
SiO2+2C Si+2CO↑ SiO2+2Cl2
Si+2CO↑ SiO2+2Cl2 SiCl4 SiCl4+2H2
SiCl4 SiCl4+2H2 Si+4HCl
Si+4HCl
石英(光纤)主要为SiO2(玻璃的原料) Na2SiO3是在洗涤时起除去Ca2+、Mg2+的作用
2、氯元素
2Na+Cl2 2NaCl 2Fe+3Cl2
2NaCl 2Fe+3Cl2 2FeCl3 Cu+Cl2
2FeCl3 Cu+Cl2 CuCl2
CuCl2
Cl2+H2O  HClO+HCl Cl2+H2O
HClO+HCl Cl2+H2O HClO+HCl 2HClO
HClO+HCl 2HClO 2HCl+O2↑
2HCl+O2↑
Cl2+2NaOH=NaCl+NaClO+H2O Cl2+2OH—=ClO—+Cl—+H2O
2Cl2+2Ca(OH)2(石灰乳)=CaCl2+Ca(ClO)2+2H2O
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O MnO2+4H++2Cl—
MnCl2+Cl2↑+2H2O MnO2+4H++2Cl—  Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
HCl+AgNO3=AgCl↓+HNO3 NaCl+AgNO3=AgCl↓+HNO3 Cl—+Ag+=AgCl↓
Na2CO3+2AgNO3=Ag2CO3↓+2NaNO3 CO32—+2Ag+=Ag2CO3↓
Ag2CO3+2HNO3=2AgNO3+CO2↑+H2O Ag2CO3+2H+=2AgNO3+CO2↑+H2O
漂白粉为Ca(ClO)2、CaCl2 有效成分为 Ca(ClO)2 。
有漂白作用的有:强氧化性有Na2O2、H2O2、NaClO、Ca(ClO)2、HClO、O3;
与有色的有机物加成有H2SO3;吸附性而漂白有活性碳、Al(OH)3胶体
3、硫和氮的化合物
主要成分的化学式: 硫铁矿(黄铁矿)FeS2 黄铜矿CuFeS2 石膏CaSO4·2HO 芒硝Na2SO4·10H2O 明矾KAl(SO4)2·12H2O 软锰矿MnO2
S+O2 SO2 SO2+H2O
SO2 SO2+H2O H2SO3 2SO2+O2
H2SO3 2SO2+O2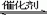 2SO3
2SO3
SO3+CaO=CaSO4 SO3+H2O=H2SO4 SO3+Ca(OH)2=CaSO4+H2O
Cu+2H2SO4(浓)  CuSO4+SO2↑+H2O C+2H2SO4(浓)
CuSO4+SO2↑+H2O C+2H2SO4(浓)  CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
N2+O2
2NO 2NO+O2=2NO2
3NO2+H2O=2HNO3+NO 4NO+O2+2H2O=4HNO3
N2+3H2 2NH3 NH3+H2O=NH3·H2O
2NH3 NH3+H2O=NH3·H2O
NH3·H2O NH3↑+H2O NH3+H2O=NH3·H2O=NH4++OH—
NH3↑+H2O NH3+H2O=NH3·H2O=NH4++OH—
NH3+HCl=NH4Cl NH4HCO3 NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
NH4NO3+NaOH NaNO3+H2O+NH3↑ NH4Cl
NaNO3+H2O+NH3↑ NH4Cl  NH3↑+HCl↑
NH3↑+HCl↑
4NH3+5O2 4NO+6H2O 2NH4Cl+Ca(OH)2
4NO+6H2O 2NH4Cl+Ca(OH)2  CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O Cu+4H++2NO3—=Cu2++2NO2↑+2H2O
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O
4HNO3(浓)  4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
钝化:常温下浓HNO3、浓H2SO4使Al、Fe片的表面产生致密氧化膜,而不能持续反应的现象。
浓HNO3、浓H2SO4工业上常用于制化肥、农药、炸药、染料、盐类;浓H2SO4还用于精炼石油、金属加工前的酸洗及制取各种挥发性酸(如HCl、HNO3等)
气体干燥剂:(固体)P2O5、NaOH、CaO、碱石灰、MgCl2、CaCl2、硅胶、CuSO4粉末;
(溶液)浓H2SO4
生成氢气的反应:较活泼金属与酸(或水)反应;电解水;高温下碳与水反应。
高一化学必修2需记忆的内容
A.化学用语
一、原子序数:0族元素:He(2)、Ne(10)、Ar(18)、Kr(36)、Xe(54)、Rn(86)、(118)

三、电子式:
1.离子化合物:Na2O2: MgCl2:
MgCl2: NH4Cl
NH4Cl
2.共价化合物:HCl: CO2:
CO2:
3.形成过程:KF的形成过程:
四、化学式:
1.N的氢化物NH3(显碱性);
2.Na、Al、N、S、Cl的最高价氧化物对应水化物:NaOH、Al(OH)3、HNO3、H2SO4、HClO4 。
3.同一元素的氢化物与最高价氧化物对应水化物生成盐:NH4NO3
五、电解质的化学式
H、C、N、O四元素形成
强电解质:NH4NO3、NH4NO2、CH3COONH4、HNO3 。弱电解质:HNO2、CH3COOH、NH3·H2O、H2C2O4 。
六、化学方程式:(写出相应的现象及在各节所表述的原理)
1、2Na+O2 Na2O2 2Na+2H2O=2NaOH+H2↑
Na2O2 2Na+2H2O=2NaOH+H2↑
2K+O2 K2O2 2K+2H2O=2KOH+H2↑
K2O2 2K+2H2O=2KOH+H2↑
2、Cl2+2NaBr=2NaCl+Br2 Cl2+2KI=2KCl+I2 Br2+2KI=2KBr+I2
Cl2+2Br—=2Cl—+Br2 Cl2+2I—=2Cl—+I2 Br2+2I—=2Br—+I2
3、Mg+2H2O Mg(OH)2+H2
Mg(OH)2+H2
4、2Al+6HCl=2AlCl3+3H2↑ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+6H+=2Al3++3H2↑ 2Al+2OH—+2H2O=2AlO2—+3H2↑
5、Al2O3+6HCl=2AlCl3+H2O Al2O3+2NaOH=2NaAlO2+H2O
Al2O3+6H+=2Al3++3H2O Al2O3+2OH—=2AlO2—+H2O
6、2Na+Cl2 2NaCl H2+Cl2
2NaCl H2+Cl2 2HCl
2HCl
7、2Al+6HCl=2AlCl3+3H2↑ Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
HCl+NaOH=NaCl+H2O
8、Zn+H2SO4=ZnSO4+H2↑ Zn+2H+=Zn+H2↑
(-)负极 Zn-2e—=Zn2+ (+)正极 2H++2e—=H2
9、2H 2O 2  2H 2O+O 2↑ 2H 2O 2
2H 2O+O 2↑ 2H 2O 2 2H 2O+O 2↑
2H 2O+O 2↑
10、Fe2O3+3CO 2Fe+3CO2 (配平的特点:FexOy+yCO
2Fe+3CO2 (配平的特点:FexOy+yCO xFe+yCO2 )
xFe+yCO2 )
11、CH4+2O2 CO2+H2O C2H4+3O2
CO2+H2O C2H4+3O2 2CO2+3H2O
2CO2+3H2O
2C6H6+15O2 12CO2+6H2O C2H6O+3O2
12CO2+6H2O C2H6O+3O2 2CO2+3H2O
2CO2+3H2O
12、CH4+Cl2  CH3Cl+HCl CH4+2Cl2
CH3Cl+HCl CH4+2Cl2  CH2Cl2+2HCl
CH2Cl2+2HCl
13、CH2=CH2+Br2─→CH2Br-CH2Br(无色液体)

21、金属的冶炼
Fe:Fe2O3+3CO 2Fe+3CO2(高炉炼铁) Fe2O3+2Al
2Fe+3CO2(高炉炼铁) Fe2O3+2Al 2Fe+Al2O3(铝热法)
2Fe+Al2O3(铝热法)
Cu: Cu2S+O2 2Cu+SO2(火法炼铜) Fe+CuSO4 =FeSO4+Cu(湿法炼铜)
2Cu+SO2(火法炼铜) Fe+CuSO4 =FeSO4+Cu(湿法炼铜)
Al:2Al2O3(熔融)  4Al+3O2↑
4Al+3O2↑
Mg:MgO+C  Mg+CO MgCl2(熔融)
Mg+CO MgCl2(熔融)  Mg+Cl2↑
Mg+Cl2↑
Na:2NaCl(熔融)  2Na+Cl2↑ (附:高温下:C+H2O
2Na+Cl2↑ (附:高温下:C+H2O CO+H2)
CO+H2)
22、 2I—+2H++H2O2=I2+2H2O
B基本概念
1.五同(对象、内容)
同位素(原子,同质子数)、同素异形体(单质,同一元素)、
同分异构体(化合物,分子式同、结构不同)、同系物(结构相似,相差原子团CH2)、
同一物(化学式,结构均同,性质也同)。
2.化学键:
1)分类:离子键,共价键(极性键、非极性键)
2)存在:离子键(只存在于离子化合物中)
共价键(存在于共价化合物、非金属单质、离子化合物)(除0族单质外)
3)辩别:离子化合物(阳离子:①金属离子NaOH②含有NH4+离子:NH4Cl、NH4NO3)
共价化合物(以分子形式存在,均为非金属元素。但含NH4+离子的化合物除外)
4)物质的化学键键能越大,所处的能级越小,则该物越稳定。如N2 (含N≡N)
3.反应热
中和热:在稀的强酸强碱反应时生成1mol水所放出的热量
4.化学平衡的标志——可逆反应
1)①方向:有正、逆反应 ②比例:与计量系数呈正比
2)方程式中的某一成分的含量不随时间变化
例 在一容器中进行反应N2+3H2 2NH3达到平衡的标志是
2NH3达到平衡的标志是
①同一时间生成H2的速率和消耗的速率相等;记为v逆(H2)=v正(H2)
②同一时间生成H2的速率为生成NH3的速率的1.5倍;记为v正(NH3)/2=v逆(H2)/3
③N2的含量不随时间变化
C、元素周期表、元素周期律
1.元素周期表:表示元素的位置(周期数、族类及数)
2.元素周期律(递变规律):主要针对的是主族元素(又以第三以下周期为主)
1)原子最外层电子数
2)原子半径 3)元素的主要价态
4)元素性质(金属性、非金属性)
D、有机物的性质
1.物理性质
1)能溶于水的:乙醇、乙醛、乙酸
2)难溶于水的、且密度比水大的:CCl4、硝基苯
2.有机反应类型:
1)取代反应:卤代、酯化、硝化、水解
2)加成反应:有机物的键数减少 3)消去反应:有机物的键数增多
4)氧化反应:得氧去氢 5)还原反应:得氢去氧
6)聚合反应:碳原子数呈倍增多 7)裂化反应:碳数减少
3.基团:
基团:分子减去H原子余下的部分(定有单电子如甲基-CH3、乙基-CH2CH3)
官能团:决定物质特性的基团(也有单电子)
如:卤原子(氯原子-Cl、溴原子-Br)、羟基(-OH)、醛基(-CHO)、羧基(-COOH)
酯基(-COO-) 硝基(-NO2)
E.部分无机物
1.海水
1)淡化:蒸馏法、电渗析法、离子交换法等
2)用途:制NaCl固体、烧碱、纯碱,制取Mg、K、Br2单质
2.气体
1)(煤干馏)焦炉气:H2、CH4、CO等 (煤的气化)水煤气:CO、 H2
2)天然气、瓦斯气、沼气:均含CH4,但含量依次降低
3)石油液化气:C3H8(丙烷)、C4H10(丁烷)、C3H6(丙烯)、C4H8(丁烯)
4)石油裂解气:C2H4(乙烯)、 C3H6(丙烯) 、C3H4(丁二烯)
3.污染
1)空气污染指数:SO2、CO、NOx、可吸入颗粒
2)温室效应:CO 、CH4 3)酸雨:SO2、NOx、
4)白色污染:塑料、薄膜等 5)臭氧空洞:卤代烃引起
F、图像

-
人教版高一化学必修一知识点总结
一重点聚焦1混合物的分离原理和分离方法2混合物分离方法的操作3离子的检验及检验试剂的选择4物质分离与提纯过程的简单设计5物质的量及…
-
人教版高一化学必修一知识点总结
第一章从实验学化学一重点聚焦1混合物的分离原理和分离方法2混合物分离方法的操作3离子的检验及检验试剂的选择4物质分离与提纯过程的简…
-
高一化学必修一知识点总结归纳
从实验学化学一化学实验安全11做有毒气体的实验时应在通风厨中进行并注意对尾气进行适当处理吸收或点燃等进行易燃易爆气体的实验时应注意…
-
高中化学知识点总结人教版
化学一物理性质1有色气体F2淡黄绿色Cl2黄绿色Br2g红棕色I2g紫红色NO2红棕色O3淡蓝色其余均为无色气体其它物质的颜色见会…
-
人教版高一化学必修一知识点总结
一重点聚焦1混合物的分离原理和分离方法2混合物分离方法的操作3离子的检验及检验试剂的选择4物质分离与提纯过程的简单设计5物质的量及…
-
高中化学必修2知识点归纳总结律必背
高中化学必修2知识点归纳总结第一章物质结构元素周期律一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中…
-
高中化学选修4知识点归纳总结律
高中化学选修4知识点归纳总结第一章化学反应与能量一焓变反应热1反应热一定条件下一定物质的量的反应物之间完全反应所放出或吸收的热量2…
-
人教版高一化学必修一知识点总结
一重点聚焦1混合物的分离原理和分离方法2混合物分离方法的操作3离子的检验及检验试剂的选择4物质分离与提纯过程的简单设计5物质的量及…
-
高中化学知识点总结人教版
化学一物理性质1有色气体F2淡黄绿色Cl2黄绿色Br2g红棕色I2g紫红色NO2红棕色O3淡蓝色其余均为无色气体其它物质的颜色见会…
-
人教版高一化学必修一知识点总结
一重点聚焦1混合物的分离原理和分离方法2混合物分离方法的操作3离子的检验及检验试剂的选择4物质分离与提纯过程的简单设计5物质的量及…
-
高一化学知识总结:3 几种重要的金属化合物
第二节几种重要的金属化合物第一课时教学目标1.让学生掌握几种典型金属氧化物在水中的溶解性,与酸反应以及与碱反应的性质。2.让学生学…