临床试验伦理委员会审查内容有哪些
临床试验伦理委员会审查内容有哪些? 伦理审查,即我们常说的上会,一般召开的频率是以月计算,那么伦理会上审查的主要内容有哪些呢?
1. 试验方案的设计与实施
1.1 试验符合公认的科学原理,基于文献以及充分的实验室研究和动物实验。
1.2 与试验目的有关的试验设计和对照组设置的合理性。
1.3 受试者提前退出试验的标准,暂停或终止试验的标准。
1.4 试验实施过程中的监查和稽查计划,包括必要时成立独立的数据与安全监察委员会。
1.5 研究者的资格与经验、并有充分的时间开展临床试验,人员配备及设备条件等符合试验要求。
1.6 临床试验结果报告和发表的方式。
2. 试验的风险与受益
2.1 试验风险的性质、程度与发生概率的评估。
2.2 风险在可能的范围内最小化。
2.3 预期受益的评估:受试者的受益和社会的受益。
2.4 试验风险与受益的合理性:①对受试者有直接受益前景的试验,预期受益与风险应至少与目前可获得的替代治疗的受益与风险相当。试验风险相对于受试者预期的受益而言必须是合理的;②对受试者没有直接受益前景的试验,风险相对于社会预期受益而言,必须是合理的。
3. 受试者的招募
3.1 受试者的人群特征(包括性别、年龄、种族等)。
3.2 试验的受益和风险在目标疾病人群中公平和公正分配。
3.3 拟采取的招募方式和方法。
3.4 向受试者或其代表告知有关试验信息的方式。
3.5 受试者的纳入与排除标准。
4. 知情同意书告知的信息
4.1 试验目的、应遵循的试验步骤(包括所有侵入性操作)、试验期限。
4.2 预期的受试者的风险和不便。
4.3 预期的受益。当受试者没有直接受益时,应告知受试者。
4.4 受试者可获得的备选治疗,以及备选治疗重要的潜在风险和受益。
4.5 受试者参加试验是否获得报酬。
4.6 受试者参加试验是否需要承担费用。
4.7 能识别受试者身份的有关记录的保密程度,并说明必要时,试验项目申办者、伦理委员会、政府管理部门按规定可以查阅参加试验的受试者资料。
4.8 如发生与试验相关的损害时,受试者可以获得的治疗和相应的补偿。
4.9 说明参加试验是自愿的,可以拒绝参加或有权在试验的任何阶段随时退出试验而不会遭到歧视或报复,其医疗待遇与权益不会受到影响。
4.10 当存在有关试验和受试者权利的问题,以及发生试验相关伤害时,有联系人及联系方式。
5. 知情同意的过程
5.1 知情同意应符合完全告知、充分理解、自主选择的原则。
5.2 知情同意的表述应通俗易懂,适合该受试者群体理解的水平。
5.3 对如何获得知情同意有详细的描述,包括明确由谁负责获取知情同意,以及签署知情同意书的规定。
5.4 计划纳入不能表达知情同意者作为受试者时,理由充分正当,对如何获得知情同意或授权同意有详细说明。
5.5 在研究过程中听取并答复受试者或其代表的疑问和意见的规定。
6. 受试者的医疗和保护
6.1 研究人员资格和经验与试验的要求相适应。
6.2 因试验目的而不给予标准治疗的理由。
6.3 在试验过程中和试验结束后,为受试者提供的医疗保障。
6.4 为受试者提供适当的医疗监测、心理与社会支持。
6.5 受试者自愿退出试验时拟采取的措施。
6.6 延长使用、紧急使用或出于同情而提供试验用药的标准。
6.7 试验结束后,是否继续向受试者提供试验用药的说明。
6.8 受试者需要支付的费用说明。
6.9 提供受试者的补偿(包括现金、服务、和/或礼物)。
6.10 由于参加试验造成受试者的损害/残疾/死亡时提供的补偿或治疗。
6.11 保险和损害赔偿。
7. 隐私和保密
7.1 可以查阅受试者个人信息(包括病历记录、生物学标本)人员的规定。
7.2 确保受试者个人信息保密和安全的措施。
8. 涉及弱势群体的试验
8.1 唯有以该弱势人群作为受试者,试验才能很好地进行。
8.2 试验针对该弱势群体特有的疾病或健康问题。
8.3 当试验对弱势群体受试者不提供直接受益可能,试验风险一般不得大于最小风险,除非伦理委员会同意风险程度可略有增加。
8.4 当受试者不能给予充分知情同意时,要获得其法定代理人的知情同意,如有可能还应同时获得受试者本人的同意。
9. 涉及特殊疾病人群、特定地区人群/族群的试验
9.1 该试验对特殊疾病人群、特定地区人群/族群造成的影响。
9.2 外界因素对个人知情同意的影响。
9.3 试验过程中,计划向该人群进行咨询。
9.4 该试验有利于当地的发展,如加强当地的医疗保健服务,提升研究能力,以及应对公共卫生需求的能力。
弗锐达医疗器械技术服务有限公司
第二篇:临床试验伦理审查
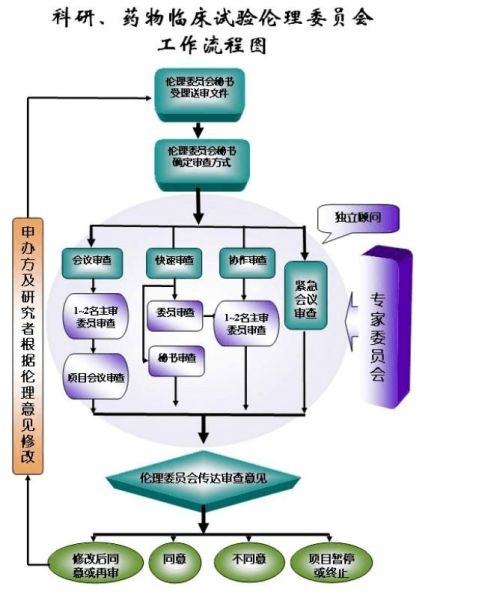
编者按:在我国,目前有两种伦理委员会批准方式:一种是中心伦理委员会批准(指牵头单位或NCO的伦理委员会),各参加单位接受中心伦理委员会的批准,不再自行审定,只需要中心伦理委员会的批件;而另一种审批方式目前越发常见,是部分单位必须通过本单位的伦理委员会批准,但也需要中心伦理委员会的批件,而还有一些单位只通过了本单位伦理审核便开始试验,一些申办方及CRO公司为了项目进度,因而认可并配合执行了此种审批方式。”
要从何时就开始准备递交中心伦理的资料呢?
虽然CRO公司与药厂操作模式不同,但通常在国家局批件获得、临床试验相关资料准备齐全后便需要CRA开始陆续准备过伦理时需要的各种资料。这时需要充分了解医院递交资料的时间,如医院给予的时间并不十分确定或有变动的可能,都建议CRA随时与医院保持电话联络或亲自拜访,这样虽然多了很多辛苦,但也许只因为一个电话没打或一夜之差,可能这份伦理递交的时间就要多拖延上半个月或一个月也是有的。
CRA在伦理会议前需要准备什么呢?
1、获得中心机构老师、机构主任或伦理秘书的直接联系电话、邮箱等(药物临床试验网机构数据频道可供网友随时查阅机构电话)。
2、问清贵医院伦理会议召开时间(如上旬或下旬)、一月几次、是否可以快速审查、伦理递交资料清单、递送地址和收件人、开户行与账号(还要问清账户名,这个账户名一般就是该院正规试验叫法,因为很多医院有很多名字,但是一定要掌握它临床试验医院名字)、费用。
3、开始打印、复印资料、证件盖章、填写伦理申请表、扫描并准备电子版文件(这时如果你是实习生,就要主动申请参加资料准备工作,前辈们也会对你有好印象,你也会经过这次磨练熟悉伦理备案)、伦理费最好早点打款,特别是遇到财政制度慢的公司,需要层层签字的(打款时一定要备注自己公司项目)、资料是越早邮寄越好,一切事宜要多和机构老师沟通,以确保事情有条不紊且最保持效率的进行。
4、确保各方资料完整送到老师手中并时常保持联络,以防止或抑制一切意外情况的发生。
伦理会议前后CRA该提前注意些什么?
1、伦理会议上准备的PPT资料需包含:参加单位、药物临床前研究、试验的必要性、方案入排标准、试验用药情况剂量、剂量调整、方案流程图、受试者收益与风险、试验进度等信息,最好提前准备完善的资料,以备之后的提问环节可以应对妥当。
2、CRA可以提前一个小时左右到达会议现场,协助,水果摆放、资料分配、幻灯片调试等,留下好印象。
3、伦理会议中提问环节可能涉及诸多可以回答及不能做出详细回答的问题,对于经常较真的问题的单位CRA需提前安排与项目经理沟通看如何应对,一般看会议的情况,差不多就知道此伦理会不会顺利通过了。
4、伦理会议结束,要问机构老师批件一般什么时候可以出来,是否可以邮寄等。
那什么情况下伦理委员会要对临床试验方案重新审批呢?
试验设计为伦理不可接受,需修改后开会重审;更惨的是直接否了,不能在该医院进行
试验。但是一般的情况,如文字、检查、评价标准的小改动,都是正常地修改后同意,不会轻易否掉的。
因伦理行为并不受任何机构的干涉,也不会因方案设计合理性或其他帮助方法而致伦理审核通过与否,所以伦理审批中遇到困难时CRA也只能干瞪眼没辙,但朋友们看过以上问答式的分享后,脑中是不是清晰了很多呢?其实无非就是这样一个过程,大家各司其职,CRA则需要付出更多的细心与耐心,方能看见顺利的曙光!(药物临床试验)
-
医学伦理委员会会议记录
20xx年医学伦理委员会会议记录时间20xx年11月18日地点大会议室内容召开20xx年医疗质量伦理委员会参会人员以及相关工作人员…
-
20xx年医学伦理委员会第二次会议记录
巴州区红十字医院20xx年医学伦理委员会第二次会议记录时间20xx年7月15日下午2时30分地点三楼会议室参加人员姜春华何元扬谢宙…
-
20xx年医学伦理委员会第一次会议纪要
巴州区红十字医院20xx年医学伦理委员会第一次会议纪要时间20xx年3月15日下午地点三楼小会议室参加人员姜春华何元扬谢宙宏陈毅王…
-
03-20xx年伦理委员会会议记录£
龙口市人民医院20xx年医学伦理委员会会议记录时间20xx年8月15日下午2时30分地点医院门诊楼四楼小会议室主持傅继东参加人员王…
-
20xx年医学伦理委员会会议记录
20xx年医学伦理委员会会议记录时间20xx年8月28日地点大会议室内容召开20xx年医疗质量伦理委员会参会人员签名会议内容1院长…
-
医学伦理委员会会议总结
20xx年x月x日在院长,医学伦理委员会程朝俊的主持下,医学伦理委员会在三楼大会议室召开会议总结会,各科人员参加了会议。程院长总结…
- 医学伦理委员会20xx年第一季度全体会议
- 医学伦理委员会20xx年第二季度全体会议
-
伦理委员会工作职责
医学伦理委员会工作职责一主任职责一行使伦理委员会主任的职责二有权对伦理委员会成员进行推荐及任免三制定或修改伦理委员会章程四审核并签…
-
伦理管理委员会
西宁康福中西医结合医院伦理管理委员会为了加强以病人为中心的服务和在涉及人体生命的道德与伦理问题的实践中发挥积极重要的作用加强医学伦…