必修一第一章物质的量知识点归纳
专题一 物质的量
【知识回顾】
一、第一章知识结构框架图:
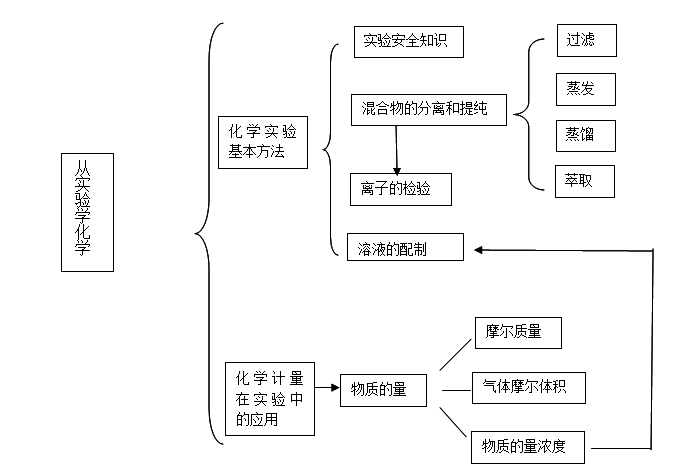
二、物质的量相关知识点
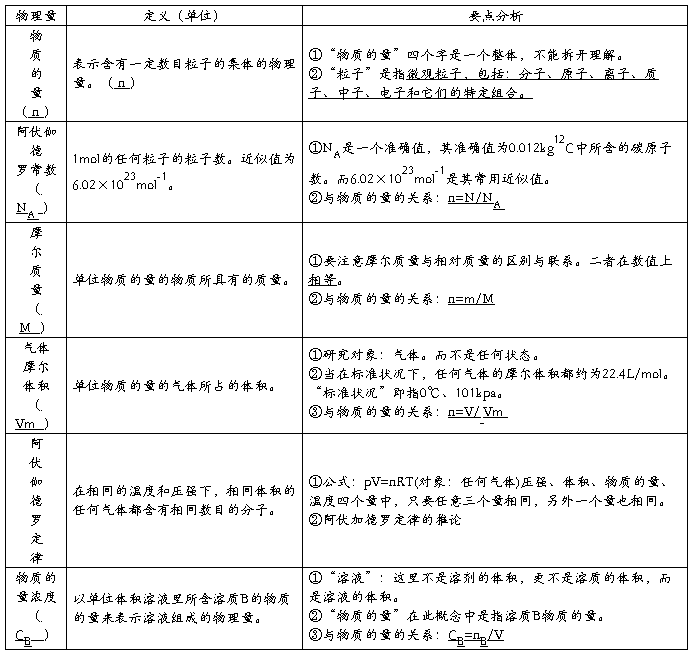
1、基本概念
【即时练习】
判断正误。(概念理解)
1 1mol大米
2 1mol氧
3 水的摩尔质量等于NA个水分子质量之和。
4 1mol CH4和1mol CO所含分子数目相同。
【答案与解析】
1(X)物质的量是用来描述微观粒子的物理量,不能描述宏观物体。
2(X)使用物质的量一定要指明具体的微粒。例如1mol氧分子(O2)或1mol氧原子(O)。
3(X)摩尔质量不等于质量,摩尔质量的单位是g/mol,质量的单位是g。
4(√)1mol的任何粒子的粒子数都相等,为NA个。
2、知识网络:

3、阿伏加德罗定律
1)同温同压下相同体积的任何气体都具有相同的分子数:PV=nRT
说明:
(1)阿伏加德罗定律依然是忽略了气体分子本身的大小
(2)阿伏加德罗定律比气体摩尔体积的应用更为广泛:
① 主要是应用于不同气体之间的比较,也可以同一种气体的比较
② 被比较的气体既可以是纯净气体又可以是混合气体
2) 阿伏加德罗定律的重要的四个推论
(1)同温同体积时,任何气体的压强之比都等于其物质的量之比,也等于其分子数之比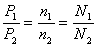
(2)同温同压时,任何气体的体积之比都等于其物质的量之比,也等于其分子数之比

(3)同温同压同体积时,任何气体的质量之比都等于其摩尔质量之比,也就是其式量之比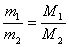
(4)同温同压同体积时,任何气体的密度之比都等于其摩尔质量之比,也就是其式量之比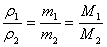
4、分子量的有关计算
(1)标准状况下mgA气体的体积为V升,求A的相对分子质量M=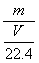
(2)标准状况下A气体的密度为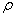 g/L,求A的相对分子质量
g/L,求A的相对分子质量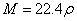
使用说明:
① 适用于所有的物质,不受物质状态的限制,也适用于所有的混合物
② 所有物质: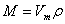 ,标准状况下气体
,标准状况下气体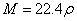
③ 某有机物气体在同温同压下对氢气的相对密度为2.69,求该气体的式量。
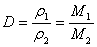
使用说明:
A. 相对密度是在同温同压下两种气体的密度之比
B. 既可以用于纯净气体之间的计算,也可以用于混合气体之间
(3)平均相对分子质量
有a mol A气体,与b mol B气体混合,则混合气体的平均式量为
M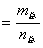 =
=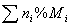 =
=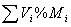
 5
、一定物质的量浓度溶液的配制
5
、一定物质的量浓度溶液的配制
C1V1=C2V2
【课堂练习】 相对原子质量:H-1 C-12 O-16 Na-23 P-31 S-32
一、 选择题
1、用1 g NaOH固体配制成0.5 mol/L NaOH溶液,所得溶液的体积是 ( )
A.0.5ml B.5ml C.50ml D.500ml
2、设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是 ( )
A.1 mol NH3所含有的原子数为NA
B.常温常压下,22 .4 L氧气所含的原子数为2NA
C.常温常压下,48 g O3所含的氧原子数为3NA
D.1 L 0.1 mol/LNaCl溶液中所含的Na+为NA
3、设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 mol氦气中有2NA个氦原子
B.14 g氮气中含NA个氮原子
C.2 L 0.3 mol·L-1 Na2SO4溶液中含0.6 NA个Na+
D.18 g水中所含的电子数为8NA
4、科学家已发现一种新型氢分子,其化学式为H3,在相同条件下,等质量的H3和H2相同的是
A.原子数 B.分子数 C.体积 D.物质的量
5、同温同压下,等质量的下列气体所占有的体积最大的是
A.O2 B.CH4 C.CO2 D.SO2
6、在标准状况下,将某X气体VL溶于水中,得到12mol·L-1的溶液500mL,则气体的体积V是( )
A.134.4L B.67.2L
C.44.8L D.537.6L
7、体积为VmL,密度为dg·cm-3的溶液,含有相对分子质量为M的溶质mg,其物质的量浓度为cmol·L-1,质量分数为w,下列表达式正确的是( )
A.c=(w×1000×d)/M
B.m=V×d×(w/100)
C.w=(c×M)/(1000×d)%
D.c=(1000×m)/(V×M)
8.在一定温度下,已知有关某饱和溶液的一些数据:①溶液的质量,②溶剂的质量,③溶液的体积,④溶质的摩尔质量,⑤溶质的溶解度,⑥溶液的密度,利用下列各组数据计算该饱和溶液的物质的量浓度,不能算出的一组是( )
A.④⑤⑥ B.①②③④
C.①④⑥ D.①③④⑤
9、一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为( )
提示:①H2C2O4是二元弱酸
②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4===8MnSO4+9K2SO4+40CO2↑+32H2O
A.0.008889 B.0.08000
C.0.1200 D.0.2400
10、下列说法正确的是 ( )
A.1mol物质的质量叫做摩尔质量
B.两个等容容器,一个盛一氧化氮,另一个盛N2、H2混合气,同T、同P下两容器内气体原子总数一定相同,分子总数和质子总数也相同
C.将98g H2SO4溶于500mL水中所得到的溶液浓度为2mol/L
D.等质量的O2和O3中所含的氧原子数相等
11、同温同压下,A容器中H2和B容器中的NH3所含氢原子数相等,则两个容器的体积比是 ( )
A.3∶2 B.1∶3 C.2∶3 D.1∶2
12、下列叙述中正确的是 ( )
A.镁的原子质量就是镁的相对原子质量
B.一个氧原子的实际质量约等于g
C.水的相对分子质量等于18g
D.二氧化硫的摩尔质量是64g
13、下列说法正确的是 ( )
A.200mL 1mol/L的Al2(SO4)3溶液中,Al3+和SO离子总数为6.02×1023
B.标准状况下,22.4L Cl2和HCl的混合气体中含分子总数为2×6.02×1023
C.0.1mol Br原子中含中子数为3.5×6.02×1023
D.30g甲醛中含共用电子对总数为4×6.02×1023
14、用NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.100mL 0.1mol/L的稀硫酸中含有硫酸根的个数为0.1NA
B.1mol CH(碳正离子)中含有电子数10NA
C.2.4g金属镁与足量的盐酸反应,转移电子数为2NA
D.12.4g白磷中含有磷原子数为0.4NA
15、由14CO和12CO组成的混合气体与同温、同压下空气(平均相对分子质量为29)的密度相同,则下列关系正确的是 ( )
A.混合气体中14CO与12CO的分子数之比为14∶15
B.混合气体中14CO与12CO的物质的量之比为1∶1
C.混合气体中14CO与12CO的质量之比为14∶15
D.混合气体中14CO与12CO的密度之比为1∶1
16、由CO、H2和O2组成的混合气体,在一定条件下恰好完全反应,测得生成物在101kPa、120℃下对空气的相对密度为1.293,则原混合气体中H2所占的体积分数为 ( )
A. B. C. D.
17、若以ω1和ω2分别表示浓度为amol·L-1和bmol·L-1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小) ( )
A.2ω1=ω2 B.2ω2=ω1
C.ω2>2ω1 D.ω1<ω2<2ω1
18有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(设反应中HNO3被还原成NO) ( )
A.0.448L B.0.672L C.0.896L D.0.224L
二、填空题
1、右图是用自来水制取少量蒸馏水的简易装置,(加热及固定仪器略),其原理与教材中的实验完全相同。回答下列问题:
⑴左边大试管中要加入几片碎瓷片,其作用是
;
 ⑵该装置中使用的玻璃导管较长,其作用是 ;
⑵该装置中使用的玻璃导管较长,其作用是 ;
⑶烧杯中还要盛有的物质是 。
2、为除去粗盐中的Ca2+、Mg2+、Fe3+、SO以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):


(1)判断BaCl2已过量的方法是__________________________________。
(2)第④步中,相关的化学方程式是_______________________________________。
(3)配制NaCl溶液时,若出现下列操作,其结果偏高还是偏低?
A.称量时NaCl已潮解( )
B.天平的砝码已锈蚀( )
C.定容摇匀时,液面下降又加水( )
D.定容时俯视刻度线( )
3.现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂出去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示: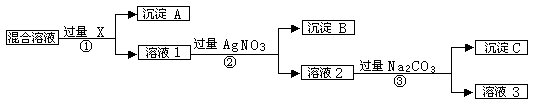
请回答下列问题:
⑴写出实验流程中下列物质的化学式: 试剂X_________,沉淀A________,沉淀B___________。
⑵上述实验流程中加入过量的Na2CO3的目的是____________________________
______________________________________________________。
⑶按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________,之后若要获得固体NaNO3需进行的实验操作是___________(填操作名称)。
5、已知标准状况下1体积水溶解了560体积氨气,所得氨水的密度为0.9g/cm3,试求该氨水的质量分数和物质的量浓度。
第二篇:化学必修一第一章知识点归纳
第一章 从实验学化学 第一节化学实验基本方法
一、化学实验安全
二.混合物的分离和提纯
1. 过滤和蒸发
实验1—1 粗盐的提纯
仪器 : 天平,烧杯,玻璃棒,漏斗,铁架台,铁圈步骤 :

注意事项:(1)一贴,二低,三靠。
(2)蒸馏过程中用玻璃棒搅拌,防止液滴飞溅。
2. 蒸馏和萃取(1) 蒸馏
原理:利用沸点的不同,处去难挥发或不挥发的杂质。
实验1---3 从自来水制取蒸馏水
仪器:温度计,蒸馏烧瓶,石棉网,铁架台,酒精灯,冷凝管,牛角管,锥形瓶。
操作:连接好装置,通入冷凝水,开始加热。弃去开始镏出的部分液体,用锥形瓶收集约10mL液体,停止加热.
现象: 随着加热,烧瓶中水温升高至100度后沸腾,锥形瓶中收集到蒸馏水.
注意事项:①温度计的水银球在蒸馏烧瓶的支管口处。
②蒸馏烧瓶中放少量碎瓷片-----防液体暴沸。
③冷凝管中冷却水从下口进,上口出。
④先打开冷凝水,再加热。
⑤溶液不可蒸干。
(2)萃取
原理: 用一种溶把溶质从它与另一溶剂所组成的溶液里提取出来.
仪器: 分液漏斗, 烧杯
步骤: ①检验分液漏斗是否漏水.
②量取10mL碘的饱和溶液倒入分液漏斗, 注入4mLCCl4,盖好瓶塞.
③用右手压住分液漏斗口部, 左手握住活塞部分, 把分液漏斗倒转过来用力振荡.
④将分液漏斗放在铁架台上,静置.
⑤待液体分层后, 将分液漏斗上的玻璃塞打开,从下端口放出下层溶液,从上端口倒出上层溶液.
注意事项: A 检验分液漏斗是否漏水.
B 萃取剂: 互不相溶,不能反应.
C 上层溶液从上口倒出,下层溶液从下口放出.
三. 离子检验

四.除杂
1.原则:杂转纯、杂变沉、化为气、溶剂分。
2.注意:为了使杂质除尽,加入的试剂不能是“适量”,而应是“过量”;但过量的试剂必须在后续操作中便于除去。
第二节 化学计量在实验中的应用
一、物质的量的单位――摩尔
1.物质的量(n)是表示含有一定数目粒子的集体的物理量。七个基本物理量之一。
2.摩尔(mol): 把含有6.02 ×1023个粒子的任何粒子集体计量为1摩尔。
3.阿伏加德罗常数:1mol物质中所含的“微粒数”。
把6.02 X1023mol-1叫作阿伏加德罗常数。
4.物质的量 = 物质所含微粒数目/阿伏加德罗常数 n =N/NA
5.摩尔质量(M)
(1) 定义:单位物质的量的物质所具有的质量叫摩尔质量.(2)单位:g/mol 或 g.mol-1
(3) 数值:等于该粒子的相对原子质量或相对分子质量.
6.物质的量=物质的质量/摩尔质量 ( n = m/M )
二、气体摩尔体积
1.气体摩尔体积(Vm)
(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积.
(2)单位:L/mol 或 m3/mol
2.物质的量=气体的体积/气体摩尔体积n=V/Vm
3.(1)0℃ 101KPa , Vm = 22.4 L/mol
三、物质的量在化学实验中的应用
1.物质的量浓度.
(1)定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度。
(2)单位:mol/L , mol/m3
(3)物质的量浓度 = 溶质的物质的量/溶液的体积 CB = nB/V
2.一定物质的量浓度的配制
(1)基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制得溶液.
(2)主要操作
a.检验是否漏水.
b.配制溶液 1.计算 2.称量3.溶解 4.冷却5.转移 6.洗涤 7.定容 8.摇匀 9.贮存溶液.
注意事项:A 选用与欲配制溶液体积相同的容量瓶. B 使用前必须检查是否漏水. C 不能在容量瓶内直接溶解. D 溶解完的溶液等冷却至室温时再转移. E 定容时,当液面离刻度线1―2cm时改用滴管,以平视法观察加水至液面最低处与刻度相切为止.
3.溶液稀释
C(浓溶液)·V(浓溶液) =C(稀溶液)·V(稀溶液)
-
高中生物必修一第一章知识点总结
第一章走近细胞第一节从生物圈到细胞1病毒没有细胞结构,必须依赖(活细胞)才能生存和繁殖。生活方式:寄生在活细胞病毒分类:DNA病毒…
-
高中生物必修一第一章知识点总结
第一章走进细胞核心概念第一节从生物圈到细胞生物学事实一生命活动离不开细胞1单细胞生物草履虫就能完成各项生命活动2多细胞生物依赖各种…
-
高一生物必修一第一章知识点总结
第一章第一节从生物圈到细胞1细胞是生物体结构和功能的基本单位除了病毒以外所有生物都是由细胞构成的2生物的生命活动离不开细胞对于单细…
-
高中生物必修一知识点总结(20xx版)
高一生物考试重要知识点第一章走近细胞第一节从生物圈到细胞1病毒没有细胞结构但必须依赖活细胞才能生存寄生在活细胞中利用细胞里的物质结…
-
高一生物必修一知识点总结(整理版)
必修(1)知识点整理第一章走近细胞第一节从生物圈到细胞一、相关概念、细胞:是生物体结构和功能的基本单位。除了病毒以外,所有生物都是…
-
物质的量相关知识点总结
一、物质的量及单位——摩尔1.物质的量以________中所含的_________数为标准来衡量其他微粒集体所含微粒数目多少的物理…
-
盐类的水解知识点总结
盐类水解的应用考点1判断或解释盐溶液的酸碱性例如正盐KXKYKZ的溶液物质的量浓度相同其pH值分别为789则HXHYHZ的酸性强弱…
-
物质的量知识点总结
物质的量知识点复习1摩尔物质的量是国际规定的七个基本物理量之一用来表示含一定数目粒子的集体符号是n单位是mol摩尔是计量原子分子或…
-
物质的量单元知识点复习小结
物质的量单元知识点复习小结一有关概念1物质的量n物质的量是国际单位制中七个基本物理量之一用物质的量可以衡量组成该物质的基本单元即微…
-
高一化学物质的量知识点归纳2
化学计量在实验中的应用考点一物质的量与摩尔质量1物质的量1定义表示物质所含微粒多少的物理量也表示含有一定数目粒子的集合体2物质的量…
-
工程质量监督员年终总结
建设工程质量监督员年终工作总结20xx年本人在住建局和建设工程质量管理站的正确领导下,立足本职工作,认真完成了领导交待的各项任务,…