氧气知识点总结
氧气
一、氧气的性质
1.物理性质:
(1)色、味、态:无色无味的气体;(2)密度:密度略大于空气;
(3)溶解性:氧气不易溶于水
2.氧气的化学性质:支持燃烧,供给呼吸
3.氧气的用途:供呼吸 (如潜水、医疗急救) 支持燃烧 (如燃料燃烧、炼钢、气焊)
4.燃烧现象
(1)木炭在氧气中燃烧(黑色固体)
碳 在空气燃烧中红热,产生气体
在氧气中发出白光,放热,产生能使澄清石灰水变浑浊的气体
点燃
 文字表达式:碳+氧气 二氧化碳
文字表达式:碳+氧气 二氧化碳
(2)硫在氧气中燃烧 (黄色粉末)
硫 在空气中燃烧发出微弱的淡蓝色火焰,放热生成有刺激性气味的气体。
在氧气中发出明亮的蓝紫色火焰, 放热,产生有刺激性气味的气体
点燃
 文字表达式:硫+氧气 二氧化硫
文字表达式:硫+氧气 二氧化硫
注:集气瓶底部加少量的水的目的——是吸收二氧化硫,防止污染环境,
(3)红磷在氧气中的燃烧
产生黄色火焰,放出热量,生成大量的白烟。
点燃
 文字表达式:红磷+氧气 五氧化二磷
文字表达式:红磷+氧气 五氧化二磷
注:集气瓶集气瓶底部加少量的水的目的—--冷却吸收五氧化二磷
(4)铁在氧气中的燃烧
铁剧烈燃烧,火星四射,放出大量热生成一种黑色固体。
文字表达式: 点燃
 铁+氧气 四氧化三铁
铁+氧气 四氧化三铁
注:1铁燃烧要在集气瓶底部放少量水或细砂的目的:防止溅落的高温熔化物炸裂瓶底
2使用火柴目的引燃铁丝。
3铁丝绕成螺旋状目的是提高铁丝的温度。
4待火柴快燃尽时候放入集气瓶:防止火柴太长,消耗过多的氧气,看不见火星四射的现象。
二、用实验测定空气中氧气的含量
 1.原理:空气是由氧气和氮气等多种气体组成的,为了测定空气中氧气的体积分数,可以选择某种能与氧气反应而不与空气中其他气体反应的固体物质,利用氧气与该物质反应后生成固体物质,使密闭容器中气体体积减小,气体压强减小,引起水面发生变化,从而确定氧气的体积分数。
1.原理:空气是由氧气和氮气等多种气体组成的,为了测定空气中氧气的体积分数,可以选择某种能与氧气反应而不与空气中其他气体反应的固体物质,利用氧气与该物质反应后生成固体物质,使密闭容器中气体体积减小,气体压强减小,引起水面发生变化,从而确定氧气的体积分数。
2.实验开始前先检查装置的气密性。
3.现象: 红磷燃烧产生黄色火焰,放出热量,生成大量的白烟。
烧杯中的水沿导气管进入集气瓶里,进入瓶中水的体积约占瓶内剩余容积的1/5。
4注意事项:
①红磷要过量。如果红磷不足,则不能将集气瓶内空气中的氧气完全消耗掉,导致测得空气中氧气的体积分数偏小。
②集气瓶集气瓶底部加少量的水的目的——冷却吸收五氧化二磷
3不能用木炭、硫、铁丝等代替红磷
木炭、硫燃烧生成物都是二氧化碳、二氧化硫是气体,会弥补所消耗的氧气的体积,不能产生压强差。铁不能在空气中燃烧
4导管内事先注满水。否则燃烧冷却后,倒吸的水有一部分存在导管中,使进入集气瓶内水的体积减少,测量结果偏低。
5.瓶中液面上升的体积小于瓶内空间的1/5的可能原因:
①红磷量不足 ②气密性不好,使外界空气进入瓶内 ③未冷却至室温
三、氧气的制取
1. 实验室制氧气原理
(1)、分解过氧化氢溶液;
过氧化氢 水 + 氧气
水 + 氧气
H2O2 H2O + O2
H2O + O2
(2)、加热氯酸钾固体;
 氯酸钾
氯酸钾 氯化钾 + 氧气
氯化钾 + 氧气
 KClO3 KCl + O2
KClO3 KCl + O2
(3)、加热高锰酸钾固体
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
锰酸钾 + 二氧化锰 + 氧气
KMnO4 K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
2. 反应装置
(1)固+液体(不加热) 适用(H2O2与MnO2反应制氧气)

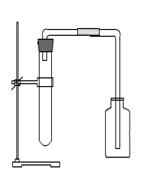
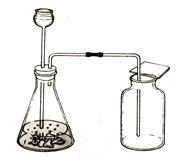
长颈漏斗可以随时添加液体,但底部要形成液封。分液漏斗可以控制反应速率。
 (2)收集装置
(2)收集装置
排水法:
① 适用范围:难溶或微溶于水且不与水发生反应的气体。
注意事项:集气瓶要装满水。
优点:收集的气体比较纯净 。 缺点:收集的气体很潮湿
② 排气法:适用范围:不与空气反应且密度与空气相差较大的气体;又可分为向上排空气法和向下排空气法。
注意事项:用排气法收集气体时,导气管一定要伸入集气瓶底部,把空气尽量排出。为了减少空气扩散,集气瓶口可盖上毛玻璃片
优点:收集的气体比较干燥 。 缺点:收集的气体不纯净。
3. 装置气密性检查
装置气密性检查:先将导管的一端浸入水中,用手握紧容器外壁,若导管口有气泡冒出,说明装置不漏气。
4. 氧气的验满:将一支带火星的木条伸到集气瓶口附近,若木条复燃,证明已收集满
5. 氧气的检验:用带火星的木条伸入集气瓶内,若木条复燃则,证明瓶内是氧气。
四、氧气的工业制法(分离液态空气法)
原理:利用液态氧和液态氮的沸点不同。
注意:该过程是物理变化
五、催化剂:
1、 概念:在化学反应中能改变其他物质的反应速率(加快或变慢),但本身的化学性质和质量在反应前后没有发生变化的物质。
2、 特点:一改变(其他物质的反应速率) 二不变(质量、化学性质)、
改变不一定是加快,还有可能是减慢。 质量和化学性质不变,物理性质有可能改变
注意:①催化剂不能改变生成物的质量,不能决定反应的进行
②催化剂不是反应物、又不是生成物
③催化剂仅针对某一反应,并不是所有反应的催化剂
④某一反应的催化剂可能不只一种
3、二氧化锰在一些反应中不只作催化剂,催化剂不一定就只有二氧化锰。(在过氧化氢溶液制取氧气中,催化剂可以用硫酸铜溶液、红砖粉末)。
六、1.氧化反应:物质与氧发生的反应 (不是氧气)

 2.化合反应:有两种或两种以上物质生成另一种物质的反应叫化合反应。 “ 多变一 ”
2.化合反应:有两种或两种以上物质生成另一种物质的反应叫化合反应。 “ 多变一 ”
化合反应与氧化反应的关系:
氧化反应不一定是化合反应 化合反应不一定是氧化反应
3.分解反应:由一种反应物生成两种或两种以上其他物质的反应。 “一变多”
4.氧化反应包括:燃烧和缓慢氧化
(1)燃烧:发光放热的剧烈的氧化反应
(2)缓慢氧化:进行的很缓慢甚至不容易察觉的氧化反应。
燃烧和缓慢氧化的共同点都是氧化反应,都放热。
如:动植物的呼吸、食物的腐烂、酒和醋的酿造、农家肥的腐熟、铁的生锈等
第二篇:实验室制取氧气知识点总结
实验室制取氧气
一、工业制法(分离液态空气法)
原理:利用液态氧和液态氮的沸点不同。——物理变化(蒸馏)
注意:该过程是物理变化
二、氧气的实验室制法(化学变化)
1、双氧水(过氧化氢)制取氧气
A、药品:过氧化氢(H2O2)和二氧化锰(黑色粉末 MnO2)
 B
实验原理:
B
实验原理:
 表达式:
表达式:
注:MnO2在该反应中是催化剂,起催化作用
C、装置: 固体与液体反应,不需加热
2、用高锰酸钾、氯酸钾制取氧气
A、药品:、高锰酸钾(暗紫色固体)、氯酸钾(白色固体)与二氧化锰(黑色粉末)
B、原理:
 ①加热氯酸钾(有少量的二氧化锰):
①加热氯酸钾(有少量的二氧化锰):
表达式:
注意:MnO2在该反应中是催化剂,起催化作用
②加热高锰酸钾:
表达式:
C、装置:加热固体制气体(加热氯酸钾的为一类)
D、操作步骤:(连)查、装、定、点、收、移、熄。
①连接装置:先下后上,从左到右的顺序。
②检查装置的气密性 :将导管的一端浸入水槽中,用手紧握试管外壁,若水中导管口有气泡冒出,证明装置不漏气。
③装入药品:按粉末状固体取用的方法(药匙或纸槽)
④固定装置 :固定试管时,试管口应略向下倾斜;铁夹应夹在试管的中上部
⑤加热药品:先使试管均匀受热,后在反应物部位用酒精灯外焰由前向后加热。
⑥收集气体:
a、若用排水集气法收集气体,当气泡均匀冒出时再收集,刚排出的是空气;水排完后,应用玻璃片盖住瓶口,小心地移出水槽,正放在桌面上(密度比空气大)(防止气体逸出)
判断气体收集满的标准:有气泡从水槽中集气瓶口向外冒出
b、用向上排空法。收集时导管应伸入集气瓶底部(为了排尽瓶内空气)
用排水法收集时,导管放在集气瓶口
⑦先将导管移出水面
⑧再停止加热
E、易错事项:
a). 试管口要略微向下倾斜:防止生成的水回流,使试管底部破裂。药品应平铺在试管底部
b). 导气管伸入发生装置内要稍露出橡皮塞:有利于产生的气体排出。
c). 用高锰酸钾制取氧气时,试管口塞一团棉花:防止高锰酸钾粉末进入导气管,污染制取的气体和水槽中的水。
d). 排气法收集气体时,导气管要伸入接近集气瓶底部:有利于集气瓶内空气排出,使收集的气体更纯。
e). 实验结束后,先将导气管移出水面,然后熄灭酒精灯:防止水槽中的水倒流,炸裂试管。
F、收集方法:
①排水法(不易溶于水)
②向上排空法(密度比空气大)
G、检验、验满
检验:用带火星的木条伸入集气瓶内,发现木条复燃,说明是氧气;
验满:用带火星的木条放在集气瓶口,若木条复燃,证明已满。
三、催化剂:
1、 概念:在化学反应中能改变其他物质的反应速率(加快或变慢),但本身的化学性质和质量在反应前后没有发生变化的物质。
2、 特点:两不变(质量、化学性质)、一改变(反应速率)
注意:①催化剂不能改变生成物的质量,不能决定反应的进行
②催化剂不是反应物、又不是生成物
③催化剂仅针对某一反应,并不是所有反应的催化剂
④某一反应的催化剂可能不只一种
3、二氧化锰在一些反应中不只作催化剂,催化剂不一定就只有二氧化锰。(在过氧化氢溶液制取氧气中,催化剂可以用硫酸铜溶液、氧化铁、氧化铜、红砖粉末)。
四、分解反应:
1、概念:由一种物质反应生成两种及以上物质的反应
2、特点:一变多
水的组成知识点
一:水的物理性质
1、 水是无色无味的液体。
2、 一个标准大气压下,沸点100℃,凝固点0 ℃;
3、 4 ℃时密度最大,水凝固成冰时,密度最小
二:水的电解实验
1、电解水的实验
(1).装置―――水电解器
(2).电源种类---直流电
(3).加入硫酸或氢氧化钠的目的----增强水的导电性
 (4).反应表达式:
(4).反应表达式:
H2O →H2+ O2
(5)实验现象:
①通电后,两根电极上都出现气泡
②一段时间后正负两极试管内收集的气体体积比为V正:V负=1:2
③正极产生的气体:能使带火星木条复燃
负极产生的气体:能燃烧产生淡蓝色火焰
(6)实验结论
①正极产生的气体是氧气 ,负极产生的气体是氢气。
②氢气和氧气的体积比:2:1
③水是由氢元素和氧元素组成的。
三:氢气的性质
 1、物理性质:氢气是一种无色、无味、难溶于水的气体。
1、物理性质:氢气是一种无色、无味、难溶于水的气体。
2、化学性质:可燃性
现象:火焰呈淡蓝色(在空气中燃烧)
3、氢气的验纯方法:管口朝下收集一试管氢气,用拇指堵住试管口靠近酒精灯火焰,移开拇指点火,若发出尖锐的爆鸣声则表明氢气不纯,若声音很小,则表明氢气已纯。
四、单质、化合物
1、单质:由同种元素组成的纯净物叫做单质,如氧气(O2)、氢气(H2)、氮气(N2)
条件:①同种元素②纯净物
2、化合物:由不同种元素组成的纯净物叫做化合物。如:KMnO4、MnO2等
条件:①不同种元素②纯净物
3、氧化物:由两种元素组成的化合物,其中一种是氧元素,叫做氧化物
条件:①两种元素②其中一种是氧元素③化合物
-
特殊的平行四边形知识点总结
矩形:有一个角是直角的平行四边形叫做矩形,也说是长方形矩形的性质:矩形的四个角都是直角;矩形的对角线相等矩形的对角线相等且互相平分…
-
初中数学四边形知识点总结大全
四边形知识点总结大全一基本概念:四边形,四边形的内角,四边形的外角,多边形,平行线间的距离,平行四边形,矩形,菱形,正方形,中心对…
-
新课标人教版八年级数学第十九章四边形知识点总结
新课标人教版八年级数学知识点总结第十九章四边形一、平行四边形:㈠.平行四边形定义:有两组对边分别平行的四边形叫做平行四边形。㈡.平…
-
四边形的知识点总结
(一)平行四边形的定义、性质及判定.1.两组对边平行的四边形是平行四边形.2.性质:(1)平行四边形的对边相等且平行;(2)平行四…
-
计算机二级考试C语言知识点总结
总体上必须清楚的:1)程序结构是三种:顺序结构,循环结构(三个循环结构),选择结构(if和switch)2)读程序都要从main(…
-
高一化学下册知识点总结
高一化学必修二知识点总结一、元素周期表★熟记等式:原子序数=核电荷数=质子数=核外电子数1、元素周期表的编排原则:①按照原子序数递…
-
初三化学第六章知识点总结
碳和碳的氧化物课题1金刚石、石墨和C60一、碳的几种单质(金刚石、石墨、C60)1、金刚石(C钻探机的钻头(体现了它的硬度大)等。…
-
高一化学必修二知识点总结
高一化学必修二知识点总结一.元素周期表中元素及其化合物的递变性规律1.1原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外…
-
20xx初中化学酸碱盐知识点总结(新)
20xx年初中化学酸碱盐知识点总结一物质的分类金属FeCuMgAl单质稀有气体HeNeAr固态非金属CSP非金属气态非金属HOCl…
-
高一高二化学知识点总结汇总
高一化学模块I主要知识及化学方程式一研究物质性质的方法和程序1基本方法观察法实验法分类法比较法2基本程序第三步用比较的方法对观察到…