04 片剂 保健食品企业标准范例
Q/XXXX
福建XXX有限公司企业标准
Q/XXXB—2012
XXX片
XXX - XX - XX发布 XXXX - XX - XX实施
福建XXX有限公司 发布
Q/XXXX 000XB—2012 目 次
前言 ................................................................................ II
1 范围 .............................................................................. 1
2 规范性引用文件 .................................................................... 1
3 技术要求 .......................................................................... 1
3.1
3.2
3.3
3.4
3.5
3.6
3.7
3.8
3.9 原辅料要求 .................................................................... 1 感官要求 ...................................................................... 2 保健功能 ...................................................................... 2 标志性成分或功效成分 .......................................................... 2 理化指标 ...................................................................... 2 微生物指标 .................................................................... 2 净含量及允许负偏差 ............................................................ 3 生产加工过程的卫生要求 ........................................................ 3 辐照要求 ...................................................................... 3
4 试验方法 .......................................................................... 3
4.1
4.2
4.3
4.4
4.5 感官检验 ...................................................................... 3 功效成分或标志性成分检验 ...................................................... 3 理化指标检验 .................................................................. 3 微生物指标检验 ................................................................ 4 净含量及允许负偏差检验 ........................................................ 4
5 检验规则 .......................................................................... 4
5.1
5.2
5.3
5.4
5.5 原辅料入库要求 ................................................................ 4 组批 .......................................................................... 4 抽样方法与数量 ................................................................ 5 检验类别 ...................................................................... 5 判定规则 ...................................................................... 5
6 标志、标签、包装、运输、贮藏 ...................................................... 5
6.1
6.2
6.3
6.4 标志、标签 .................................................................... 5 包装 .......................................................................... 5 运输 .......................................................................... 5 贮藏 .......................................................................... 6
附录A(规范性附录) 功效成分或标志性成分测定方法 .................................... 7
附录B(规范性附录) 原料质量要求 .................................................... 8
附录C(规范性附录) 辅料质量要求 .................................................... 9
I
Q/XXXX 000XB—2012 前 言
XXX片目前尚无国家标准和行业标准,为组织生产和交验货,特制定本标准。
本标准主要参照GB 16740-1997《保健(功能)食品通用标准》并结合本公司产品实际的特点而制定。
本标准的格式按GB/T 1.1-2009《标准化工作导则 第1部分:标准的结构和编写》组织编写。 本标准由福建XXX有限公司提出。
本标准由福建XXX有限公司起草。
本标准主要起草人:XXX 。
II
Q/XXXX 000XB—2012 XXX片
1 范围
本标准规定了XXX片的技术要求、试验方法、检验规则、标志、标签、包装、运输和贮藏。 本标准适用于以XXX为原料,经过XXX生产工艺制成的具有XXX保健功能的XXX片。
2 规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 191 包装储运图示标志
GB 4789.2 食品安全国家标准 食品微生物学检验 菌落总数测定
GB/T 4789.3-2003 食品卫生微生物学检验 大肠菌群测定
GB 4789.4 食品安全国家标准 食品微生物学检验 沙门氏菌检验
GB 4789.5 食品安全国家标准 食品微生物学检验 志贺氏菌检验
GB 4789.10 食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验
GB/T 4789.11 食品卫生微生物学检验 溶血性链球菌检验
GB 4789.15 食品安全国家标准 食品微生物学检验 霉菌和酵母计数
GB 5009.3 食品安全国家标准 食品中水分的测定
GB 5009.4 食品安全国家标准 食品中灰分的测定
GB 5009.5 食品安全国家标准 食品中蛋白质的测定(根据实际检测需要列出)
GB/T 5009.11 食品中总砷及无机砷的测定
GB 5009.12 食品安全国家标准 食品中铅的测定
GB/T 5009.19 食品中有机氯农药多组分残留量的测定
GB/T 6543 运输包装用单瓦楞纸箱和双瓦楞纸箱
GB 7718 食品安全国家标准 预包装食品标签通则
GB 16740 保健(功能)食品通用标准
GB 17405 保健食品良好生产规范
GB XX
JJF 1070 定型包装商品净含量计量检验规则
中华人民共和国药典20xx年版一部、二部
3 技术要求
3.1 原辅料要求
3.1.1 XX:应符合附录B(或中华人民共和国药典2010版一部)的规定。
1
Q/XXXX 000XB—2012
3.1.2 XX、XX、XX:应符合GB XXX(或中华人民共和国药典2010版X部)的规定。
3.1.3 XX:XX、XX:应符合附录C规定。(如辅料品种崩解剂、矫味剂、着色剂等无国标、行标或地标,须在附录C作出规定) 3.2 感官要求
感官要求应符合表1 规定。
表1 感官要求
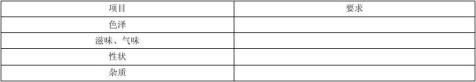
3.3 保健功能
本品具有XXXXXX的保健功能。 3.4 标志性成分或功效成分
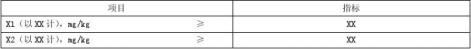
标志性成分或功效成分应符合表2规定。
表2 标志性成分或功效成分及含量
2、计量单位应与保健食品批准证书附件质量标准(主要内容)中规定的一致。
3.5 理化指标
理化指标应符合表 3 的规定。
表1 理化指标
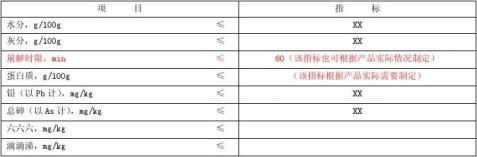
注:含片、咀嚼片崩解时限不需列入,以中药为原料六六六、滴滴涕须列入。
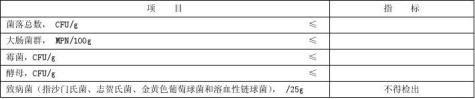
3.6 微生物指标
2
Q/XXXX 000XB—2012
微生物指标应符合表4规定。
表4 微生物指标

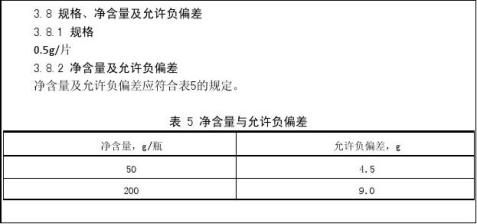
3.7 净含量及允许负偏差
净含量及允许负偏差应符合表5的规定。
表5 净含量及允许负偏差
3.8 生产加工过程的卫生要求
应符合GB 17405的规定。
3.9 辐照要求
如有辐照工艺,须提供放射源及吸收剂量。
4 试验方法
4.1 感官检验
4.1.1 色泽、性状、杂质
取样品内容物X g~X g倒入洁净的白色搪瓷盘中,在亮处用肉眼观察其色泽、组织形态及有无可 见外来杂质。
4.1.2 滋气味
被测定样品倒入洁净的瓷盘中,品尝其滋味,嗅其气味,检查有无异味。
4.2 功效成分或标志性成分检验
按本标准附录A规定执行。
4.3 理化指标检验
4.3.1 水分
按GB 5009.3规定执行。
3
Q/XXXX 000XB—2012
4.3.2 灰分
按GB 5009.4 规定执行。
4.3.3 崩解时限
按中华人民共和国药典20xx年版一部附录XII A “崩解时限检查法”执行。
4.3.4 蛋白质
按GB 5009.5规定执行。
4.3.5 铅
按GB 5009.12规定执行。
4.3.6 总砷
按GB/T 5009.11规定执行。
4.3.7 六六六、滴滴涕
按GB/T 5009.19规定执行。
4.4 微生物指标检验
4.4.1 菌落总数
按GB 4789.2规定执行。
4.4.2 大肠菌群
按GB/T 4789.3-2003规定执行。
4.4.3 霉菌和酵母
按GB 4789.15规定执行。
4.4.4 致病菌(指沙门氏菌、志贺氏菌、金黄色葡萄球菌、溶血性链球菌)
按GB 4789.4、GB 4789. 5、GB 4789.10、GB/T 4789.11规定执行。
4.5 净含量及允许负偏差检验
按JJF 1070规定检验。
5 检验规则
5.1 原辅料入库要求
原辅料需按各自相关质量标准检验合格后,方可入库。
5.2 组批
4
Q/XXXX 000XB—2012
压片前使用同一台混合设备一次混合量所生产的均质产品为一批。
5.3 抽样方法与数量
XXX,抽样数量不得少于产品检验用量的3倍。
5.4 检验类别
分出厂检验与型式检验。
5.4.1 出厂检验
5.4.1.1 产品出厂前须经质量检验部门检验合格并签发合格证书后,方可出厂。
5.4.1.2 出厂检验项目为感官要求、净含量、标志性成分或功效成分、水分、灰分、崩解时限、菌落总数、大肠菌群。
5.4.2 型式检验
5.4.2.1 型式检验项目包括该标准技术要求中所有项目。
5.4.2.2 型式检验正常生产情况下每半年进行一次,发生下列情况之一亦应进行:
a) 产品投产时;
b) 停产3个月以上,恢复生产时;
c) 原料来源发生变化或主要设备发生改变,可能影响产品质量时;
d) 出厂检验与上次型式检验结果有较大差异时;
e) 国家有关质量监督部门要求时。
5.5 判定规则
5.5.1 全部检测项目经检验合格的产品为合格品。
5.5.2 微生物指标检测不符合本标准时,则判定该批产品不合格。
5.5.3 如果其他指标检测不符合本标准时,可重新抽取双倍样品,对不合格项进行复检。复检结果仍有一项指标不符合规定时,则判定该批产品不合格。
6 标志、标签、包装、运输、贮藏
6.1 标志、标签
产品包装物上的标签、标示应符合GB 7718及GB 16740规定。包装储运图示标志应符合GB/T 191的规定。
6.2 包装
6.2.1 产品包装规格????。
6.2.2 产品内包装用某某包装,应符合某某包装材料的要求,封口严密,不漏气。
6.2.3 产品外包装用瓦楞纸箱,应符合GB/T 6543的要求,封口胶带粘贴牢固、平整,并保证箱内产品完好。
6.3 运输
运输工具应清洁卫生,不得与有毒、有害、有异味的物品混装、混运,防止日晒雨淋及撞击,小心
5
Q/XXXX 000XB—2012
轻放,不得压踏。
6.4 贮藏
6.4.1 产品应放于通风干燥的仓库内,严禁与有毒、有害有异味、影响产品质量的物品混放。应距离周围墙壁20cm以上,距离地面10cm以上。
6.4.2 产品在符合本标准6.3、6.4规定的条件下,保质期为24个月。
6
Q/XXXX 000XB—2012
附 录 A
(规范性附录)
功效成分或标志性成分测定方法
注:未制定国标、行标、地标的功效成分或标志性成分测定方法列入附录A。
7
Q/XXXX 000XB—2012
附 录 B
(规范性附录)
原料质量要求
注:未制定国标、行标、地标的原料质量要求列入附录B。
附 录 C
(规范性附录)
辅料质量要求
注:未制定国标、行标、地标的辅料质量要求列入附录C。
8
Q/XXXX 000XB—2012
_________________________________
9
第二篇:北京市保健食品企业标准编写指南(试行)
北京市保健食品企业标准编写指南(试行)
一、保健食品企业标准的基本要求
1.1 法律、行政法规、部门规章、技术标准和规范性文件
保健食品企业标准编制工作应符合以下法律、行政法规、部门规章、技术标准和规范性文件的相关规定:
a) 《中华人民共和国食品安全法》及实施条例
b) 《北京市保健食品企业标准备案办法(试行)》
c) GB/T1.1《标准化工作导则 第一部分:标准的结构和编写规则》
d) GB 16740《保健(功能)食品通用标准》
e) DB11/T1000.1《企业产品标准编写指南 第1部分:标准的结构和通用内容的编写》 f) 其他保健食品法律、行政法规、部门规章、技术标准和规范性文件
1.2 一般要求
a) 保健食品企业标准的文字、数字、公式、单位、符号、图表等应符合GB/T1.1及DB11/T1000.1的要求,引用的标准准确、有效。术语的定义应符合国家有关规定。
b) 保健食品企业标准可能涉及知识产权的,北京市药品监督管理部门不承担识别该知识产权的责任。
c) 本文中助动词“应”表示硬性要求。
二、标准正文的内容及要求
标准正文的内容分为应包括的内容和可选择的内容两部分。其中应包括的内容是保健食品标准必须编写的内容,可选择的内容可根据产品标准中涉及的具体内容增删。
a) 应包括的内容
封面、前言、标准名称、范围、技术要求、试验方法、检验规则(包括:抽样和判定原则)、标志、标签、包装、运输、贮存、保质期等。
b) 可选择的内容
目次、引言、规范性引用文件、术语和定义、产品分类、规范性附录、资料性附录、参考文献和索引等。
标准正文的编写应以“范围”作为第1章,“标志、标签、包装、运输、贮存和保质期”可作为1章。
2.1 封面
保健食品企业标准封面的内容及格式应符合GB/T1.1及DB11/T1000.1的要求。其中标准标志、标准编号、中国标准文献分类号及标准名称按照本指南要求编写。
2.1.1 标准标志
在封面的右上角标注企业产品标准的标志。以“Q/”或“Q/企业代号”表示。企业代号由企业确定,由拼音字母或阿拉伯数字或两者兼用组成。一般以企业名称的汉语拼音或英文缩写的五个字
1
母或字母数字兼用表示。
2.1.2 标准编号
在标准封面中标准类别的右下方为标准编号,标准编号以“ Q/企业代号四位顺序号J—四位年代号”表示。
如果有标准重新修订或改版时,需要标注被代替标准的编号,被代替标准的编号,应在标准编号之下另起一行。“代替”两字之后接排代替标准的标准编号,标准编号和代替标准编号右端对齐。
2.1.3 中国标准文献分类号
按照《中国标准文献分类法》的规定,保健食品标准文献分类号应统一为X83。
2.1.4 标准名称
保健食品企业标准名称应置于正文首页和标准的封面,并与国家有关部门批准的产品名称一致。 本指南中国家有关部门指原卫生部、原国家食品药品监督管理局和国家食品药品监督管理总局。
2.2 目次、前言
目次所列的内容和顺序及前言的内容及格式应符合GB/T 1.1及DB11/T 1000.1的要求,前言应尽量简明。
2.3 范围
范围项应包括产品的全部原辅料、主要工艺步骤、产品名称等内容。
范围可用下列典型的表述形式进行表述:

2.4 规范性引用文件
应列举企业标准中执行的所有标准,并有GB/T 1.1规定的导语。规范性引用文件应按下列顺序排列:国家标准、行业标准、地方标准、国内有关文件、国际标准以及国际有关文件。引用文件编号按下列原则排序:国家标准、国际标准按标准顺序号从小到大排列。
规范性引用文件可使用下列典型的表述形式:
2
2.5 技术要求
技术要求应包括原辅料要求、感官指标、保健功能、鉴别、理化指标、微生物指标、功效成分或标志性成分指标、规格、净含量及允许负偏差等项目,每个项目作为一条编写并应与国家有关部门批准的相应内容一致。
原辅料要求项、鉴别项、规格、净含量及允许负偏差项应按照本指南要求编写。
2.5.1 原辅料要求
原、辅料要求应符合相应国家标准、行业标准的规定或有关要求,未制定国家标准、行业标准的应分别在附录B、C中给出相关质量标准。
2.5.2 鉴别
应与原国家食品药品监督管理局或国家食品药品监督管理总局批准的技术要求中的鉴别项一致;批准的技术要求中没有鉴别项的、鉴别项内容为“无”的及原由卫生部批准的,不编写此条。
2.5.3规格、净含量及允许负偏差
备案申请人应按照《保健(功能)食品通用标准》(GB16740-1997)及《定量包装商品计量监督管理办法》(国家质检总局[2005]第75号令)的规定,标示产品的规格,并规定产品净含量及允许负偏差,净含量的单位可标示为g/盒、mL/盒、g/袋等。
可使用下列典型的表述形式:
也可使用下列典型的表述形式: 3

为保证产品质量,鼓励制定允许正偏差。 2.6 试验方法
试验方法应包括质量标准中感官指标、功效成分或标志性成分、理化指标、微生物指标、净含量及允许负偏差的检测方法,检测方法须注明其名称及编号。其中,功效成分或标志性成分的检测方法,应列出该方法执行的国家标准、行业标准,未制定国家标准、行业标准的在附录A中编写详细内容。所列检测方法均应与国家有关部门批准的相应内容一致。
可使用下列典型的表述形式:
2.7 检验规则
检验规则应至少包括:检验分类及每类检验所包含的试验项目,组批规则,抽样方法,判定规则等。
应与申报保健食品批准证书时提供的检验规则相符,鼓励制定更严格的检验规则。
2.7.1 检验分类
2.7.1.1 原辅料入库检验
应逐批次对原料进行鉴别和质量检查,不合格者不得使用。
2.7.1.2 出厂检验
规定出厂检验的项目,应包括直接影响产品安全和功能的指标,如感官指标、理化指标、微生物指标、功效成分指标等。
2.7.1.3 型式检验
规定型式检验的项目,应包括技术要求中的全部项目,对产品质量进行全面考核。
可参照下列情况,规定进行型式检验:
a) 新产品试制鉴定时;
b) 产品长期停产后,恢复生产时;
c) 出厂检验结果与上次型式检验有较大差异时;
d) 食品安全有关部门提出进行型式检验的要求时;
e) 正常生产时,定期或积累一定产量后,也应规定周期检验的期限;
f) 原辅料来源发生改变时。
4


2.7.2组批规则
组批应根据生产班次、作业线、产量或批量大小确定。抽样方案应能保证样品与总体的一致性。
2.7.3 抽样方法
应根据产品特点规定抽样方案,包括抽样地点、环境要求、抽样保存条件等。
2.7.4 判定规则
对每一类检验均应规定判定规则,即判定产品合格、不合格的规则;并规定由于检验、试样误差需要进行复验的规则。其中,微生物指标有一项不符合企业标准时,判为不合格产品,不得复检。
2.8 标签、标志、包装、运输、贮存和保质期
应符合国家现行规定并与申报保健食品批准证书时提供的相应内容一致。
2.8.1 标签
保健食品标签的标注内容应符合GB7718、GB 16740及《保健食品标识规定》等有关规定,包含国家有关部门审批的标签内容项目。
2.8.2 标志
保健食品运输包装上应有标志。标志的基本内容除参考标签主要内容外,还应符合GB/T 191等有关标准的规定。
2.8.3 包装
包装条款的基本内容一般包括:
a) 包装环境,可对包装环境的卫生条件、安全防护措施及温度、相对湿度作出规定;
b) 包装材料,包装材料有现行标准时,应直接引用,无现行标准时,应规定可用材料的基本
要求;
c) 包装容器,可规定包装容器的类型、规格尺寸、外观要求、物理和化学性能等;
d) 包装要求,可规定包装规格、包装程序及关键程序的注意事项、封箱与封口要求、捆扎要
求等。
2.8.4 运输
应根据保健食品的特点规定运输要求,一般包括:
a) 运输方式,指明运输工具等;
b) 运输条件,指明运输时的要求,如遮篷、密封、温度、通风、制冷等;
c) 运输注意事项,指明装、卸、运的特殊要求以及某些保健食品的保鲜措施、防污染措施等。
2.8.5 贮存
应根据保健食品的特点规定贮存要求,一般包括:
a) 贮存场所,指明库房、遮篷冷藏、冻藏等;
b) 贮存条件,指明温度、湿度、通风、气调,对有害因素的防护措施等;
5
c) 贮存方式,指明堆码方式、堆码高度、垛垫要求等;
d) 贮存期限,可指明与a~c项要求相适应的库存期限;
e) 应根据稳定性考察研究的结果阐述产品贮存条件。
2.8.6 保质期
保质期的格式应标注为:XX个月。
2.9 其他
与保健食品有关的其他技术内容也可以根据制定标准的目的或标准的特点合理纳入。如,为了使产品达到技术要求而必须限定卫生规程时,可以引用现行卫生规范或工艺规程。
建议采用下列典型用语:

2.10 附录
附录应至少包括国家有关部门批准的内容,并可根据实际需要增加。
附录应包括附录A、附录B、附录C等,其中附录A所列内容为未制定国家标准、行业标准的功效成分或标志性成分的检测方法。附录B、附录C所列内容为未制定国家标准、行业标准的原、辅料质量标准。
对于未制定国家标准、行业标准的功效成分或标志性成分的检测方法,须列出其详细内容;对于未制定国家标准、行业标准的原、辅料,其质量标准中应包括反映原、辅料特征的指标(如主要成分及含量、色泽、性状、滋味、气味等)、理化指标(如水分、灰分、粒度等)及污染物指标(如铅、砷、汞、六六六、滴滴涕、微生物指标等),并列表表示。
2.11终止线
标准文本所有内容后,应有终止线。
6
-
20xx年食品企业标准模板
QXXXX食品名称20xx发布20xx实施QXXXX0001S20XX目次前言I1范围12规范性引用文件13技术要求14食品添加剂…
-
食品生产企业标准范本
备案号36S20xxQXXX业名称企业标准QXXXXXXXS20xx代替QXXXXXXXXXX生产企标准名称20xxXXXX发布2…
-
浙江省食品企业标准模板
备案号有效期至Q食品名称企业名称发布前言前言部分应视你公司的具体情况给出下列信息说明你的产品与对应的国家行业标准或其他文件的一致性…
-
茶剂 保健食品企业标准范例
QXXXXXXX有限公司企业标准QXXXX000XB20xx福建XXX茶XXXXXXXX发布XXXXXXXX实施福建XXX有限公司…
-
企业标准范本
XQ标准名称企业名称发布Q00S20前言前言部分应视你公司的具体情况给出下列信息本标准的编写格式符合GBT1120xx标准化工作导…
-
茶剂 保健食品企业标准范例
QXXXXXXX有限公司企业标准QXXXX000XB20xx福建XXX茶XXXXXXXX发布XXXXXXXX实施福建XXX有限公司…
-
02 胶囊剂 保健食品企业标准范例
QXXXX企业标准Q000XB20xxXXX胶囊XXXXXXXX发布XXXXXXXX实施福建XXX有限公司发布QXXXX000XB…
-
食品生产企业标准范本
备案号36S20xxQXXX业名称企业标准QXXXXXXXS20xx代替QXXXXXXXXXX生产企标准名称20xxXXXX发布2…
-
企业标准范文
ICS备案号QGYJQ牛腩萝卜罐头广东鹰金钱企业集团公司发布QGYJQ05S20xx前言本标准按GBT1120xx标准化工作导则第…
- 食品安全企业标准编制说明Microsoft Office Word 文档
-
企业大型画册项目可行性研究报告评审方案设计(20xx年发改委标准案例范文)
企业大型画册项目可行性研究报告评审方案设计20xx年发改委标准案例范文编制机构博思远略咨询公司360投资情报研究中心研究思路关键词…