化学文献综述格式
文 献 综 述
(文献综述题目)
学生姓名 王小丽 学 号 院 系 专 业 完成日期
羧甲基纤维素-粘土及其
在控制农药污染上的用途
摘 要
综述了羧甲基纤维素,粘土的性质、用途及羧甲基纤维素-粘土在控制农药污染方面的应用。
关键词 农药污染;羧甲基纤维素;粘土
农药的广泛使用在保证农业高产稳产的同时也带来了一系列的环境问题,影响人们的正常生活,因此如何控制农药污染显得尤为重要。羧甲基纤维素(CMC)是一种电解质聚合物,具有诸多优良特性;而粘土对于农药控释技术很有应用价值,本文讨论新型复合材料羧甲基纤维素-粘土以及其在控制农药污染上的应用。
1 农药污染
1.1 农药的类型及用途
农药是农、林、牧业有害生物的克星, 在防治有害生物和保障农林业生产增长方面起着重要作用。同时,农药是毒性高、环境释放率大、影响面广的有机污染物,在保护农作物免受病虫草危害的同时也污染环境和农产品[1]。为了研究和使用上的方便,常常从不同角度把农药进行分类。其分类的方式较多,可以分为离子型农药和非离子型农药。部分农药为弱酸性,在土壤中能以阴离子形式存在。实际应用中,应用品种、数量最多的则是非离子型农药,如有机氯、有机磷和氨基甲酸酯等类农药[2]。
.
.
7 结束语(或小结)
农药的应用对人类社会的进步和生产力的发展起了巨大的促进作用,却不可
避免对周围环境造成污染。利用羧甲基纤维素及粘土在控制药物释放的特性,研究羧甲基纤维素-粘土复合材料作为农药缓释剂控制农药污染是非常有实际意义的。一旦这方面技术有所突破,必将引起农药应用技术的重大变革,使其向着高效安全、环境友好的方向发展。
参考文献:
第二篇:化学文献综述
手型金属络合物的合成及应用
姓名:杨小玲 1学号:2009296094专业:化学
(山西大学化学化工学院)
摘要:随着化学化工的发展,人们已将重点转向如何更有效地模拟自然,高选择性地合成自然界中存在的那些具有特殊活性的物质,设计并合成具有新的特殊活性的物质。其中一个极为重要的和富有活力的领域就是手性物质的合成,简称手性合成。随着手性合成研究的深入,新型的高效手性催化剂层出不穷。本文旨在就其中一种催化剂即手性金属络合物催化剂的制备和应用做一介绍。所谓手性即立体异构形式,具有手性的两个分子的结构彼此间的关系如同镜像和实物或左手和右手间的关系,相似但不叠合。 关键词:手性 金属络合物 催化剂
Synthesis and application of chiral metal complexes
Name: Xiaoling yang Number: 2009296094 Professional : Chemical
(Chemistry and Chemical Engineering , Shanxi University)
Abstract
Along with the development of chemical industry, people already will focus on how to more effectively simulate natural, high selectivity synthesis exist in nature that have special active substances, design and synthesis of new special activity of the material. One of them is very important and dynamic area is the synthesis of chiral material, hereinafter referred to as chiral synthesis. With the deepening of the research chiral synthesis, new high-efficiency chiral catalysts are endless. This paper aimed at one of the catalyst that chiral metal complex catalyst preparation and application of this paper. The so-called hand nature is stereo heterogeneous form, with two of the chiral molecule structure relation to each other as a mirror and material or left and right hand, the relation between similar but not composite.
Keywords: chiral Metal complex catalyst
前言
手性金属络合物的发现和认识对早期配位化学理论的建立起了积极的作用它在生物无机化学, 不对称催化剂, 超分子化学等化学分支学科中都具有重要的应用已知在一些重要体系中精确的分子识别和严格的结构匹配都与手性密切相关。近年来, 随着在国际范围内对有机化学新反应、新试剂需求量的急剧增长, 使金属有机化合物的合成成为世界各国有机合成和催化学家关注的焦点, 其中对含不饱和键的金属有机化合物的研究尤为引人注意. 特别是自20 世纪90 年代以来, 合成了许多高活性、高选择性金属络合物催化剂,并被广泛地用于催化有机化学反应. 有的立体选择性反应甚至达到几乎定量的结果, 展现了它们在医药、生物及化工等领域的广阔的应用前景, 从而成为金属有机化学的前沿研究课题. 随着对手性金属络合物的深入研究除了配体和中心金属离子的合理选择外其它如溶剂效应,氢键效应配体间非共价键作用等因素对立体选择性也有重要的影响。
1手性金属络合手物的立体选择性合成 (1-7)
1.1立体性选择合成手性金属络合物催化剂
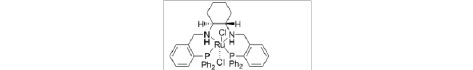
采用立体选择性合成的方法制备特定手性构型的金属络合物在不对称催化领域中由于在催化前手性底物形成手性产物的过程中手性诱导剂和底物之间的距离可能是重要的影响因素此距离越近则手性转移和光学诱导越容易进行 而当中心金属作为手性诱导中心时与配位底物之间的距离可能最近。例如Brookhart等曾经报道一对非对映异构的半夹心型手性h5-茂铁络合物18 和19[46] 其差异仅在于中心金属Fe 的构型当它们分别作为不对称环丙烷化的催化剂时亚乙基从每个络合物有效地转移至苯乙烯可得到高对映体过量手性相反的顺式和反式1-甲基-2-苯基环丙烷20~23(图5) 说明中心金属的手性确实在不对称诱导中起作用但是18 和19 并不是通过立体选择性合成而是通
过柱色谱分离非对映异构体混合物获得的。
2手性席夫碱及其金属配合物作为手性催化剂的某些应用(8-22)
2.1 对不称氢转移反应
合成手性仲醇, 是近几年研究的热点之一. 含N, P,O 等杂原子的Schiff 碱与铑(I)或(II)、钌(I)或(II)、铱(I)等金属的配合物作为氢转移反应的催化剂显示出良好的性能[14]. Noyori 等利用邻(二苯磷基)苯甲醛分别与(1R,2R)-己二胺、(1S,2S)-己二胺形成的Schiff 碱作为四齿配体, 再分别与(trans)-RuCl2(DMSO)4 回流, 得到钌(II)的配合物8 及其对映体9; (1S,2S)-己二胺的Schiff碱再用硼氢化钠还原得到了其二氢化后的胺磷与钌(II)的配合物10, 并且制得它们的单晶. 把它们用于催化苯乙酮及取代苯乙酮与异丙醇的不对称氢转移还原为手性醇的反应, Schiff 碱配合物作催化剂, 产物的光学产
率与化学产率都很低; 但配合物10作催化剂, 产物化学产率达67%~99%, ee值达58%~97% 。


3.手性富勒烯金属络合物研究 3.1非金属手性富勒烯衍生物的研究简介
自从发现富勒烯以来,化学家们已经预测到一些高碳数富勒烯和碳纳米管具有手性。Vasella等[17]最先报道了手性中心在R*基团上的C60-R*单取代衍生物(R*为葡萄糖的衍生物),并且测定了它的CD光谱。Wilson等[18 a]首次成功地在手性HPLC柱上直接拆分手性C60衍生物。Wilson等认为手性非金属C60衍生物主要有两类。第一类是手性中心在R*基团上的C60-R*, 在这一类型中, C60仅仅是作为一个取代基; 第二种类型是两个基团不对称地连接在C60的碳笼上。他们对非金属手性富勒烯衍生物绝对构型的指定提出了一个象限规则
3.2第一、二类手性富勒烯金属络合物
Hawkins的动力学拆分方法的设计构思则来自于之前他对C60[OsO4(py)2]2的五个"区域"异构体的其中两个具
[19]有C2对称性的外消旋体(II和III)的拆分(它们可能是首次获得的手性富勒烯金属络合物,属于第二类)。
Hawkins等用HPLC的手性固定相色谱柱(Pirkle柱)部分拆分了两对对映体(II和III,图3),测定了它们的CD
**光谱。在反应过程中,同样采用了手性的生物碱酯类配体L,他们考察了不同L的作用,认为C60
的双锇氧化加成
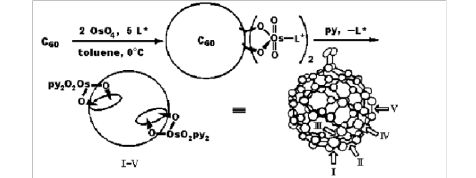
的区域选择性和立体选择性与金属锇直接相连的手性配体有关,其中一个手性异构体(+)-III的旋光值[a]436达到
o+3700。他们还指出为满足反应剂分子的p体系与富勒烯表面的最佳电子相互作用而设计的反应试剂可能实现富勒烯化学中完全的立体和区域控制。为此奠定了用不对称锇氧化加成动力学拆分手性高碳数富勒烯C76, C78,C84的基础。
3.3 第三类手性富勒烯金属络合物
[20]** 第三类手性富勒烯金属络合物是Yamago等报道的PtCl2(L)2,其中L是含有手性膦取代基的富勒烯衍生物
*配体。他们用循环伏安法研究了PtCl2(L)2的氧化还原性质。这类金属络合物之所以令人感兴趣,不仅在于它可
以作为多重氧化还原的催化剂,而且可以作为带有“推”(膦)和“拉”(C60)双重功能的双齿“金属配体”。对它们进行适当修饰,可以为不对称合成设计新的手性催化剂。
DABCO = 1,4-重氮二环 [2,2,2]辛烷
4 结 论
综上所述近年来手性金属络合物的合成及应用研究取得了可喜的进展,更多的新型手性配体的涌现和稳定的手性金属络合物(包括手性配位聚合物和超分子化合物)合成将极大地丰富配位化学的研究内容同时将为21 世纪生命科学和材料科学的发展提供具有实际应用价值的新化合物和带来不可估量的影响
参考文献
[1] A von Zelewsky. Coor. Chem. Rev., 1999, 190~192: 811~825.
[2] U Knof, A von Zelewsky. Angew. Chem. Int. Ed., 1999, 38: 302~322.
[3] A von Zelewsky, O Mamula. J. Chem. Soc., Dalton Trans., 2000: 219~231.
[4] A von Zelewsky. Stereochemistry of coordination compounds, Wiley, N.Y., 1996: 101~105, 119~ 167.
[5] H Okawa. Coord. Chem. Rev., 1988, 92: 1~28.
[6] F S Richardson. Chem. Rev., 1979, 79: 17~ 36.
[7] 金斗满, 朱文祥编著. 配位化学研究方法. 北京:科学出版社, 1996: 268~271.
[8]Yu, C. Y.; Cohn, O. M. Tetrahedron Lett. 1999, 40, 6665.
[9] Sun, W.; Xia, C. G.; Zhao, P. Q. The Third Conference forWorld-wide Chinese Young Chemists, Xiamen, 2000, p. 433.
[10] Sun, W.; Chen, M. D.; Xia, G. C. J. Mol. Catal. 2002, 16(2),541 (in Chinese).(孙玮, 陈敏东, 夏春谷, 分子催化, 2002, 16(2), 541.)
[11]Sun, W.; Xia, G. C.; Zhao, B. Q. Acta Chim. Sinica 2001,59(6), 976 (in Chinese).(孙伟, 夏春谷, 赵培庆, 化学学报, 2001, 59(6), 976.)
[15]Takaya, H.; Ohta, T.; Noyori, R. Asymmetric Hydrogenatio in Catalytic Asymmetric Synthesis, Weinheim, 1993, p. 20.
[16] Gao, J. X.; Ikariya, T.; Noyori, R. Organometallics 1996, 15(4), 1087.
[17] Flores-López, C. Z.; Flores-López, L. Z.; Aguirre, G.; Hellberg,L. H.; Parra-Hake M.; Somanathan, R. J. Mol. Catal.A: Chem. 2004, 215(1~
2), 73.
[18] Zi, G. F.; Yin, C. L. Chin. Chem. Soc. 1997, (7), 39 (in Chinese).(自国甫, 尹承烈, 化学通报, 1997, (7), 39.)
[19] Zhan, J. L.; Dong, C. E.; Zhi, Y. G.; Han, J.; Zheng, W. Z.; Zhang, L. F. Chin. J. Org. Chem. 2000, 20(5), 754 (in Chinese). (张俊龙, 董春娥, 支永刚, 韩杰, 郑维忠, 张良辅, 有机化学, 2000, 20(5), 754.)
[20] Dai, H. C.; Hu, X. P.; Chen, H. L.; Bai, C. M.; Zheng, Z.Tetrahedron: Asymmetry 2003, 14, 1467.
[21]Trifonova, K. E.; Kallstro, M.; Andersson, P. G. Tetrahedron 2004, 60, 3393.
[22 ]Himeda, Y.; Komatsuzaki, N. O.; Sugihara, H.; Arakawa, H.; Kasuga, K. J. Mol. Catal. A: Chem. 2003, 195, 95.
[23] Hawkins J M, Lewis T A, Loren S D et al. Organic Chemistry of (Buckminsterfullerene): Chromatography and Osmylation. J. Org. Chem., 1990, 55: 6250~6252
[24] Hawkins J M, Meyer A, Lewis T A et al. Crystal Structure of Osmylated: Confirmation of the Soccer Ball Frame-work. Science, 1991, 252: 312~313
[25] Balch A L, Catalano V J, Lee J W et al. (h-C70)Ir(CO)Cl(PPh3)2: The Synthesis and Structure of an Organometallic Dedrivative of a Higher Fullerene. J. Am. Chem. Soc., 1991, 113: 8953~8955
[26] Hawkins J M, Meyer A. Optically Active Carbon: Kinetic Resolution of C76 by Asymmetric Osmylation. Science, 1993, 260: 1918~1920
[27] 林永生, 吴振奕, 詹梦熊等. 球烯配合物的研究进展. 化学通报, 1996, (9):5~9
[28] (a) 陈健, 黄祖恩, 蔡瑞芳. C60-钯(0)金属有机化合物的合成. 科学通报, 1994, (7): 671; (b) 林永生, 庄焱, 吴振奕等.
[29]M Zieler, V Monney, H Stoecki-Evans et al. J. Chem. Soc., Dalton Trans., 1999: 667~675.
[30]M Shibasaki, N Yoshikawa. Chem. Rev., 2002,
[31] Prato M. [C60] Fullerene chemistry for materials science applications. J. Mater. Chem., 1997, 7(7): 1097~

1109 2
[32](a) Linssen T G, Durr K, Hanack M et al. A Green Fullerene: Synthesis and Electrochemistry of a Diels-Alder Adduct of [C60]. J. Chem. Soc. Chem. Commun., 1995: 103~104; (b) Imahori H, Hagiwara K, Akiyama T et al. Synthesis of Photophysical of Porphyrin-linked Fullerene. Chem. Lett., [29] (a) Sawamura M, Iikura H, Nakamura E. The First Chem., 1996, 100: 15926~15932
[33] Pioda, G.; Togni, A. Tetrahedron: Asymmetry 1998, 9, 543
[34] R R Fenton, F S Stephens, R S Vagg et al. Inorg. Chim. Acta, 1991, 182: 67~75.
[35] R R Fenton, S F S tephens, R S Vagg et al. Inorg. Chim. Acta, 1992, 201: 157~164.
[36] K Bernauer, P Pousaz, J Porret et al. Helv. Chim. Acta, 1988, 71: 1339~1348.
[37] K Bernauer, P Pousaz. Helv. Chim. Acta, 1984, 67: 796~803.
[38] K Bernauer, H Stoeckli-Evans, D Hugi-Cleary et al. Helv. Chim. Acta, 1992, 75: 2327~2339.
[39] K Bernauer, E Fuchs, D Hugi-Cleary. Inorg. Chim. Acta, 1994, 218: 73~79.
[40] K Bernauer, S Ghizdavu, L Verardo. Coor. Chem. Rev., 1999, 190~192: 357~369.
-
文献综述资料及范文
资料一一什么是文献综述是对某一方面的专题搜集大量的情报资料后经综合分析而写成的一种学术论文它是科学文献的一种文献综述往往反映的是当…
-
外国文学文献综述范文
一关于荷马伊利亚特的研究综述研究综述伊利亚特又名伊利昂记相传在公元前9世纪由行吟诗人荷马编订成口头史诗因此它通常和奥德塞一起被称为…
-
文学论文的文献综述
文献综述理智与情感中的婚姻观与人性摘要本文结合了情感与理智中两姐妹的经历以及奥斯丁本人的婚姻观分析了婚姻中金钱和门当户对的重要性并…
-
文献综述范文
武汉工程大学邮电与信息工程学院文献综述从教师角度看小学英语课堂教学有效性的提高学生姓名学号专业班级成绩从教师角度看小学英语课堂教学…
-
文献综述范文
文献综述范文中国农村学前教育问题文献综述作者单位内容提要关键词学前教育是指对尚未进入小学学习的儿童以科学的方法开发其智力的一种系统…
-
自然科学类论文综述《应用化学》
应用化学金属碱基对能增强DNA导电性20xx0920105359来源应用化学导读20xx年北大化学院郭雪峰课题组在单分子生物传感研…
-
文献综述格式说明--北京化工大学版
北京化工大学本科毕业设计论文文献综述学号北京化工大学毕业设计论文文献综述论文题目学院名称专业学生姓名导师姓名北京化工大学本科毕业设…
-
文献综述范文[1]
光化学烟雾的形成机制危害和防控措施研究综述摘要伴随我国经济的持续高速发展燃料的消耗量逐年增长大气中一氧化碳氮氧化物及碳氢化物等污染…
-
化工大学范例——文献综述
北京化工大学北方学院毕业设计论文文献综述文献综述前言作为物流管理专业的一名学生我发现企业关键绩效指标考核体系已经被越来越多的企业重…
-
化工类毕业论文开题报告模板(含论文综述)
南华大学化学化工学院毕业设计南华大学本科生毕业设计(论文)开题报告综述一、邻苯二酚1、邻苯二酚的性质及用途邻苯二酚,又名儿茶酚,分…
-
文献综述范文
宁德师范学院文献检索与科技论文写作年级专业学生学号题目20xx年6月20日文献综述含NS的杂环化合物的研究进展宁德师范学院化学系2…