训练计划的制定
第十四次课 训练计划地制定
如果你刚开始健美训练,那就应立即制订一个完全符合你的身体特点、工作性质和时间安排的训练计划。
制订训练计划应遵循以下要点。
一、简单至上
每个训练者刚开始时都想找到能令肌肉快速发达的训练秘诀,所以把明星的训练方法奉为至宝。但明星的训练方法大多都相当复杂,包含很多孤立练习,有些还是自创的动作,技术性很强,强度也很大。所以,明星们的训练方法并非初练者要寻找的秘诀。如果说健美训
练有什么秘诀的话,那就是科学——训练的科学。对初练者而言,训练的科学就是简单的、基本的复合性训练,如卧推、深蹲、硬拉等等。尽管这些简单的动作很乏味,但效果却不容置疑。几乎每个冠军都是靠复合性训练获得了“超级大块”。八届奥林匹亚先生获得者李·哈尼在夺得全美冠军后才开始分部训练,在此之前他的训练计划中差不多全部是复合性练习。
把基本的复合性训练列为“主菜”,目的是增强基本素质,练出大肌肉块,为将来的“精雕细琢”打下坚实基础。
二、目标明确
你的训练计划最好用大纸、大字列出来,训练目标应用红笔写在最醒目的位置。它越明确越好,比如“我要练出 60厘米围度的大腿!“或“体重 70公斤十8块腹肌!”当你对枯燥的训练感到厌烦时,当你想偷懒时,那些醒目的字会深深地刺激你,让你为自己的惰性感到无地自容。
三、持续性和渐进性
持续性和渐进性是制订训练计划的的两个重要原则。不坚持训练,肌肉就得不到持续的、有规律的刺激,以致生长迟缓;训练强度不增加,肌肉对所给予的刺激产生适应性,生长也会迟缓。一个有效的计划除了保证训练的持续性外,还要保证循序渐进地增加训练强度,频度、数量、强度是训练计划的三个要素。这些要素的量和度都决定于是否能保持训练的持续性和渐进性。所以,不要中断训练,不要错过一节训练课。反之,训练不能过频,训练量不能过大,增加重量不能急于求成,否则会造成训练过度,甚至会因负荷过大而受伤。那样你就不得不中断训练
四、频度
频度是指一星期练几次。频度的设定取决于你训练后的恢复能力,恢复能力又取决于身体素质、睡眠和营养三个因素。另外,你的工作性质和家庭负担对恢复能力的影响也不容忽视。如果你的工作和家务每天都耗费很多体力和精力,那就会延缓你的恢复过程。一般来说,有工作有家庭的初级训练者一星期进行两个循环的重量练习比较合适。对学生而言,一周三个循环也可以。每个循环的具体安排视时间和身体状况而定,最好一个循环练两天,一天练上身,一天练腿。一周两循环是基于人体的平均恢复能力而言的,保证充足而不拖沓的恢复时间既兼顾了训练的持续性,也不会破坏训练的渐进性。一星期进行两个循环的重量练习能使时间比较宽松,体脂较大者还可在两个循环之间的休息日安排3O40分钟的有氧训练。但有氧训练的强度不能太大,以训练时心率120——140为宜。
五、数量
数量就是训练量,练多少组、每组多少次以及组间休息时间的长短等。
首先,组数的安排不是固定的,但每个动作必须有一个热身组。热身组的作用是:互.加速代谢,进人训练状态;2.充分活动关节和韧带,避免受伤。
其次,正式组以2—4组为宜,较少的组数有助于提高训练效率。每个正式组的次数6——12 次,热身组不少于 20次。然后,每组之间的间歇时间一般不多于2分钟。间歇时间视身体状况而定,2分钟以上也是允许的,但不允许在休息时聊天或做其它影响训练的事情。否则不但拖延了训练时间,而且降低了训练效率,破坏了训练的持续性。最后,每次训练不要超过1小时,因为在无氧训练40分钟后,一些影响训练的重要的内分泌激素就会大幅度减少,直到基本停止,以致造成肌肉损耗。对初级训练者而言,精简时间、提高效率是必须养成的习惯。
六、强度
强度是指训练中你所承受的负荷水平。负荷水平价高低取决于三个因素:重量,训练间歇,力竭程度。“高强度”是指在训练间歇较短的前提下,每组都使用较大以重量训练至接近力竭。“力竭”的概念是“无能力完成一次”。“高强度”的要点是达到力竭的边缘,而不是力竭;因为力竭的时候肌肉无法完成一次完整的动作,肌肉收缩不充分肌纤维就得不到足够刺激。另外,力竭时肌肉对训练重量失去控制,随时都有受伤的危险。所以,完全力竭对初级训练者来说不可取。了解“高强度”的概念和要点对如何增加重量是报重要的。因为增加重量就要影响训练次数和力竭程度刚入门的朋友要注意,增加重量不可操之过急。下面介绍一种行之有效的方法。刚开始训练时,正式组使用的重量允许你完成的次初他就是练至力竭的次数.例如,你的目标次数为8次,那么所使用的重量应该允许你完成13次,而你完成8次就停下来。接下来的6-8周内,逐渐增加重量,直到所使用重量允许你完成的次数,而你仍是完成8次就停下来。保持这样的强度训练了一3周,然后改变目标次数为6次,使用力竭次数为11次的重量训练。接下来仍然用上述方法增加重量。
肌肉的生长决定于所受的刺激。经常改变重量、次数等可变因素,才能使肌肉对刺激保持敏感,不断生长。
掌握以上六点可以帮助你制订一个适合自己的训练计划,而真正的考验是计划能否严格实施。树立了目标就要付诸行动,不要为了偷懒而找任何借口。健美运动是强壮体格的运动,也是增强意志的运动。懒惰就是懦弱,克服它。才会更强。
你不可能在1-1.5小时内充分地锻炼全身的肌肉,因此必须将全
身分成二或三个部分,每次训练课只集中锻炼一个部分,这样可保持
该部位每次训练都可达到超负荷,同时,可确保每块肌肉至少在每周
可充分锻炼两次,这种训练计划的安排方法叫做分部锻炼,在健美界
被广泛采用。
如何进行分部锻炼?
最简单的办法是把各肌肉群分别组合成甲、乙两部分,每周进行
四次锻炼:周一、四练甲部;周二、五练乙部。各部锻炼课程中所
选用的动作项目约两个月更换一次,每次锻炼时间约1.5至2小时。
当你照上列安排锻炼了约两年而进入更高的体格发展阶段时,你
可以把全身分为甲、乙、丙三部分,每周锻炼六次;周一、四练甲
部;周二、五练乙部。周三、六练丙部。如果你的生活条件良好,生理代谢功能
强盛,锻炼目标很高,也可以把全身分为甲、乙两部分,每周锻炼六次;周一、
三、五练甲部;周二、四、六练乙部。如果你一周只能锻炼五次,则可照下列安
排进行锻炼:

第三周同第一周,第四周同第二周,如此轮换地进行
下去。每经两个星期,甲、乙两部就受到相等的锻炼次
数。各部锻炼课程的内容可根据各个暑期的不同目的要
求和锻炼效果来加以变化。
一般有下列几种划分法和组合法:
- 上身和下身分开法。
- 重点发展部分和非重点发展部分分开法。
- 起“拉”的作用和起“推”的作用的肌肉群分开法。
- 反以锻炼主要肌肉群为主的“基本动作”和以分别锻炼个别肌肉群的“孤立动作”分开法。
- 大注肌肉群或重点非重点,上身和下身在混合搭配后的均匀分部法。
- 其他根据锻炼者的爱好、习惯和能收到较佳效果或按器材、场地的特点而组合成的分部法。
下面是几种常见分部法的具体示例:
(1)每周锻炼四次的分部安排:
第一种:周一、四 周二、五
腹部 腹部
胸部 大腿
背部 上臂
肩部 前臂
小腿 小腿
第二种:腹部 腹部
胸部 大腿
肩部 背部
肱三头肌 前臂
肱二头肌 颈部
小腿 小腿
注:腹部和小腿以每周锻炼四至六次效果较佳,下列课程中也会
出现同样情况。
(2)每周锻炼六次的分部安排法:
第一种:每一肌肉群(除腹部,小腿外),一周锻炼两次:
周一、四 周二、五 周三、六
腹部 腹部 腹部
胸部 大腿 肩部
背部 前臂 上臂
小腿 颈部 小腿
第二种:每一肌肉群(除腹部外),一周锻炼到三次:
周一、三、五 周二、四、六
腹部 腹部
大腿 胸部
下背部 上背部
小腿 肩部
前臂 上臂
(3)每周练六次,每天练两次的双分部安排法:
周一、三、五(上午) 周一、三、五
腹部 小腿
胸部 肩部
前臂 肱三头肌
周二、四、六(上午) 周二、四、六(下午)
大腿 背部
腹部 肱二头肌
初级班训练计划及基本动作
初级班学员的训练计划
初级班学员的训练应本着劳逸结合,以基础训练为主的原则。每周三次
力量训练,四次力量训练后进行一次有氧训练,隔天练习。
第一天计划
胸部:平板卧推 6组 每组8--10次
俯卧撑 4组 每组10--20次
双杠臂屈伸 4组 每组8--10次
蝴蝶机夹胸 4组 每组8--10次(作为辅助项目)
背部:引体向上 4组 每组6--8次
背阔肌胸前下拉 6组 每组10--12次
腹部:仰卧起坐 4组 每组20次
仰卧举腿 4组 每组20次
第二天计划
肩部:直立上举 6组 每组8--10次
坐式哑铃上举 4-6组 每组8--10次
哑铃侧平举 4组 每组12-15次
臂部:直立杠铃弯举 4-6组 每组10-12次
颈后臂屈伸 4-6组 每组10--12次
腿部:深蹲 6-8组 每组8-12次
提踵 6组 每组12-15次
第三天计划同第一天
第四天计划同第二天
第五天计划
有氧训练:跑步 20-30分钟
固定自行车 10-30分钟
韦德健美训练法则详解
(一)
初练者的训练法则
1、渐进性超负荷法则
增强任何健康素质(如:力量、肌肉围度、耐力等)的基础
是使肌肉负担比它已习惯的更重的工作,使肌肉承担不断增加的
负荷。例如:若求增大肌肉围度,则不仅要日益试用更大重量,
并且还要增加训练组数和每周锻炼次数。若求增大局部肌肉的耐
力,你可以逐步减少各组动作之间的休息时间和增加锻炼该部位
肌肉的组数和每组的动作次数,一切要有渐进性。所有的身体锻炼法的基本观念是超
负荷,这也是韦德法则的坚实基础。
2、多组练习法则
在韦德系统的初建时期,多数专家建议有雄心的健美运动员对其所选用的每个动
作,只须各做一组。如果在一次锻炼课程中选用锻炼到全身的12个动作,那就共做12
组。但韦德法则提出每个动作要练多组(3—4组)的训练法则,以使每一肌肉群都能
得到彻底的锻炼而增大到其最大限度。
3、孤立锻炼法则
可以让许多肌肉群共同来做某项锻炼动作,也可以使它们相对
分离地进行这个动作。对完成某一复杂的整个动作说来,每一有关
肌肉群都有其各自的作用,除起主要动力作用者之外,有的起协助
作用,有的起稳定作用。如求最大限度地发展某一局部肌肉,就要
尽可能使其在工作时与其他肌肉活动分离开,不借用身体其他部位
的助力而使其单独承受负荷来获得集中的刺激,这种锻炼法主要用于突出加强某一部
分的肌肉和着重纠正身体上某一部分的缺点。
4、迷乱莫测(动作多变)法则
促使肌肉不断发展的主要因素之一是决不让其顺应某一锻炼课程。如果总是用老一套的方法锻炼,肌肉就会由于太习惯于某种固定的动作方式、角度、重量、次数,以及其程序编排,而感受不到强烈的刺激,不能引起良好的反应。反之,若常加变化,就能使其感受到新刺激,并能增加锻炼者的兴趣,避免枯燥乏味。乔.韦德对这种多加变化的训练法一个创新的名称,即:使肌肉感到“迷乱莫测”的法则。
第二篇:第二天制定针对性训练计划
第二天
昨天的查漏补缺大家做好了吗?如果想做,内心真的渴望化学能得到高分的话,你肯定会动手做的。做好了这个纠错本,跟着老师,我们一起来看看。孩子们容易出错或者是觉得解答起来很棘手的都是哪一类的问题呢?
我们按照试卷四大块的分类来介绍:一般来说,选择题当中是化学式的计算和涉及到金属活动性的判断式选择题;非选择题中的有关物质鉴别类(包括推断题)的题目;实验题中的探究性试验(多数孩子无法写出标准答案或者是没有理解题意)以及最后计算题大题中的第二小题(以图表和坐标)!下面我分块来介绍这些题型的特点,以及我们针对这些题型应该采取什么样的训练。
一、 选择题
所有涉及到化学式的计算,其解题精髓就是我在前面提到过就是“元素守恒”的思想。很多孩子会感到特别恐惧此类题型,实际上就是元素质量分数的计算(计算基本功不过关,很多孩子列式都是不规范的)和此类题型解答的基本思路没有很好的掌握。很多学生看到这类题型就会主动跳过,平时也很害怕做这类题目!或者是粗略的看题接着贸然下笔,在得不出思路的时刻就想放弃了!那么,下面我们以一摸中的第25小题为例来谈谈如何用“元素守恒”的思想来解题。
25、有一在空气中暴露过的NaOH固体,经分析知其含水7.65%,含Na2CO3 4.32%,其余是NaOH。若将此样品1 g放入100 g3.65%的稀盐酸中充分反应,残余的酸再用10 g 30.9%的NaOH溶液恰好完全中和。将反应后的溶液蒸干,得到固体的质量是
A.5.85 g B.4.52 g C.2.62 g D.1.33 g
这道题乍一看来真的好复杂,涉及到了三种物质,前后兜来兜去发生了好几次化学反应。有的同学一看到这种题目。马上就开始写化学方程式,然后标出相对分子质量,标出各反应物的质量,紧接着然后哼哧哼哧的开始算了。其实不然,所有的题目在解答时有一点是相同的,就是一定要首先分析题目,在草稿上化出草图以帮助分析题意。确定了解答方案后再开始动手进行计算。其实,化学计算题就特别像一道数学应用题。
我们来仔细分析这道题的初始状态和结束状态。初始状态为变质的氢氧化钠固体,接着然后放入盐酸发生反应,结果固体量不足,就又添加了一部分氢氧化钠来中和过量的盐酸,在所有的反应结束之后只剩下氯化钠的溶液。其实我们观察这个题目,表面上看来我们需要写出三个方程式分步进行计算。其实,最关键的一点是我们可以跳过中间过程可以直接看产物,用元素守恒的思想来解答貌似看来是化学方程式计算的题目。
我们已经分析出固体产物只有氯化钠,如果能知道其中钠元素或者是氯元素的质量那就太好了!然后,我们仔细观察题目。同学们,猜猜看,我是用钠元素的质量来算方便还是用氯元素的质量来计算方便呢?很显然,是氯元素!因为只需要算一组数。根据题意可以知道稀盐酸中含有的氯元素质量是100g×3.65%×(35.5/36.5×100%)=3.55g,根据元素在化学反应中的质量守恒,那么产物氯化钠中的氯元素质量为35.5g,那么该氯化钠的质量心算都能得出答案是5.85g。
大家看,是不是很简单?而现在这种题型的考法是当前的热点。它已经从一定程度上涉及到了高中化学计算题的解题思想,就是“元素守恒”。
我将会在第六天化学计算的专题中给大家详细的讲解十道例题!
金属活动性方面的判断题,也是很多孩子觉得很困难的地方。其实,这类题目只要弄清此类题型的常规思路就完全OK的!我们来看下面的题目
印刷铜制电路板的“腐蚀液”为FeCl3溶液。已知铜、铁均能与FeCl3溶液反应,反应方程式分别为:Cu+2FeCl3=2FeCl2+CuCl2,Fe+2FeCl3=3FeCl2。现将一包铜、铁的混合粉末加入到盛有FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体,关于烧杯中物质组成的说法正确的是( )
A.溶液中一定含FeCl2,固体一定含铜
B.溶液中一定含FeCl2,固体一定是铁和铜
C.溶液中一定含FeCl3,固体一定是铁和铜
D.溶液中一定含FeCl2、CuCl2,固体一定含铜
还是先仔细观察题目,如果要想知道反应结束后各物质的状态就必须要知道化学反应的实际情况。有很多同学看到这个问题的第一个反应就是两个化学反应有先后顺序吗?两个都是我没有学过的新反应怎么判断呢?其实,只要是试卷里面出现的题目,就一定是在初中阶段能够被解答出来的,因为超纲的题不可能在一模题里面出现!
我们只要仔细思考一下就知道这一定是一道涉及金属活动性顺序的题目。因为金属活动性强的金属单质在化学反应中一定会表现出强势的一面,所以不同的金属单质在和相同的的对象反应的时候,活动性强的要先反应!就好比在狼群中,狼王是绝对有先享用食物的权利的,等狼王吃饱了舒服了,再轮到其他的狼。
这道题目关键就在于,从表观上看来,铁会和氯化铁先反应!只有当铁单质和氯化铁完全反应了,并且有多余的氯化铁剩余的话才会轮到铜和氯化铁反应。假如铁单质非常多,一上来就把氯化铁给全反应完了,那铜也就没有反应的对象了。
题目给出一个关键信息“充分反应后烧杯中仍有少量固体”,那么根据我们那刚才分析的反应先后顺序!铜得待在铁后面反应,如果要留下,铜一定得留下。铁如果想留下,那得看氯化铁的量如何。那么固体一定含铜,有没有铁剩余就不好说了!那么选项BC去掉!AC当中的区别在于是否会有CuCl2留下!一样的道理,万一铁很多时,氯化铁全没了,铜就没有反应对象,也就没有氯化铜的存在了。这道题的答案就出来了,为A!
大家看看,这种题目真的很难吗?其实不是,这类题目旨在于考察同学们的分析和处理问题的能力。当然,强大的分析能力还是需要我们有厚实的基础知识做支撑。如果说金属活动性顺序的基础含义没理解,这道题是怎么也做不出啦!
一般说来,孩子们会觉得选择题中这两类题型很困难,所以咱们就得多找这个类型的题目来练了!(此类型的题目将会在金属这一专题中很容易找到相类似的十道题来练习。大家加油哦!)
二、 非选择题
此类题型当中大家一般会觉得推断题困难!这一方面其实是需要我们“酸、碱、盐”的基本功要非常的好!所有的化学反应原理要弄的非常透彻!绝对不能一知半解,觉得好像差不多我明白了就行了。只要是酸碱盐钻研的不透彻的同学,这方面的题目肯定做不好的。推断题中确实也是框图题比较困难。但是目前中考,完全的框图已经不是流行趋势了。我们来看一道推断题
30、A、B、C、D均为初中常见物质,转化关系如图所示。试回答下列问题。
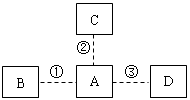 (1)若A是金属单质且能转化为其他三种物质,B是黑色
(1)若A是金属单质且能转化为其他三种物质,B是黑色
固体,C是紫红色固体,D是最理想的清洁燃料。
则A的化学式是 ,反应②的化学方程式是 。
(2)若A能由其他三种物质转化而成,这四种物质分别
是单质、氧化物、酸、碱、盐中的一种,且均含有
一种相同元素。其中A是一种温室气体,则其他三种物质的化学式分别是 。
(3)若A与其他三种物质均能相互转化,A是地球上含量最多的无色液体,A、B、C、D的相对分子质量依次增大。则C的化学式是 ,D转化成A的化学方程式是 。
大家要注意的是,以前我们流行用箭头指向来代表物质的反应,现在是用虚线代表,此题虚线可以有三种含义“1、二者能反应2、A和B、C、D可以相互转化!”这是一个新的考法,要引起重视,读题时要高度细心!
(1)现在题眼非常明显,肯快就可以看出来A是铁单质
Fe Fe + CuSO4 = FeSO4 + Cu
(2)A这种温室气体首推CO2,现在都强调低碳生活嘛,题目中肯定会呼应的!很显然都含有氧元素的物质类别比都含有碳元素的物质类别中,可选的常见物质多。走氧元素这方面去思考,也是水到渠成了。
O2 H2SO4 CaCO3
(3)A肯定为H2O,而第三问也确实在题目中强调了相互转化的问题,那么初中最常见的涉及到水的反应只有有限的几个:二氧化碳和水反应,氧化钙和水反应,水的电解,酸碱中和产生水,非金属氧化物和碱反应得到水,金属氧化物和酸反应得到水,碳酸盐和酸反应得到水。由题意A、B、C、D的相对分子质量依次增大,就不难得出答案了!
H2CO3 CO2+Ca(OH)2=CaCO3↓+H2O (合理答案均可得分)
此题答案不止一个!C是碳酸时,B就是过氧化氢,D可以是氢氧化钙或者碳酸钙、碳酸钠都可以的!如果B是碳酸,C也可以是Ca(OH)2D可以是碳酸钙碳酸钠都行!
所以现在推断题中,只要是合理答案均给分,实际上已经降低难度了!所以大家一定要有信心,初中推断已经不是拦路虎!
多多练习一些,会发现出现在中考推断题答案中的物质一般都在
H2 O2 Fe Cu C CO CO2 CuO Fe3O4 Fe2O3 H2O2 H2SO4 HCl Ca(OH)2 NaOH CuSO4 FeSO4 CaCO3 Na2CO3出现。
推断题在二模当中也会出现,请大家以二模卷子为范本好好练习,也绝对足够了!
三、 探究性实验题
这是很多同学觉得头好痛的一类题型。其实,说实在的,大家完全没必要害怕!很多同学害怕的原因只是因为别人说这种题难做。这一点上和最后一道计算题相同。很多同学其实看到题目那么长的时候便已败下阵来。从心理上已经投降了!这里先给大家说一个答题小技巧!
探究性实验提一般设置6-7分,这当中5分左右时在命题时一定要送给大家的!所以我们首先要做的是把最基础的分一定要拿到手。然后实在不会的空可以先放着。说实在话,探究性实验提里面真正很难做出来的一般就一个空。实在不行就先搁着。不要耽误下面的答题!我们一起来看一道崇文的探究题
33.(6分)同学们在学习碱的化学性质时,进行了如下图所示的实验。

(1)甲实验中可观察到的实验现象是 。
(2)乙实验中发生反应的化学方程式为 。
(3)丙实验中观察到试管内有白色沉淀产生。
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,看到废液浑浊并呈红色,可知废液中含有能使废液呈碱性的物质。
【提出问题】能使废液呈碱性的物质是什么?
【查阅资料】碳酸钠溶液呈碱性;氯化钙溶液呈中性;两种盐的溶液之间发生复分解反应的条件是有沉淀生成。
【实验设计】小方用氯化钙溶液进行如下实验。

(5)若甲实验改成向盛有稀盐酸的烧杯中加入滴有酚酞的氢氧化钠溶液,并观察到明显的实验现象,乙、丙实验不变。当三个实验的废液倒入另一干净的废液缸中,看到废液澄清并为无色。则废液的组成成分中一定含有的是 。
【反思拓展】 在分析化学反应后所得物质的成分时,除了考虑生成物外,还需考虑 。
我们来分析一下:这道题首先是三位同学分别做了探究碱的的化学性质实验,这一点很重要!很多同学看题时根本不看第一句话,却没想到玄机藏在第一句话里面。既然要探究碱的化学性质,那说明每一个独立实验都会看到明显的实验现象。而且发生了三个独立的化学反应!这在解决后面的难题时会用到!
前两问非常简单,送分! 答案:(1)烧杯中的溶液由红色变为无色
(2)2NaOH + CO2 == Na2CO3 + H2O
在(4)中,实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,看到废液浑浊并呈红色,可知废液中含有能使废液呈碱性的物质。这里告诉我们一个隐含条件!既然废液呈红色,说明甲同学实验中的原料已经全部用完!因为我们在初始的个人实验时必须看到明显现象,所以甲中氢氧化钠肯定是没有了的,都被盐酸中和掉了!。而与其他废液混合后。废液红色,除了沉淀以外的溶液呈碱性,说明盐酸也没了(可能是被乙和丙中的氢氧化钠或者是氢氧化钙中和掉了)。甲能做的贡献就是剩下了氯化钠!
而混合后的废液是浑浊的!说明有碳酸钠和氢氧化钙的反应在里面,只有他们反应才能得到浑浊。剩下的物质在溶液中当中呈碱性的可以有碳酸钠,氢氧化钠,氢氧化钙!这时,题目又给了一个条件:取少量废液缸中的上层清液于试管中,加入过量氯化钙溶液,无白色沉淀生成!说明溶液中不可能存在碳酸钠了,碳酸钠被氢氧化钙反应完了!
那剩下呈碱性的物质就只有NaOH和Ca(OH)2,如果氢氧化钙恰好和碳酸钠完全反应,那剩下的碱性物质就只有氢氧化钠。假若氢氧化钙把碳酸钠反应完全后还有过量剩余的,则呈碱性的物质是氢氧化钠和氢氧化钙的混合溶液!
答案:(4)只有NaOH或者NaOH和Ca(OH)2(此空2分,二种情况都写全才得分)
(5)中,若甲实验改成向盛有稀盐酸的烧杯中加入滴有酚酞的氢氧化钠溶液,并观察到明显的实验现象,乙、丙实验不变。当三个实验的废液倒入另一干净的废液缸中,看到废液澄清并为无色。找到关键信息:甲反过来操作时,必须看到明显现象,即滴进去的氢氧化钠酚酞混合液红色会消失!紧接着当三个实验的废液倒入另一干净的废液缸中,看到废液澄清并为无色。这个现象说明甲中的氢氧化钠肯定没有了,并且现在混合的废液中也没有碳酸钠、氢氧化钠和氢氧化钙这些碱性物质了。这些物质反应掉了,那反应的对象就只有甲当中的盐酸,那么那么剩下的产物就一定有氯化钠和氯化钙。假若甲当中的盐酸恰好完全反应,则产物中只有氯化钠和氯化钙!如甲中的盐酸过量,那么产物中就有盐酸,氯化钠和氯化钙三种溶质。但是题目问一定有,那么答案为NaCl和CaCl2
【反思拓展】反应物是否过量
大家可以看一下老师的分析过程,很难吗?并不是!每一步我都是根据题意,紧抓题意!所有的思考线索都是题目当中的,这说明我们在解答探究性实验题的时候一定要寻找到有用的线索,这一点,和推断太相似了!其实,在初中化学当中,推断题和绝大部分实验研究题都是考查物质的性质,也就是说我们酸碱盐的物质性质要掌握的非常透彻,才能帮助我们解答!剩下的,同学们要拿二模题来多多练习了!
四、 计算题最后一题
大部分同学会觉得最后一题难,是因为觉得它题目太长!其实,我们要转换的观念是:题目越长,越能找到有用的关键线索!大家试想一下,一道计算题只给你一个数据,然后求好几种其他物质的质量,那算起来肯定是很困难的!数据少,意味着需要的解答技巧的要求高!数据多,有用信息多,其实只需要将层次处理清楚就可以了!
35、某化学小组的同学到钢铁厂做社会调查。他们抽取组成相同、质量不同的三份钢的样品(假设钢的样品中只含铁和碳),分别加入100g 19.6%的硫酸进行实验(见左下表),充分反应后,用得到的实验数据绘制出右下图所示的图像。


试回答:
(1)实验一中参加反应的铁的质量为多少克?
(2)稀硫酸完全反应的实验中,反应后所得溶
液中溶质的质量分数是多少?
我们来分析一下:所有的计算题重在分析解题思路,而不是一上来就开始解啊设啊,此时还没搞清楚要算什么,拿什么量来算的话,万一设的物质不对,那岂不是浪费时间了吗?所以,我们经常说,重在分析!其实是为了更大的节约时间!
仔细观察这表格中呈现的数据:钢样的量是一到三递增的,而三次试验中酸的量都是相等的!根据这个变化趋势,我们不难得出肯定在这三次反应中当中不是钢样的量不足,就是硫酸的量不足。然后我们再来仔细观察右边的坐标图,前两次反应中产生氢气的斜率相同,其实说明此时钢样全都反应完了,斜率才能完全一致。到了第三次的时候,发现斜率减小,如果说钢样还是像前两次那样完全反应掉话,那么大家应该斜率都完全一致,也就是说在同一条射线上!现在第三次比前两次的要稍低一些,如果在原来的射线上,第三次氢气量应该大于0.4g!
如果有同学看斜率不明白的话,我们也可以看数据:第二次和第一次减钢样的增量为8.52g-5.68g=2.84g,氢气的增量为0.1g;第三次和第二次钢样的增量为12.46g-8.52g=3.94g,假如钢样完全反应的话就是说氢气的增量应该大于0.1g,可是现在只有0.1g,就说明此时酸的量不够了,才导致产生氢气的增量只有0.1g。
大家明白了吗?其实只要图形和表哥分析清楚了,问题就迎刃而解!看看,多么快速啊!
再来看看标答:
解:
(1)设实验一中参加反应的铁的质量为x
Fe + H2SO4 == FeSO4 + H2↑
56 2
x 0.2g
x = 5.6g (1分)
(2)实验三中100g稀硫酸完全反应
设反应生成FeSO4 的质量为y;消耗铁的质量为z
Fe + H2SO4 == FeSO4 + H2↑
56 152 2
z y 0.4g
y = 30.4g(1分)
z = 11.2g
所得溶液中溶质的质量分数为: ×100% = 27.4%(1分)
×100% = 27.4%(1分)
这里只是给大家提供了一个例子,也就是我们可以在哪些方面做针对性训练!每个孩子的问题都是不尽相同的,所以一定要先找准自己的问题在哪里。着重强化自己薄弱的题型!以上所述是很多孩子觉得解答起来很难的地方。只是给大家做一个借鉴!
不管孩子的问题在哪里,在做针对性训练的时候一定要训练到位,并不是在量上达到目标就够了!咱么一定保证“质”这个关键点!做一道题目要保证这道题是完完全全弄懂了,如果不明白的,赶紧问老师!否则,没有在“质”上得到完全提高,那种提高就是假象!到了中考这种大考检验时就一定会露馅!
后面我会给大家整理初中的知识点。同时,在每个知识点下的难点问题会给大家一些解题建议和指导!让我们一起加油!有不足之处欢迎大家批评指正!
-
制定计划的感想
制定计划的感想制定计划容易执行难因此在计划制订的时候必须对自己有充分的了解制订合适自己的计划内容1制订出明确可实现的目标行动计划的…
-
怎样制订年度工作计划及公司
怎样制订年度工作计划及公司部门年度工作计划120xx1110093332转载标签分类产品方案杂谈什么是年度工作计划什么是年度工作计…
-
如何制定项目进度计划
第10讲如何制定项目进度计划本讲重点项目活动的定义项目活动的排序怎样制订项目的时间计划项目活动的定义项目活动定义确定完成项目产品或…
-
如何制定生产计划
如何制定生产计划一制定生产计划的原则1最少项目原则用最少的项目数进行生产计划的安排如果生产计划中的项目数过多就会使预测和管理都变得…
-
招聘计划的制定
招聘计划的制定经主管总经理批准的人员需求表列入人力资源部招聘工作计划人力资源部着手制定招聘方案明确对应聘人员的资格要求标准1制定计…
-
如何制定年度工作总结和计划
何为总结?工作总结是对过去某一时期或某项工作的情况(包括成绩、经验和存在的问题)的总回顾、评价和结论。它一般先由公司的高层按照战略…
-
制定学习计划的意义和方法
古人说凡事预则立不预则废要学习好首先要制定一个切实可行的学习计划用以指导自己的学习严格遵守学习计划有很多好处1学习计划表可以帮助你…
-
如何制定学习计划
如何制定学习计划俗话说要打有准备的仗才会赢只有制定好学习计划学习效率肯定好由于每个学校的教学方法不一每一个学生的水平能力习惯身体等…
-
新的学期开始了如何制定学习计划
新的学期开始了我已经是新学期的学生了我深知我的学习任务又加重了在这一学期中我要更加努力的学习了不能落在其他同学的后面更要处处严格要…
-
如何制订学习计划_掌门1对1
如何制订学习计划掌门1对1制订学习计划的重要性凡事预则立不预则废做什么事有了计划就容易取得好的结果反之则不然有没有学习计划对你的学…
-
器械健身一周训练计划
器械健身一周训练计划20xx年5月自身情况体重69公斤身高173厘米自我感觉微胖腹部大腿有较多赘肉身上各部位肌肉均不明显力量不够强…