设计性实验报告封面
太原师范学院
设计性实验报告
题 目: 和
和 混合液各组分含量的测定
混合液各组分含量的测定
课程名称:分析化学实验
姓 名: 陈娟
学 号: 2011122233
系 别: 化学系
专 业: 应用化学
班 级: 114班
指导教师(职称):李省云
实验学期: 20## 至 20## 学年第一学期
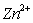 和
和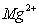 混合液各组分含量的测定
混合液各组分含量的测定
陈娟
(化学系 应用化学 114班 学号2011122233)
摘要 通过用EDTA溶液测定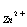 -
-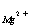 混合液各组分的含量,了解酸度对EDTA选择性的影响,培养学生用络合滴定解决实际问题的能力,提高学生查阅资料和撰写实验报告的能力。
混合液各组分的含量,了解酸度对EDTA选择性的影响,培养学生用络合滴定解决实际问题的能力,提高学生查阅资料和撰写实验报告的能力。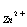
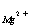 均能与EDTA形成稳定的1:1络合物,他们的LgK分别为16.50和8.7.两者的LgK相差很大,固可利用EDTA的酸效应,在不同酸度下进行分别滴定。在Ph=5~6时,可滴定
均能与EDTA形成稳定的1:1络合物,他们的LgK分别为16.50和8.7.两者的LgK相差很大,固可利用EDTA的酸效应,在不同酸度下进行分别滴定。在Ph=5~6时,可滴定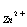 ,在pH为10时,可测定
,在pH为10时,可测定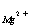 。通过两次滴定可分别求出
。通过两次滴定可分别求出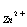
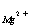 的浓度。该方法简便易行,准确度高,基本符合实验要求。
的浓度。该方法简便易行,准确度高,基本符合实验要求。
关键词 六亚甲基四胺-HcL,氨性缓冲溶液,指示剂
1引言
目前国内外测定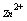 -
-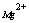 混合溶液中各组分含量的方法有六种:
混合溶液中各组分含量的方法有六种:
第一种方案:取一份溶液加入六亚甲基四胺-HCl缓冲液调节pH=5.4,再滴加二甲酚橙作指示剂,用EDTA标准溶液滴定溶液由酒红色变为黄色(Zn2+)再向溶液中加氨性缓冲液,调节pH=10,再滴加铬黑T作指示剂,继续用EDTA滴定溶液由紫红色变为蓝紫色(Mg2+)
第二种方案:即取一份混合溶液调节pH=10,以铬黑T指示剂,用EDTA滴定离子总量;另取一份溶液加六亚甲基四胺-HCl缓冲液,以二甲酚橙作指示剂,以EDTA滴定Zn2+,差减法为Mg2+。
第三种方案:与第二种方案第一步相同;另取一份溶液加入氨性缓冲溶液,足量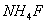 以掩蔽Mg2+,加入铬黑T作指示剂,再用EDTA滴定,差减法为Mg2+。
以掩蔽Mg2+,加入铬黑T作指示剂,再用EDTA滴定,差减法为Mg2+。
第四种方案[1]:取一份溶液加入氨性缓冲溶液,向溶液中加KCN使Zn2+转变为[Zn(CN)4]2-以铬黑T作指示剂,滴入EDTA,记录数据;取一定甲醛或三氯乙醛以破坏[Zn(CN)4]2-释放出Zn2+,再用EDTA滴定至,记录数据。
第五种方案[2]:取一份溶液调pH=5,用二甲酚橙作指示剂,用EDTA滴到黄色,加2mL1%溴化十六烷三甲铵,黄色褪去近为无色,再加氨性缓冲溶液,再调溶液又变为红色,用EDTA滴定近无色。
本实验采用的是第一种方法,简单易操作。第二、三种方法操作繁琐,第四种方法KCN有毒,第五种方法缺少实验药品。
2 实验原理
2.1 0.10 mol.L-1 EDTA标准溶液的配制和浓度的标定
EDTA标准溶液的配制:因为EDTA不易制纯,在空气中常吸附有少量水分并含有其它杂质,因此采用间接配制发配制,及先制取近似浓度的溶液,再用基准物质标定。
EDTA标准溶液浓度的标定: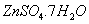
标定反应: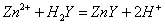
调节pH=10,用铬黑T作指示剂
2.2 混合溶液的测定原理:
Zn2+ Mg2+均能与EDTA形成稳定的1:1络合物,他们的LgK分别为16.50和8.7.两者的LgK相差很大,固可利用EDTA的酸效应,在不同酸度下进行分别滴定。在pH=5~6时,可滴定Zn2+ ,在pH为10时,可测定Mg2+。
因此,可先将Zn2+–Mg2+混合液的pH调至5左右,以二甲酚橙为指示剂,用EDTA标液滴定Zn2+,当溶液由紫红色变为黄色时,即为滴定Zn2+的终点。在滴定完Zn2+的溶液中,加入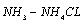 缓冲溶液,调节pH为10,以铬黑T为指示剂,用EDTA标液来滴定Mg2+。
缓冲溶液,调节pH为10,以铬黑T为指示剂,用EDTA标液来滴定Mg2+。
3 实验用品
实验仪器:全自动电光分析天平、锥形瓶、容量瓶(250ml)、移液管(25ml)、酸式滴定管(50ml)、胶头滴管、玻璃棒、洗耳球、500ml烧杯
实验试剂:0.01mol/L Zn2+和Mg2+的混合液,Na2H2Y.2H2O(s);ZnSO4.7H2O(基准试剂);氨性缓冲液(pH=10.0);铬黑T(5g/L);二甲酚橙(2g/L);六亚甲基四胺(200g/L);六亚甲基四胺-HCl缓冲液(pH=5.4)
4 实验方法
4.1 EDTA溶液的配制
在台秤上称取1.8~2.0g乙二胺四乙酸二纳盐于250mL烧杯中,加蒸馏水溶解,然后倒入烧杯中,加蒸馏水稀释至500mL左右,用玻璃棒搅拌,使其均匀混合。
4.2 Zn2+标准溶液的配制
在分析天平上准确称取0.6~0.75g 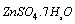 于一干净的小烧杯中,加蒸馏水溶解。将溶液转移至250mL容量瓶中,加蒸馏水至刻度,摇匀,计算溶液的浓度。
于一干净的小烧杯中,加蒸馏水溶解。将溶液转移至250mL容量瓶中,加蒸馏水至刻度,摇匀,计算溶液的浓度。
4.3 EDTA溶液的标定
用移液管准确移取25.00mL的Zn2+标准溶液于锥形瓶中,向其中加入5mL 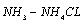 缓冲溶液,2~3滴二甲酚橙指示剂。用待标定的EDTA溶液滴定。当溶液由紫红色恰好变为黄色时,停止滴定。记录所消耗EDTA的体积V,平行三份,计算溶液的浓度。
缓冲溶液,2~3滴二甲酚橙指示剂。用待标定的EDTA溶液滴定。当溶液由紫红色恰好变为黄色时,停止滴定。记录所消耗EDTA的体积V,平行三份,计算溶液的浓度。
4.4 Zn2+ Mg2+ 混合溶液的滴定
用移液管准确移取20.00mL混合溶液于锥形瓶中,向其中加入5mL六亚甲基四胺-HCL缓冲溶液。加1~2滴二甲酚橙做指示剂,用上述已标定的EDTA溶液滴定。当溶液由紫红色恰好变为黄色时,停止滴定。记录所消耗EDTA的体积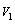 。
。
向滴定后的溶液中加入10mL氨性缓冲溶液,1~2滴铬黑T指示剂。用上述配好的EDTA溶液滴定。当溶液由紫红色恰好变为黄色时,停止滴定。记录所消耗EDTA的体积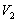 ,平行三份,计算溶液的浓度。
,平行三份,计算溶液的浓度。
实验完毕后,将仪器洗涤干净,废液回收到废液桶中,将和仪器放回相应位置,整理好实验台,并登记实验数据。
5 实验记录及数据处理
5.1 Zn2+标准溶液的配制
称量瓶+样品的初质量=10.1360g 倾倒后称量瓶+样品的初质量=9.5274g
样品的质量=10.1360-9.5274=0.6086g
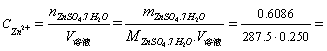
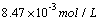
5.2 EDTA溶液的标定
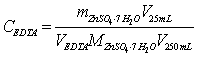

5.3 Zn2+ Mg2+混合溶液的滴定
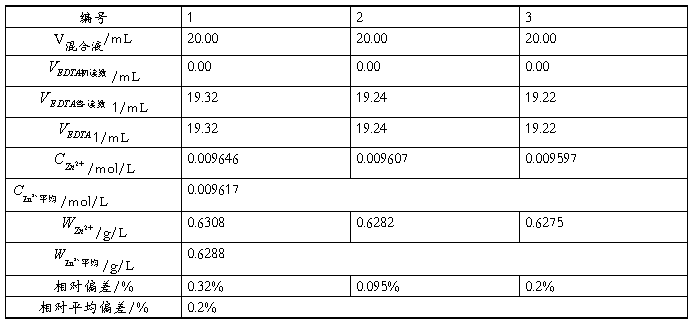
5.3.1 Zn2+含量的测定
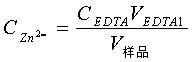
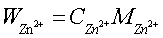
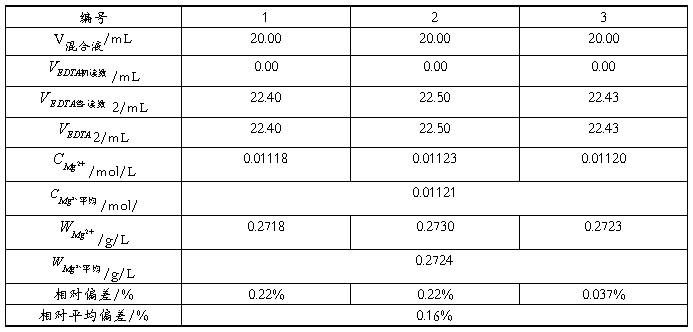
5.3.2 Mg2+含量的测定

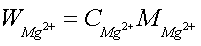
6 实验结果与讨论
6.1 测定结果
本实验采用酸碱滴定法测定Zn2+和Mg2+的混合液各组分的含量,其中所标定EDTA溶液的标准浓度 0.009986mol/L ;滴定得Zn2+的浓度为 0.009617 mol/L ,Zn2+含量为 0,6299g/L 。Mg2+的浓度为 0.01121mol/L ,Mg2+含量为 0.2724g/L .
6.2 误差分析
6.2.1 分析天平仪器老化,灵敏度不高,有系统误差;
6.2.2 滴定过程中,有少量溶液滞留在锥形瓶内壁,未用蒸馏水完全冲入溶液中,导致误差;
6.2.3 滴定过程中滴定终点判断有误,读数时有人为误差;
6.2.4 试剂纯度可能不够和蒸馏水中可能含有微量杂质从而引起系统误差。
6.3 注意事项
6.3.1 注意滴定时指示剂的用量,及滴定终点颜色的正确判断;
6.3.2 注意滴定时的正确操作:滴定成线,逐滴滴入,半滴滴入;
6.3.3 确定滴定终点时,要注意在规定时间内不褪色再读数;
6.3.4 处理数据时注意有效数字的保留。
6.4 心得体会
分析化学是一门严密的课程,需要我们认真操作好每一步,认真读取数据并准确计算。我们应以严谨的态度对待这门学科。然而滴定分析又是分析化学的基础,需要我们好好掌握滴定方法,滴定终点的判断以及指示剂的使用等。通过实验我懂得了络合滴定的基本原理,及正确应用双指示剂、连续滴定。我相信通过做此设计性实验不仅可以熟练分析天平、移液管、滴定管等的使用,还能锻炼我们学会运用已学知识、提高解决问题的能力。
参考文献
[1] 工科化学第三版,化学工业出版社,60
[2] 定量分析化学实验,中国科学技术大学出版社,95
A4纸打印,上边距2.5cm,下边距2.0cm,左边距3.0cm,右边距2.0cm,装订线在左侧1.0cm.
第二篇:机能学设计性实验报告
神经干、肌膜动作电位和骨骼肌收缩同步观察
摘要 目的:通过同步记录神经干、肌肉膜动作电位和骨骼肌收缩,学习多信号记录技术。观察神经-肌接头兴奋传递和骨骼肌兴奋的电变化与收缩之间的时间关系以及各自的特点。
方法:通过微机生物信号采集处理系统,刺激离体蟾蜍坐骨神经腓肠肌标本,观察神经干、肌膜动作电位和骨骼肌收缩以及神经-肌接头兴奋传递和骨骼肌兴奋的电变化与收缩之间的时间关系,并观察标本在酸中毒和碱中毒情况下的结果。 结果:加入乳酸溶液时,阈刺激强度变大,加入NaHCO3溶液时,阈刺激强度变小。 结论:肌肉酸中毒,阈刺激强度变大,肌肉碱中毒,阈刺激强度变小。
关键词 动作电位、阈刺激、不应期、酸中毒、碱中毒
Abstract Purpose:Through the simultaneous recording of nerve, muscle membrane action potential and contraction of skeletal muscle, learning multiple signal recording technology. Observation of neuromuscular junction excitation transfer and skeletal muscle excitability and contraction of electrophysiological changes of the relationship between time and their characteristics. Method:Biological signal collecting and processing system by microcomputer, stimulation of isolated toad sciatic Nerve-gastrocnemius specimen, observation of neural stem, muscle membrane action potential and contraction of skeletal muscles and neuromuscular junction excitation transfer and skeletal muscle excitability and contraction of electrophysiological changes of the relationship between time, and the specimens were observed in acidosis and alkalosis results under the conditions of. Result: Adding lactic acid solution, the threshold stimulus intensity becomes large, joined the NaHCO3solution, the threshold stimulus intensity change small. Conclusion: Muscle acidosis, threshold stimulus intensity becomes large, muscular alkalosis, threshold stimulus intensity change small.
Key word Action potential, threshold stimulus, Refractory period, acidosis, alkali poisoning
引言 兴奋的运动神经通过局部电流将神经冲动传导至神经-肌接头,使接头前膜释放神经递质乙酰胆碱(Ach),Ach与接头后膜M受体结合使后膜去极化,后膜去极化至阈电位水平便爆发动作电位,进而引起肌肉的收缩。上述过程中,骨骼肌兴奋的电变化(AP)与收缩(长度与张力变化)是两种不同性质的生理过程,但又密切相关。当肌膜产生动作电位后,根据局部电流原理,AP可沿肌膜迅速传播,并经由横管膜进入肌细胞内到达三联体部位。AP形成的刺激使终池膜上的钙通道开放,贮存在终池内的Ca2+顺浓度差以易化扩散的方式经钙通道进入肌浆到达肌丝区域,使Ca2+与细肌丝的肌钙蛋白结合,引发肌丝滑行过程,结果是肌细胞的收缩。
一、材料与方法
(一)材料
1.实验动物 蟾蜍
2.实验药品 任氏液、2.5%NaHCO3,1%乳酸
3.实验器材 BB-3G屏蔽盒、针形引导电极、张力换能器、生物信号采集处理系统
(二)方法
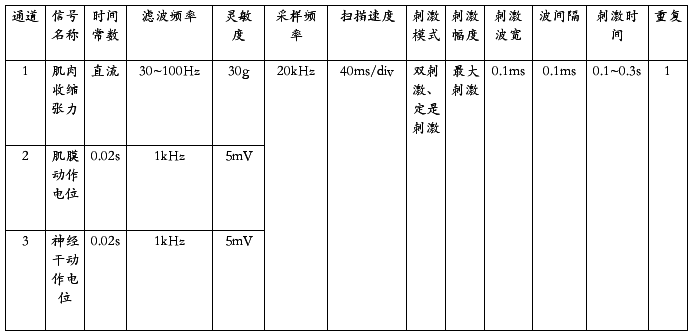
1. 系统连接和仪器参数设置 张力换能器输入RM 6240 系统第一通道,肌膜AP引导电极信号输入第二通道,神经干AP引导电极信号输入第三通道。 启动生物信号采集处理系统,仪器参数见下表
2.离体蟾蜍坐骨神经腓肠肌标本制备
3.实验装置连接 讲离体坐骨神经腓肠肌标本固定在屏蔽盒中,腓肠肌的跟腱结扎线固定在张力换能器的悬梁臂上。坐骨神经放在刺激电极和引导电极上,保持神经与电极接触良好。针形引导电极插入腓肠肌并固定。
4.实验观察
(1) 启动刺激, 观察记录不同刺激间隔情况下神经干动作电位、肌膜动作电位波形和腓肠肌的收缩曲线和刺激标记之间的时间按关系。
(2) 测量腓肠肌不完全强制收缩和完全强直收缩是的刺激波间隔;测量刺激间隔等于500ms时神经干动作电位起点,肌膜动作电位起点到肌肉收缩起点的时差。
(3) 测量第二个动作电位消失时的波间隔
(4) 观察兴奋收缩去耦连现象 用浸泡任氏液的棉花包裹在腓肠肌上,每隔30s用单刺激刺激标本一次。记录用单刺激刺激标本一次。记录有动作电位无腓肠肌收缩的时间。
5.分别加入溶液NaHCO3、1%乳酸,依次重复实验操作。NaHCO3和乳酸只考虑对肌肉阈刺激强度的影响,不必记录收缩幅度的变化。
6. 观察指标 肌肉收缩的阈刺激强度和肌肉在相同刺激强度下收缩幅度的改变。
二、实验结果
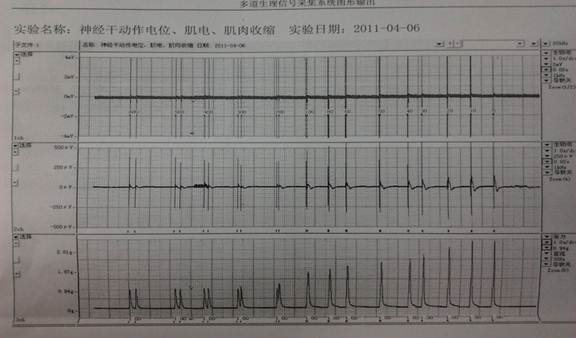
生物信号波形
实验名称:神经干动作电位、肌电、肌肉收缩 实验日期:20##-04-06
实验评注:正常
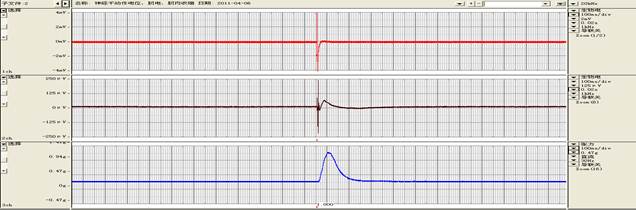
实验评注:乳酸
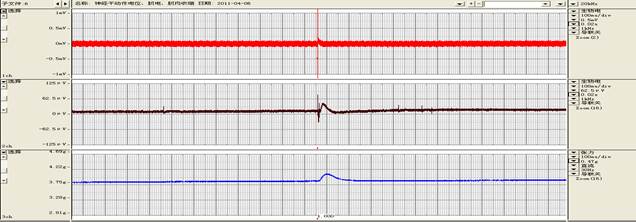
实验评注:NaHCO3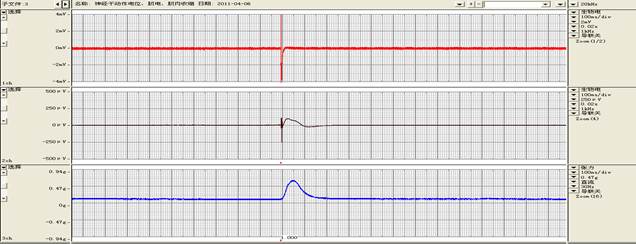
三、实验讨论
在生物对某一刺激发生反应后,在一定时间内,即使再给予刺激,也不发生反应,此期间称为不应期。在一次兴奋后出现兴奋性消失或降低的有序变化,分绝对不应期与相对不应期。给神经肌肉等应激性器官或部位以刺激,刚产生兴奋之后,再给予第二次刺激则无效。该时期被认为是该器官或部位是处于兴奋状态的恢复时期。不应期分为绝对不应期和相对不应期。不论第二次刺激强度多大均无反应的是绝对不应期;以后给予强刺激则可能发生反应的是相对不应期。上述几种不应期与神经动作电位的位相相对应,绝对不应期相当于峰电位的持续期(例如在哺乳类运动神经A纤维中为0.5毫秒左右)。相对不应期是继绝对不应期之后短时间结束。以后是兴奋性比正常增强的超常期,相当于动作电位的负后电位(从开始起约10-15毫秒)。继超常期的是兴奋性减低的低常期,长达70毫秒。从兴奋的离子学说来看,不应期是因为膜的Na+ 的转运机制全部或部分钝化,膜对K+的透性亢进的结果。即使同一细胞,其不应期也随各种内外条件而变化,例如低温或疲劳可使其延长,药物或无机离子也有影响。
碱中毒时,肌肉的兴奋性降低,酸中毒时,肌肉的兴奋性增大。在任氏液中加入2.5%NaHCO3溶液后,腓肠肌碱中毒,肌肉阈刺激强度减小。在任氏液中混入1%乳酸后,腓肠肌酸中毒,肌肉阈刺激强度增大。
四、实验结论
肌肉酸中毒,阈刺激强度变大,肌肉碱中毒,阈刺激强度变小。
五、参考文献
1.陆源 林国华 杨午鸣 机能学实验教程 第二版 北京:科学出版社
2. V.B蒙卡斯尔. 医学生理学. 1版. 北京:科学出版社,1988年
3. 李子输,于志铭等. 医用生理学. 1版. 南昌:江西科技出版社,1988年
4. 王娜等.细胞外液离子浓度的改变对肌肉收缩活动的影响.中山医科大学学报.1999
-
实验报告样式封面
实实验课程学生姓名学号专业班级验报告目录实验一建筑CAD操作系统实验二AutoCAD的基本绘制命令编辑命令与操作实验三实验四实验五…
-
实验报告的统一要求与封面格式-11
实验报告要求20xx1030一实验报告内容与要求1按照自己所做实验的次序撰写实验报告1实验内容2总体方案和设计流程3程序清单每个程…
-
实验报告书封面
实验报告名称姓名学号年级专业10会计学教改班20xx年1月1日成绩评语指导教师签名实验一股票系数的估计与应用实验时间20xx20x…
- 实验报告的封面及模版
-
实验报告封面及报告
重庆交通大学学生实验报告实验课程名称开课实验室学院年级学生姓名学号开课时间至学年第学期交通经济管理实验教学示范中心实验报告20至2…
- 大学计算机基础实验报告封面
-
20xx年实验报告的封面及模版
报告要求报告一律使用A4纸报告模版的封面必须需打印封面必须填写完整实验报告内容只能手写报告末尾必须保留教师评语的地方和分数框报告内…
-
实验报告样式封面
实实验课程学生姓名学号专业班级验报告目录实验一建筑CAD操作系统实验二AutoCAD的基本绘制命令编辑命令与操作实验三实验四实验五…
- 文献检索实验报告封面
-
实验报告的统一要求与封面格式-11
实验报告要求20xx1030一实验报告内容与要求1按照自己所做实验的次序撰写实验报告1实验内容2总体方案和设计流程3程序清单每个程…
-
调研报告封面格式
餐饮空间设计调研报告书专业名称班级学号学生姓名设计课题完成日期郑州轻工业学院易斯顿美术学院二0一0年x月调研报告一导言调研时间:调…