大学化学A实验报告
实验一 硫酸亚铁铵的制备
姓名: 班级:学号: 指导老师: 实验成绩:
一、实验目的
1. 了解复盐的制备方法。2. 练习简单过滤、减压过滤操作方法。3. 练习蒸发、浓缩、结晶等基本操作。
二、实验原理
三、实验步骤
四、实验数据与处理
1. 实际产量:
2. 理论产量:
3. 产率:
实验二 化学反应速率、活化能的测定
姓名: 班级:学号: 指导老师: 实验成绩: 一、实验目的
1. 通过实验了解浓度、温度和催化剂对化学反应速率的影响。 2. 加深对活化能的理解,并练习根据实验数据作图的方法。
二、实验原理
三、实验数据记录及处理
1. 浓度对反应速率的影响,求反应级数
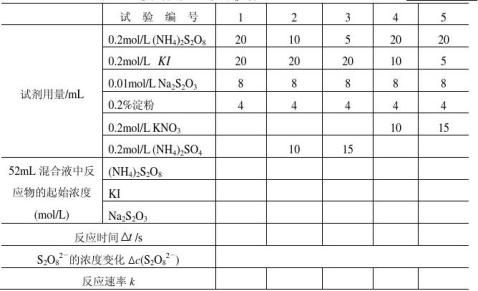
确定反应级数:m= n=
2. 温度对反应速率的影响,求活化能
表2 温度对反应速率的影响
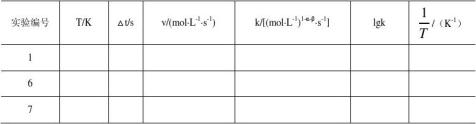

利用表2中各次实验的k和T,作lg
求出直线的斜率,进而求出反应活化能Ea。 ?k?-图,
3. 催化剂对反应速率的影响
实验三 盐酸标准溶液的配制、标定及混合碱的测定
姓名: 班级:学号: 指导老师: 实验成绩: 一、实验目的
1.了解间接法配制标准溶液的方法。2.学习用双指示剂法测定混合碱中不同组分的含量。
二、实验原理
三、实验数据记录及处理
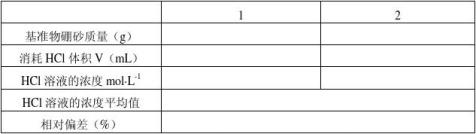
1. HCl标准溶液的标定结果
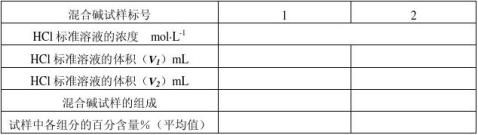
2. 混合碱的测量结果
第二篇:大学化学A实验讲义(20xx年)
大学化学A实验讲义
(试用版)
北京石油化工学院
化学工程学院
2OO9年6月
实验一 硫酸亚铁铵的制备
一、 实验目的
1. 了解复盐的制备方法。
2. 练习简单过滤、减压过滤操作方法。
3. 练习蒸发、浓缩、结晶等基本操作。
二、 内容提要
铁与稀硫酸作用生成硫酸亚铁,溶液经浓缩后冷却至室温,即得到浅绿色的FeSO4·7H2O (俗称绿矾)晶体。
Fe + H2SO4=FeSO4 + H2↑
FeSO4在弱酸溶液中容易氧化,生成黄色的碱式硫酸铁沉淀:
4FeSO4 + O2 + 2H2O=4Fe(OH)SO4↓
因此,在蒸发浓缩过程中,应加一枚小铁钉,并使溶液保持较强的酸性。
浅绿色的FeSO4·7H2O在70℃左右时,容易变成溶解度较小的白色FeSO4·7H2O,所以在浓缩过程中,温度不宜过高,就维持在70℃以下。
硫酸亚铁与等物质的量的硫酸铵溶液混合,即生成溶解度较小的浅蓝绿色硫酸亚铁铵FeSO4·(NH4)2SO4·6H2O复盐晶体。
FeSO4 + (NH4)2SO4 + 6H2O = FeSO4·(NH4)2SO4·6H2O
该复盐组成稳定,在空气中不易被氧。在分析化学中可用作标定KMnO4和K2Cr2O7的标准溶液。
三、 仪器、药品和材料
仪器:台称 布氏漏斗 吸滤瓶
药品:H2SO4(3mol/L) Na2CO3(10%) (NH4)2SO4 (固体) 铁屑
材料:pH试纸 滤纸
四、 实验内容
称取2克的铁屑,加入15mL Na2CO3(10%)溶液煮沸5分钟,用倾析法将溶液倒掉,用水洗涤2次。加入 3mol/L H2SO430mL,盖上表面皿,用小火加热,使铁屑和H2SO4反应直至不再有气泡冒出为止。在加热过程中,就不时加入少量水,防止FeSO4晶体析出。趁热过滤,滤液用蒸发皿接收,此时溶液的pH值应在1左右。
根据FeSO4的理论产量,按照反应方程式,计算出所需(NH4)2SO4的质量。在室温下称出(NH4)2SO4并将其配制成饱和溶液,与FeSO4溶液混合均匀,用3mol/L H2SO4溶液调节pH值为1~2。用小火加热蒸发浓缩至表面出现晶膜为止,冷却,硫酸亚铁铵即可结晶出来。抽滤,用滤纸把晶体压干,观察晶体的形状和颜色。称量并计算产率。
五、 指导与思考
1. 为什么要保持硫酸亚铁溶液和硫酸亚铁铵溶液有较强的酸性?
2. 如果硫酸亚铁溶液已有部分氧化,则应如何处理才能制得较纯的硫酸亚铁铵?
3. 根据FeSO4的理论产量如何计算反应所需的(NH4)2SO4的量?
4. 除去铁屑表面油污的方法:将铁屑放在烧杯中,加入15mL 10% Na2CO3 溶液,小火加热约10分钟,用倾析法除去碱液,用水把铁屑冲洗干净。
实验二 化学反应速率、活化能的测定
一、 实验目的
1. 通过实验了解浓度、温度和催化剂对化学反应速率的影响。
2. 加深对活化能的理解,并练习根据实验数据作图的方法。
3. 练习在水浴中保持恒温的操作及秒表的使用。
4. 测定过二硫酸铵氧化碘化钾的反应速率,并求算一定温度下的反应速率常数。
二、 内容提要
在水溶液中,过二硫酸铵与碘化钾发生反应的离子方程式为:
S2O82- + 3I-= 2SO42- + I3- (1)
根据实验,该反应的反应速率和浓度的关系可用下式表示:
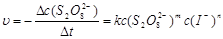 (2)
(2)
为了能够测出在一定时间(Δt)内S2O82-浓度的改变量,在混合过二硫酸铵和碘化钾溶液时,同时加入一定体积的已知浓度并含有淀粉(指示剂)的Na2S2O3溶液。因而,在式(1)进行的同时,有下列反应进行:
S2O32- + I3-= S4O62- + 3I- (3)
反应(3)进行得非常快,几乎瞬间完成,而反应(1)却缓慢得多。由反应(1)生成的I3-立即与S2O32-作用生成无色的S4O62-和I-。因此,开始一段时间内溶液呈无色,当Na2S2O3 一旦耗尽,则由反应(1)继续生成的微量碘就很快与淀粉作用,使溶液呈蓝色。
从反应方程式(1)和(3)的关系可以看出,S2O82-浓度减少的量,总是等于S2O32-减少量的一半,即:
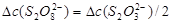 (4)
(4)
由于在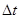 时间内S2O32-全部耗尽,所以Δ[S2O32-]实际上在数值上就是反应开始时Na2S2O3的浓度,只是差一个负号。在本实验中,每份混合液中Na2S2O3的起始浓度都是相同的,因而,Δc(S2O32-)也是不变的。这样,只要记下从反应开始到溶液出现蓝色所需要的时间(Δt),就可以求算一定温度下的平均反应速率:
时间内S2O32-全部耗尽,所以Δ[S2O32-]实际上在数值上就是反应开始时Na2S2O3的浓度,只是差一个负号。在本实验中,每份混合液中Na2S2O3的起始浓度都是相同的,因而,Δc(S2O32-)也是不变的。这样,只要记下从反应开始到溶液出现蓝色所需要的时间(Δt),就可以求算一定温度下的平均反应速率:
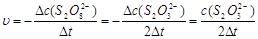 (5)
(5)
从不同浓度下测得的反应速率,即能计算出该反应的反应级数m和n。
又可从下式求得一定温度下的反应速率常数:
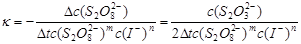 (6)
(6)
根据实验事实,阿累尼乌斯提出了反应速率常数k与反应温度T之间的经验关系式,即阿累尼乌斯方程式(指数式):
k=Ae-Ea/RT (7)
两边取常用对数, 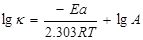 (8)
(8)
式中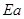 称为阿累尼乌斯实验活化能,R为气体常数,A为实验测得常数。测出不同温度时的k值,以lgk对1/T作图得一条直线,其斜率(J):
称为阿累尼乌斯实验活化能,R为气体常数,A为实验测得常数。测出不同温度时的k值,以lgk对1/T作图得一条直线,其斜率(J):
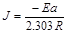 (9)
(9)
求得反应的活化能为:
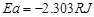 (10)
(10)
三、 仪器和药品
仪器:烧杯(50mL,洁净) 秒表 温度计(0~100℃)
药品:(NH4)2S2O8、KI、(NH4)2SO4、KNO3溶液浓度均为0.2mol/L
Na2S2O3 (0.01mol/L) 淀粉(0.2%) Cu(NO3)3 (0.02mol/L)
四、 实验内容
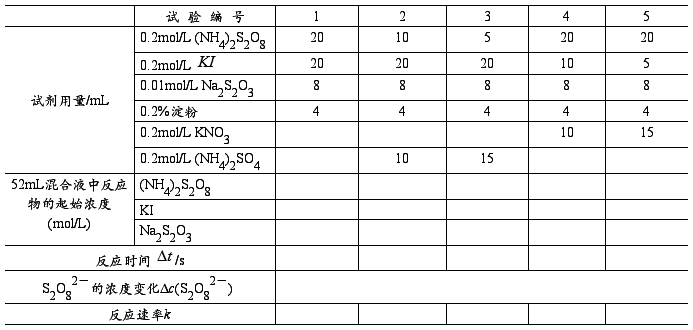
1. 浓度对反应速率的影响,求反应级数
在室温下,用3个量筒分别量取20mL0.2mol/L KI溶液、8.0mL 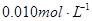 Na2S2O3溶液和4.0mL 0.2%淀粉溶液,都倒入50mL烧杯中,混合均匀、再用另一量筒量取20mL0.2mol/L (NH4)2S2O8溶液,迅速倒入烧杯中,同时按动秒表,不断搅拌,仔细观察,当溶液刚出现蓝色时,立即停止计时,将反应时间和室温记入表1中。
Na2S2O3溶液和4.0mL 0.2%淀粉溶液,都倒入50mL烧杯中,混合均匀、再用另一量筒量取20mL0.2mol/L (NH4)2S2O8溶液,迅速倒入烧杯中,同时按动秒表,不断搅拌,仔细观察,当溶液刚出现蓝色时,立即停止计时,将反应时间和室温记入表1中。
用上述方法参照表1的用量进行2~5号实验,为了使每次实验中溶液的离子强度和总体积保持不变,所减少的KI或(NH4)2S2O8的用量可分别用0.2mol/L KNO3或0.2mol/L (NH4)2SO4来调整。
表1 浓度对反应速率的影响 室温
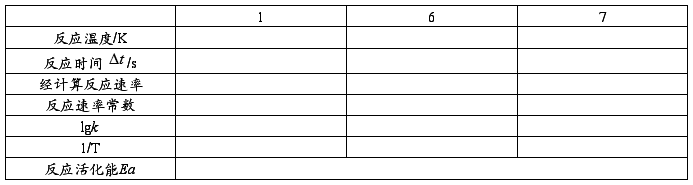
2. 温度对反应速率的影响,求活化能
按表1试验1中的用量,在50mL洁净的小烧杯中加入KI、Na2S2O3溶液和淀粉溶液,在另一小烧杯中加入(NH4)2S2O8溶液,同时放入冰水中冷却,待两种试液均冷却到低于室温10℃时,将(NH4)2S2O8迅速倒入KI等混合溶液中,同时计时并不断搅拌,当溶液变蓝时,记录反应时间。
利用热水浴在高于室温10℃的条件下,重复上述实验,记录反应时间。
表2 温度对反应速率的影响
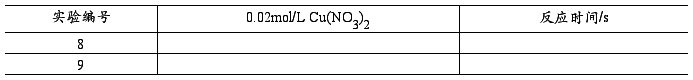
3. 催化剂对反应速率的影响
按表1试验1中的用量,在50mL洁净的小烧杯中加入KI、Na2S2O3溶液和淀粉溶液,加入1滴、2滴0.02mol/L Cu(NO3)2,将(NH4)2S2O8迅速倒入KI等混合溶液中,同时计时并不断搅拌,当溶液变蓝时,记录反应时间,填入表3中。
表3催化剂对反应速率的影响
五、 数据处理和讨论
1. 反应级数和反应速率常数的求算
把表1中试验1号和3号的结果代入下式:
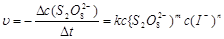
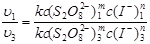
由于 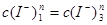 所以
所以 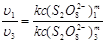
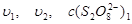 和
和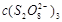 都是已知的,就可以求出m。用同样的方法把表1中试验1号和5号的结果代入,可得:
都是已知的,就可以求出m。用同样的方法把表1中试验1号和5号的结果代入,可得: 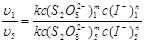
由于 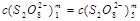 所以
所以 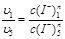
由上式可求出n。再由m和n得到反应的总级数。
数据处理得:m= ;n=
将求得的m和n代入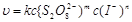 ,即可求得反应速率常数
,即可求得反应速率常数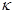 ,将计算所得k值填入表2。
,将计算所得k值填入表2。
2. 反应活化能的求算
用表2中的结果,以lgk为纵坐标,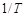 为横坐标作图,得到一条直线,此直线的斜率为
为横坐标作图,得到一条直线,此直线的斜率为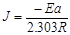 , 由此可以求出此反应的活化能Ea。
, 由此可以求出此反应的活化能Ea。
3. 结果与讨论
总结前三部分的实验结果,说明浓度、温度和催化剂如何影响反应速率。
六、 指导与思考
1. 两人为一组进行实验。两人必须分工明确,密切配合,做到溶液量准,混合迅速,不断搅拌,看准现象,准确计时。
2. 在温度对反应速率影响实验中,最好在35℃以下(温度过高,会使溶液蒸发加快,反应不准,特别是影响活化能的测定)选择三个试验温度(包括室温),并使三个温度间隔7~10℃,注意恒温控制。(NH4)2S2O8溶液与其余混合溶液在同温度下混合,反应开始时,要将反应烧杯仍置于水浴中,并控制溶液从混合到变蓝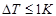 。
。
3. 该实验成败的关键之一是试剂的使用,试剂的瓶塞不能盖错,否则会导致溶液浓度不准确。
4. 根据反应方程式,是否能确定反应级数? 为什么? 试用本实验的结果加以说明。
5. 若不用S2O82-,而用I-或I3-的浓度变化来表示反应速率,则反应速率常数k是否一样?
6. 实验中为什么可以由反应溶液出现蓝色的时间长短来计算反应速率? 反应溶液出现蓝色后,反应是否就终止了?
7. 下列操作情况对实验结果有何影响?
(1) 取用三种试剂的量筒没有分开专用;
(2) 先加入(NH4)2S2O8溶液,最后加入KI溶液;
(3) 慢慢加入(NH4)2S2O8溶液。
8. 本实验Na2S2O3的用量过多或过少,对实验结果有何影响?
9. 活化能文献数据Ea=51.8kJ/mol。将实验值与文献值作比较,分析产生误差的原因。
实验三 盐酸标准溶液的配制、标定及混合碱的测定
一、实验目的:
1.学习滴定管的正确使用与滴定操作;掌握确定滴定终点的方法;
2.了解间接法配制标准溶液的方法。
3.学习用双指示剂法测定混合碱中不同组分的含量。
二、实验原理
(一) HCl标准溶液的配制与标定
酸碱滴定中常用HCl和NaOH溶液作为标准溶液,但由于浓HCl易挥发,NaOH易吸收空气中的水分和二氧化碳,因此只能用间接法配置HCl和NaOH溶液,即先配制近似浓度的溶液,然后用基准物质标定其准确浓度;也可用一已知准确浓度的HCl(NaOH)溶液标定NaOH(HCl)溶液,然后经计算求知NaOH (HCl)溶液的浓度。标定酸的基准物质常用无水碳酸钠和硼砂。
1. 用无水碳酸钠标定HCl的反应分两步进行:
Na2CO3 + HCl = NaHCO3 + NaCl ,NaHCO3 + HCl = NaCl + CO2 + H2O
当反应达到化学计量点时,溶液pH值约为3.89 ,可选用甲基红或甲基橙作指示剂。标定时应注意CO2的影响,为减小CO2的影响,临近终点时应将溶液剧烈摇动或加热,用甲基橙作指示剂时,最好进行指示剂校正。
2. 用硼砂(Na2B4O7·10H2O)标定HCl的反应如下:
Na2B4O7 + 2HCl + 5H2O = 4H3BO3 + 2NaCl
计量点时,由于产物是H3BO3(Ka1=5.8×10-10),溶液pH值约为5.1,可选用甲基红作指示剂。
(二)混合碱测定
混合碱系指Na2CO3与NaHCO3或Na2CO3与NaOH等类似的混合物,可采用双指示剂法进行分析,测定各组分的含量。
若混合碱是由Na2CO3与NaOH组成,先以酚酞作指示剂,用HCl标准溶液滴定至溶液略带粉红色,这是第一计量点,假设此时用去标准HCl溶液的体积为V1 (mL)。反应如下:
HCl + NaOH = NaCl + H2O (1)
HCl + Na2CO3 = NaHCO3 + H2O (2)
继续以甲基橙作指示剂,HCl标准溶液滴定至橙色,这是第二计量点,假设此时用去标准HCl溶液的体积为V2 (mL)。反应如下:
HCl + NaHCO3 = NaCl + CO2 + H2O (3)
由反应式可知:V1 >V2 ,且Na2CO3消耗标准酸溶液的体积为2V2 (mL);NaOH消耗标准酸的体积为(V1-V2)(mL)。于是可求得混合碱中Na2CO3和NaOH的含量。
若混合碱系Na2CO3与NaHCO3的混合物,以上述同样方法进行滴定,则V1 <V2 ,且Na2CO3消耗标准酸溶液的体积为2V1 (mL);NaHCO3消耗标准酸的体积为(V2-V1)(mL)。于是可求得混合碱中Na2CO3和NaHCO3的含量。
由以上讨论可知,若混合碱系未知组成的试样,则可根据V1与V2的数据关系,便可确定试样由何种碱组成,计算出试样中各组分的百分含量。
三、仪器与试剂
仪器:酸式滴定管,锥形瓶,洗瓶,试剂瓶(500mL),量筒(10mL),电子天平。
试剂:浓HCl(AR),硼砂(Na2B4O7·10H2O,AR,M=381.42),NaOH(AR,M=40.00),NaHCO3(AR,M=84.01),NaCO3(AR,M=105.99)甲基红(0.2%水溶液),甲基橙(0.2%水溶液)酚酞(0.2%乙醇溶液)。
四、实验步骤
1. 0.1 mol·L-1HCl溶液配制
用洁净量筒量取纯浓盐酸4~4.5mL,倒入500mL试剂瓶中,用水稀释至500mL,盖上玻璃塞,摇匀。
2. HCl标准溶液的标定
在分析天平上准确称取0.4~0.5g基准试剂Na2B4O7·10H2O两份,分别置于250mL锥形瓶中,标上瓶号,加20~30mL水溶解后,加入1~2滴0.2%甲基红指示剂,分别用HCl溶液滴定至溶液由黄色变为橙色,即为终点。记录每次滴定时消耗HCl的体积数。根据基准物Na2B4O7·10H2O的质量,计算HCl标准溶液的准确浓度。
3. 混合碱的测定
用移液管移取25mL已配好的混合碱试样溶液于锥形瓶中,加入酚酞指示剂2~3滴,以标定好的HCl标准溶液滴定至溶液由红色刚好变为微粉红色,记录下消耗HCl标准溶液的体积(V1);然后加入1~2滴甲基橙指示剂,继续滴定至溶液由黄色恰好变为橙色,记录下第二次用去HCl标准溶液的体积(V2),平行做2~3次。
根据HCl标准溶液的浓度和所消耗的体积(V1与V2),判断试样的组成,并计算各组分的百分含量。
五、结果与讨论
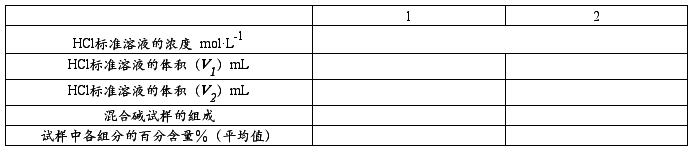
1. HCl标准溶液的标定结果

2. 混合碱的测量结果 混合碱试样标号:
六、思考题
1. 用双指示剂法测定混合碱组成的方法原理是什么?
2. 0.04g NaOH和0.06g Na2CO3混合物,用0.1 mol·L-1 HCl溶液滴定时V1和V2各为多少mL?
3. 20mL NaOH与Na2CO3混合溶液,以酚酞作指示剂,用去0.1 mol·L-1HCl溶液15mL,加入甲基橙指示剂后,继续滴定又用去0.1 mol·L-1HCl溶液15mL,问NaOH与Na2CO3在此混合液中的浓度是否相等?各等于多少?
-
大学化学实验报告模板
物理化学实验报告院系班级学号姓名实验名称姓名日期成绩实验名称姓名日期成绩实验名称姓名日期成绩实验名称姓名日期成绩实验名称姓名日期成…
- 大学化学实验报告格式
-
浙江大学化学实验报告模板
实验报告课程名称指导老师成绩实验名称实验类型同组学生姓名一实验目的和要求必填三主要仪器设备必填五实验数据记录和处理七讨论心得一实验…
-
无机化学实验报告格式
无机化学实验报告格式无机化学实验一般都被设置成大学一年级的课程对于新入大学的学生要想完成一份满意的实验报告真是有一定的难度另外由于…
-
西安交通大大学 化学实验报告模板
西安交通大学化学实验报告第页共页课程实验日期年月日专业班号组别交报告日期年月日姓名学号报告退发订正重做同组者教师审批签字实验名称化…
-
大学生物化学实验报告标准格式汇总
生物化学实验报告班级姓名实验一血清蛋白质醋酸纤维薄膜电泳目的原理仪器组成操作与结果结果粘贴实验二酶的特异性目的原理操作与结果将以上…
- 大学化学实验报告格式
-
大 学 化 学 实 验 报 告
大学化学实验报告综合性实验学院班级学号姓名扬州大学化学实验教学中心20xx年9月综合性实验报告班级姓名组别实验名称实验日期实验目的…
-
大学化学实验报告模板
物理化学实验报告院系班级学号姓名实验名称姓名日期成绩实验名称姓名日期成绩实验名称姓名日期成绩实验名称姓名日期成绩实验名称姓名日期成…
-
大学化学实验报告
大学化学实验报告专业班级学号姓名基础化学实验中心实验名称实验时间年月日学生姓名同组人姓名第一部分实验预习报告一实验目的二实验原理三…
-
化学探究实验报告2
化学探究实验报告(实验B)实验名称:白醋中的鸡蛋实验目的:探究鸡蛋泡在白醋中所发生的化学变化实验过程:1,将一枚鸡蛋放入一只干净的…