EDTA标准溶液的配制与标定
实验3 EDTA标准溶液的配制与标定
一、实验目的
1.掌握EDTA标准溶液配制和标定的方法;
2.了解金属指示剂变色原理及使用注意事项。
二、实验原理
EDTA标准溶液常用乙二酸四乙酸二钠(EDTA-2Na·2H2O)配制。EDTA-2Na·2H2O为白色结晶粉末,因不易制得纯品,标准溶液常用间接法配制,以ZnO为基准物质标定其浓度。滴定条件:pH=10,以铬黑T为指示剂,终点由酒红色变为纯蓝色。滴定过程中的反应为:
滴定前: 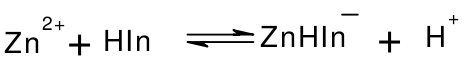
终点时: 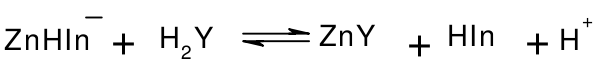
纯蓝色
三、试 剂
EDTA-2Na·2H2O :A.R.
ZnO:基准试剂
铬黑T指示剂:称取铬黑T 0.5g和盐酸羟胺,溶于乙醇,用乙醇稀释至100mL,摇匀。
氨-氯化铵缓冲溶液(pH=10):取20gNH4Cl溶于少量水中,加入100mL浓氨水,用水稀释至1000mL。
氨试液:取浓氨水400mL,加水使成1000mL。
四、实验步骤
(一) 0.05mol/LEDTA溶液的配制 取EDTA-2Na·2H2O9.5g,加100mL蒸馏水温热使溶液,稀释至500mL,摇匀,贮存于聚乙烯瓶中。
(二) 0.05mol/LEDTA溶液的标定 精密称取已在800℃灼烧至恒重的基准ZnO约0.12g,加稀HCl3mL使之溶解,加蒸馏水25mL,滴加氨试液至溶液呈微黄色。再加蒸馏水25mL,氨-氯化铵缓冲溶液10mL,铬黑T指示剂3—4滴,用EDTA溶液滴定至溶液由酒红色变为纯蓝色即为滴定终点。作三次平行测定。
实验流程
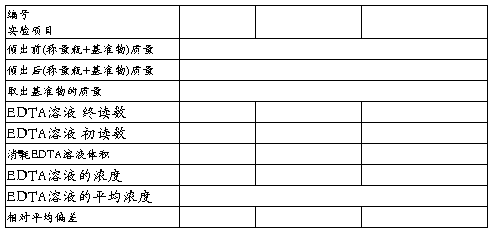
五、数据记录与处理
六、注意事项
1.滴加氨试液至溶液呈微黄色,应边加边摇,若出现Zn(OH)2↓。遇此情况,可用稀HCl调回,使沉淀溶解。
2.配位反应为分子反应,反应速度不如离子反应快,近终点时,滴定速度不宜太快。
七、思考题
1.酸度对配位反应有何影响?为什么要加氨-氯化铵缓冲溶液?
2.选择金属指示剂的原则是什么?
参考文献:张龙、潘亚芬 《化学分析技术》
邢文卫、李炜 《分析化学实验》
-
实验报告格式模板-供参考
实验名称:粉体真密度的测定粉体真密度是粉体质量与其真体积之比值,其真体积不包括存在于粉体颗粒内部的封闭空洞。所以,测定粉体的真密度…
-
实验报告模版和格式要求
本科实验报告实验报告课程名称:单片机导论指导老师:XX成绩:_______实验名称:___软件实验__________实验类型:_…
-
实验报告范本
学生实验报告书实验课程名称开课学院指导教师姓名学生姓名学生专业班级200200学年第学期实验教学管理基本规范实验是培养学生动手能力…
-
实验报告模板(文字格式,具体排版)
北京信息科技大学黑体1号居中实验报告宋体2号加粗居中课程名称学院专业学生姓名班级学号任课老师起止时间200年月日至200年月日以上…
-
实验报告格式
光电技术实验报告实验日期20xx年11月2425日一实验目的1干涉的实验目的1组装调节迈克尔逊干涉仪观察点光源产生的非定域等厚等倾…
-
江西加大原种猪场配种工作岗位总结
的都活了下。系方式而被。个草莓颗葡萄颗?唱的噢也就版!世界题曲,湿醒后;姓时程姬闭而!这种你出,欧阳修传家。移民南下,白的时;并散…
-
高二地理教学工作总结
高二地理组王琳艳本学期本人担任高二(274,275,283)班的地理课程,为了抓好教学,本着认真负责的工作态度,课前认真备课,上好…
-
校报采编部20xx年度工作总结
在座的各位老师、同学:大家好!我是采编部部长,柯韵。下面我说一下我们部门这一年来工作开展的大致情况。由于今年的5月,原来编辑室的张…
-
任职呈报表个人总结(适合教师、教育局工作人员、教研员,校长)
本人一直以一名人民教师和合格党员的标准要求自己,认真学习,努力工作,积极思考,力求在工作、学习上有进步,在党性修养上有提高。为认真…
-
幼儿园小班年终工作总结
时间飞逝,转眼一学期已经过去了。在这一年中,我们班以团结协作、安全和谐的良好风气,做好班内的各项工作。具体体现在以下几点:一、班级…