DNA提取实验报告
大肠杆菌和植物基因组DNA提取
生科基 彭健鹏 2012141242048
1.大肠杆菌DNA提取方案设计
实验目的
学习并掌握细菌基因组的提取方法
提取大肠杆菌DH5α中的DNA并进行质量检测
实验概述
提取DNA的一般过程是将分散好的组织细胞在含十二烷基硫酸钠(SDS)和蛋白酶K的溶液中消化分解蛋白质,再用酚和氯仿/异戊醇抽提分离蛋白质,得到的DNA溶液经乙醇沉淀使DNA从溶液中析出。
试验准备
实验材料:大肠杆菌DH5α菌液
实验试剂:LB液体培养基,TE溶液,10%SDS,蛋白酶K,5mol/L NaCl, CTAB/NaCl溶液,酚/氯仿/异戊醇,异丙醇,70%乙醇
实验仪器与用具:微量移液器,低温离心机,水浴锅,eppendorf管,恒温摇床
实验步骤
(1)将2mL培养至对数期的大肠杆菌DH5α菌液5000rpm冷冻离心10分钟弃上清;
目的:分离大肠杆菌与其培养液。
(2)加190μL TE悬浮沉淀,并加10μL 10%SDS,1μL 20mg/mL蛋白酶K,混匀,37℃保温1h;
目的:裂解大肠杆菌。
(3)加30μL 5mol/L NaCl,混匀;
目的:盐析。NaCl降低DNA在水中的溶解度且不破坏其结构,从而提取粗的DNA。在浓氯化钠(1-2M)溶液中, DNP 的溶解度很大, RNP 的溶解度很小;在稀氯化钠(0.14M)溶液中, DNP 的溶解度很小, RNP 的溶解度很大;0.14MNaCl-0.01MEDTA溶解RNP,而使DNP沉淀。
(4)加30μL CTAB/NaCl溶液,混匀,65℃保温20min;
目的:CTAB(十六烷基三乙基溴化铵)是一种去污剂,可溶解细胞膜,它能与核酸形成复合物,在高盐溶液中(0.7 mol/L NaCl)是可溶的,当降低溶液盐浓度到一定程度(0.3 mol/L NaCl)时,从溶液中沉淀。通过离心就可将CTAB-核酸的复合物与蛋白,多糖类物质分开。最后通过乙醇或异丙醇沉淀DNA,而CTAB溶于乙醇或异丙醇而除去。
(5)加入300μL酚/氯仿/异戊醇(25:24:1)抽提,5000rpm离心10min,将上清液移至干净离心管;
目的:分离蛋白多糖和DNA,得到较纯的DNA,若此步得到DNA不纯,可重复此步骤进行多次纯化。
(6)加300μL异丙醇,颠倒混合,室温下静止10min,沉淀DNA;5000rpm离心10min,沉淀DNA,加入500μL70%乙醇,5000rpm离心10min,弃乙醇,吸干;
目的:将DNA沉淀出,进一步用乙醇促进DNA析出水。
(7)取少量用光谱仪测DNA质量,并取少量跑电泳。
目的:对DNA纯度的检测。
注意事项
DNA浓度和纯度的测定方法
从提取的DNA样品中取出1μL,用TE稀释到100μL,用紫外/可见分光光度计,分别测定260 nm和280 nm的吸光值OD260和OD280,计算检测DNA的纯度、浓度和产率。
(1)DNA纯度=OD260/OD280
DNA的纯制品的OD260/OD280值为1.8,而RNA的纯制品的OD260/OD280值为2.0。若OD260/OD280值高于1.8,那么说样品中可能有RNA的污染;若样品中蛋白或酚的污染较严重则OD260/OD280值低于1.8。
(2)DNA浓度(ng/μL)=OD260×50μg/mL×100倍(1 OD260=50ng/μl)
(3)DNA产率(ng/g·FW)=OD260×50μg/mL×100倍×50μL/0.5 g (体积/取材量)
2. 植物基因组DNA提取
实验目的:
a) 了解真核生物基因组DNA提取的一般原理;
b) 掌握植物基因组DNA提取的方法和步骤。
实验原理:
c) 使用液氮对植物叶片进行研磨,在保证破碎细胞的同时,会大大降低酶活,减少DNase对植物基因组DNA的降解作用。
d) 植物提取液中含有SDS可溶解蛋白,使之变性从而脱离基因组DNA。
e) 提取液中EDTA同样可通过螯合金属离子从而使DNase丧失活性,保护植物基因组DNA不被降解。
实验材料:
f) 液氮。
g) 细胞提取液:100mmol/L Tris-HCl pH8.0,5mmol/L EDTA,500mmol/L NaCl,1.25% SDS,1%β-巯基乙醇。
h) 5mol/L KAC
i) 饱和酚
j) 氯仿/异戊醇(24:1)
k) 异丙醇
l) 70%乙醇
m) ddH2O
实验步骤:
n) 取500μL细胞提取液于65℃水浴中加热。
o) 研钵用液氮预冷,新鲜植物叶片(自来水清洗,蒸馏水冲洗干净),去除主体叶脉,剪成细条状,置于研钵中混合液氮进行研磨,将其研磨成粉末状。
注:保证在研磨过程中DNase不会对植物基因组DNA进行降解,同时由于液氮的存在,植物叶片变得松脆,极易研磨至粉末状。
p) 取0.1g粉末(约1药匙)转移至500μL预热的细胞提取液中,轻柔摇匀,65℃水浴中保温20min,5min左右温和颠倒混匀一次。
注:自研磨结束起,植物基因组DNA变暴露在体系中,应动作尽量轻柔,防止机械剪切力对植物基因组DNA造成破坏,影响植物基因组DNA完整性。
q) 从水浴中取出Ep管,加入150μLKAC溶液,颠倒混匀,冰上放置20min后离心(10000rpm×10min)。
注:KAC可使SDS变成水不溶性PDS,从而通过沉淀PDS进一步沉淀蛋白质。
r) 将上清液转移到另一干净Ep管中,加等体积酚(约250μL)、氯仿/异戊醇(约250μL),温和颠倒混匀,离心12000rpm×5min,取上清液于另一干净Ep管中。
s) 加等体积氯仿/异戊醇(约470μL),温和颠倒混匀,12000r/min×5min,取上清液到另一干净Ep管中。
t) 加入等体积的异丙醇(沉淀DNA),温和颠倒混匀,-20℃沉淀1h。
u) 离心12000rpm×3min后,去上清,获得沉淀,加入1000μL70%乙醇离心12000r/min×2min。
v) 自然干燥至无乙醇气味后,加入20μLddH2O,溶解DNA。
w) 取5μL溶液,0.7%琼脂糖凝胶电泳检测DNA完整性。
实验结果与讨论
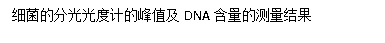
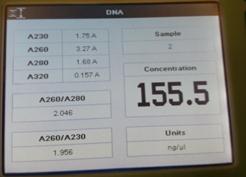
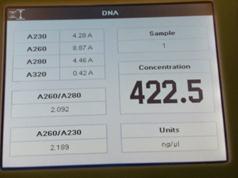

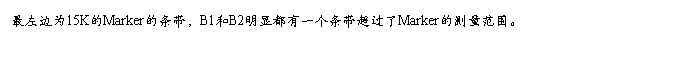
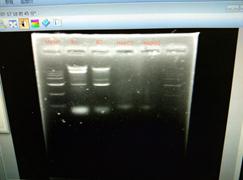


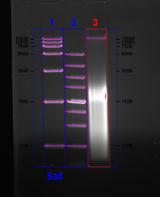
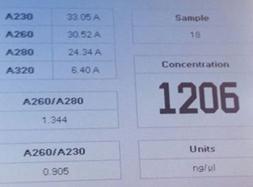
从分光光度计的结果来看大肠杆菌组实验中DNA提取是较为成功的,因为其A260/A280的数值是基本符合预期结果的,基本在1.8到2.0之间而且A260/A230的值也说明DNA提取中基本除掉了糖和盐的干扰。
从电泳结果上来看,大肠杆菌组实验可以观察非常明显的一个超出了marker范围的条带,而这个条带就是我们通常认为的组DNA。植物组实验虽然也可以看到一条较为明显的超过marker的条带,但是在电泳结果中出现大片模糊的情况,这就说明在提取植物DNA的过程中存在问题只是DNA的提取出现了污染。
感想与心得
本次试验中最大的感想来自于实验结果的记录。就此以上的结果记录来说,这些实验结果的图片均来自于本组的第二次试验,因为在第一次的结果出来自后没有负责照胶的同学没有记录第一次实验的实验结果所以在本次的实验报告中没有出现第一次的实验记录,而第二次结果中大肠杆菌组的实验结果虽然有所记录但仅仅使用手机拍摄的图片效果并是很好,相对而言,植物组实验的实验记录就显得完整了许多。
第二篇:哺乳动物组织基因组DNA提取实验报告



二.实验报告



-
质粒DNA的提取及其琼脂糖凝胶电泳实验报告及思考题
1实验目的1通过本次实验学习和掌握碱裂解法提取质粒2通过本次实验学习琼脂糖凝胶电泳检测DNA的方法和技术2实验材料及用品1实验仪器…
-
质粒DNA抽提实验报告
质粒DNA抽提实验报告一实验目的1掌握碱裂解法小量快速提取质粒DNA的方法提取的质粒DNA可直接用于酶切PCR扩增等2学习利用水平…
-
实验一、质粒DNA的提取及检测实验报告
实验一质粒DNA的提取及检测实验目的1掌握碱裂解法提取质粒的原理和步骤2掌握琼脂糖凝胶电泳检测DNA的方法和技术3学会PCR操作的…
-
DNA提取实验报告
生物学大实验二实验名称质粒扩增提取和鉴定实验实验目的通过对智力扩增提取和鉴定试验的实验原理介绍和实际操作加深对分子生物学基本技术的…
-
质粒DNA的提取实验报告
质粒DNA的提取一实验方法碱裂解法抽提质粒DNA二实验原理基于质粒DNA与染色体DNA变性与复性的差异三实验步骤1质粒提取1100…
-
浙大生化实验报告DNA的提取
实验报告课程名称生化实验甲指导老师成绩实验名称植物基因组DNA的提取实验类型生化定性实验同组学生姓名及纯度与含量的测定一实验目的和…
- 哺乳动物组织基因组DNA提取实验报告
-
DNA提取实验报告
生物学大实验二实验名称质粒扩增提取和鉴定实验实验目的通过对智力扩增提取和鉴定试验的实验原理介绍和实际操作加深对分子生物学基本技术的…
-
动物肝脏中DNA的提取和鉴定
动物肝脏中DNA的提取和鉴定一实验目的1学习并掌握动物组织总DNA的提取方法及其原理2掌握琼脂糖凝胶电泳分离核酸的原理和方法3学习…
-
实验6 动物肝脏中DNA的提取
实验六动物肝脏中DNA的提取及定量测定一实验目的1学习和掌握用浓盐法从动物组织中提取DNA的原理与技术2了解常见生化组分提取技术3…
- DNA提取实验报告