铁的比色测定实验报告
铁的比色测定实验报告
试验时间:2014.05.09 报告人:武伟
一、 目的要求
1. 了解仪器分析。
2. 学习比色法用比色法测定绘制标准曲线、测定试样浓度的方法。
3. 了解分光光度仪的性能、结构及使用方法。
二、 实验原理
u 仪器分析:英文:instrument analysis,仪器分析是指采用比较复杂或特殊的仪器设备,通过测量物质的某些物理或物理化学性质的参数及其变化来获取物质的化学组成、成分含量及化学结构等信息的一类方法。仪器分析与化学分析(chemical analysis)是分析化学(analytical chemistry)的两个分析方法
仪器分析的主要特点:

u 比色法是根据朗伯—比尔定律发明的,朗伯比尔定律告诉我们,溶液的吸光度和溶液的厚度以及溶液的浓度乘积成正比,如果控制溶液的厚度相同,吸光度就和溶液的浓度成正比,这样我们就可以通过测量溶液的吸光度来进一步推算溶液的浓度。
吸光度在测量时是采用和空白溶液的比值,首相测量一系列已知浓度的溶液的吸光度,绘制吸光度—浓度标准曲线,然后测量未知浓度的吸光度,再在标准曲线上找到对应的浓度值,完成测定。
u 分光光度仪的使用方法:
1) 在比色皿中装入2/3体积的溶液,第一个要装空白的溶液。
2) 打开分光光度仪,盖好上盖,调节好光波长,调节分光光度仪让空白组的吸光度为零,然后拉动分光光度仪前端转换测量的手柄,依次测量不同组别的吸光度。
3) 对应记录已知溶液和未知溶液的分光度,处理数据,计算未知溶液的浓度。
注意:
a) 拿取比色皿时,只能用手指接触两侧的毛玻璃,避免接触光学面。同时注意轻拿轻放,防止外力对比色皿的影响,产生应力后破损。
b) 凡含有腐蚀玻璃的物质的溶液,不得长期盛放在比色皿中。
c) 不能将比色皿放在火焰或电炉上进行加热或干燥箱内烘烤;。
d) 当发现比色皿里面被污染后,应用无水乙醇清洗,及时擦拭干净。
e) 不得将比色皿的透光面与硬物或脏物接触。盛装溶液时,高度为比色皿的2/3处即可,光学面如有残液可先用滤纸轻轻吸附,然后再用镜头纸或丝绸擦拭。
u  亚铁离子在pH=3
亚铁离子在pH=3 9的水溶液中与邻菲啰呤生成稳定的橙红色的[Fe(C12H8N2)3]2+,本实验就是用它来比色测定亚铁离子的含量。如果用盐酸羟胺还原溶液中的高铁离子,则此法还可以用来测定总铁含量,从而求出高铁离子的含量。
9的水溶液中与邻菲啰呤生成稳定的橙红色的[Fe(C12H8N2)3]2+,本实验就是用它来比色测定亚铁离子的含量。如果用盐酸羟胺还原溶液中的高铁离子,则此法还可以用来测定总铁含量,从而求出高铁离子的含量。
u 药品说明:
邻菲啰呤
中文名称: 1,10-菲罗啉
中文别名: 邻菲罗啉又叫邻二氮菲
英文名称: 1,10-Phenanthroline monohydrate
英文别名: 1,10-Phenanthroline hydrate
分子量: 198.22
危险品标志: T N 说明
风险术语: R25; R50/53; (吞食有毒;对水生生物有极高毒性,可能在水生环境中造成长期不利影响;)
安全术语: S45; S60; S61(若发生事故或感到不适立即就医;该物质及其容器需作为危险性废料处理;避免释放到环境中。)
主要用途:邻菲罗啉与亚铁离子在pH4~5的条件下生成桔红色络合物,然后用分光光度法测定铁含量。
物理化学性质:一水合物为白色结晶性粉末。熔点93~94℃,无水物熔点为117℃,溶于300份水,70份苯,溶于醇和丙酮。
能与多种过渡金属形成配合物,由于形成的配合物为螯合物,所以较为稳定。与铜形成的配合物及其衍生物因为对DNA有一定的切割活性,可以用作非氧化性核酸切割酶,进而有一定的抗癌活性。
盐酸羟胺
中文名称:盐酸羟胺
中文别名:盐酸胲; 羟基氯化胺; 氯化羟胺; 羟基氯化铵; 氢氯羟胺; 羟胺酸; 羟胺盐酸
英文名称:Hydroxylamine hydrochloride
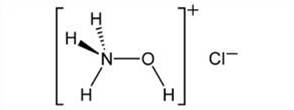 Hydroxylammonium chloride
Hydroxylammonium chloride
Oxammonium hydrochloride
分子结构:HO-NH2·HCl
分子式:HONH3Cl;
分子量:69.4
理化性质:
无色结晶,易潮解,密度:1.67。熔点:152℃(分解)。 溶于水,乙醇、甘油,不溶于乙醚。无色单斜晶系结晶体。密度1.67 g/cm3(17℃)溶于热水、醇、丙三醇,不溶于醚。吸湿性强,受潮高于151℃则分解。
毒性:本品有毒,对皮肤有刺激性。半数致死量(小鼠经口)408 mg/kg。有腐蚀性。生产设备应密闭,防止跑、冒、滴、漏,操作人员应穿戴防护用具。溅及皮肤时,可用大量水冲洗。
三、 实验试剂
邻菲啰呤水溶液(ω=0.0015) 盐酸羟胺水溶液(ω=0.10,此溶液只能保持数日) NaAc溶液(1 mol/L) HCl溶液(6 mol/L) NH4Fe(SO4)2标准溶液(10 mg/L)
四、 实验内容
i. 实验步骤
1) 标准曲线的绘制
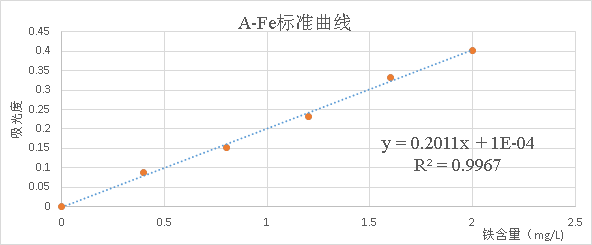
在五只50 mL的容量瓶中,用吸量管分别加入0.00,2.00,4.00,6.00,8.00,10.00 mL NH4Fe(SO4)2标准溶液。然后再加入5 mL 1mol/LNaAc溶液,2 mL邻菲啰呤水溶液,配制一系列浓度梯度溶液。
在510 nm的波长下,用2 cm比色皿,以试剂空白做参比测其吸光度,并以铁含量为横坐标相对应的吸光度为纵坐标,绘出A—Fe含量标准曲线。
2) 总铁含量的测定
吸取25.00 mL被测试液代替标准液,其余步骤同上,测出其吸光度,和标准曲线进行对比。
3) 亚铁含量的测定
不加盐酸羟胺,步骤同上。
ii. 数据处理
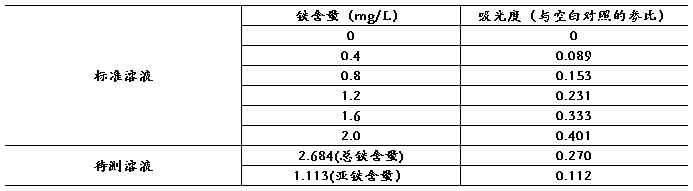
 附:公式及计算过程
附:公式及计算过程
根据吸光度和铁含量的关系公式,可以计算出:
c(Fe2+) = 2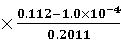 = 1.113 mg/L c(Fe) =
= 1.113 mg/L c(Fe) = 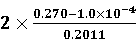 = 2.684 mg/L
= 2.684 mg/L
五、 思考题
1. 从实验测出的吸光度求铁含量的根据是什么?
答:根据朗伯比尔定律,吸光度和溶液厚度以及溶液浓度的乘积成正比,我们控制溶液的厚度相同,测得的吸光度就和溶液的浓度成正比,通过和已知试液的吸光度的对比,就可以推算出位置试液的吸光度。
2. 如果试液测得的吸光度不再标准曲线范围之内怎么办?
答:将试液按照确定比例稀释,使稀释后的溶液在标准曲线的范围以内,然后在根据比例推算原来溶液的浓度。在本次试验中,测定总铁含量和亚铁含量都是有稀释两倍的。
3. 如试液中含有某种干扰离子,它在测定波长下也有一定的吸光度,该如何处理?
答:调换检测波长;将干扰离子除去在检测;或衍生化样品,改变其吸收波长。
六、 心得体会
时光匆匆而过,一转眼一学期的实验就过去了,我跟朋友开玩笑说,这学期什么都没有留下,就留下了好多的实验报告,足见这些实验在我生活中的比重。在众多的实验中,无机与分析实验,又是最为印象深刻的一个,不仅仅是因为在这个实验上花的时间比较多(其他的实验一个是果蝇杂交实验,主要是到时间了换一下培养管,等待后代出现,还有就是有机寥寥数周的实验),我同时深深的感觉到,这是我最快乐的一个实验,我很喜欢课上的氛围,甚至慢慢喜欢上了呆在那间实验室,这也是我很期待的时光。
分析化学是一个很精细的项目,很多教科书上一笔带过的东西,到了实际的实验中都是不可缺少的环节,真的很帮助人提高细致的素养,不管你做什么,这都是需要的。回想起初的刚做实验时的不知所措,到后来慢慢从容,再到最后的享受实验过程,就像你爱上了一个人,一开始你不了解她的时候,跟人家在一起会紧张,后来慢慢熟悉了,就什么都可以聊得开了,再到后来进入臻境,浑然天成,“有时候会突然忘了,我依然爱着你”。而这几乎又是所有发现,成长,获得的过程,我没那么厉害,可以透过一粒沙看到整个世界,但是至少现在透过一个实验看到了生活。
大半张白纸不能浪费了不是?有的没的还得写下去。
那天被老师问到“我这个老师怎么样”,我的回答是“很贴心”,咱今天就好好唠唠这个话题。
咱先夸夸你们博士这伙人,就拿我接触过的人来说,我感觉虽然都是研究生,博士的水平要比硕士高出一个明显可见的水平,博士这群人吧,言谈举止之中都透露着一种知识上的厚度,而且博士们都带给了我一种豁达中不失智慧的感觉,感觉它们对付问题很轻松,但是我后来想想明白,或许不是他们看起来很轻松,或许是他们更努力,他们并不是用相同的时间把事情做的更好,或许是下了更大的功夫,人和人的智力能相差多少呢,或许不是博士们都很努力认真细致,而是因为他们认真细致努力,他们才成为了博士。
说完了博士们,再说说您这个博士。我觉得您一定是一个很热爱生活的人,如果不是,那您也一定是一个很会苦中作乐的人。我知道,您自己的项目也并不轻松,但是还是肯花那么多时间等那些很慢很慢的同学,肯花那么多时间给我们那么细致地改报告,那么细致的交代给我怎么用word做出一份很好看的东西来,这是很让人感动的,做的再不好也没有被抛弃的感觉,学生们自然自己也就不会放弃,不会应付。记得有一次有机实验,鲁福身老师出去了,有一个老师给我们上了一次实验,超凶的,这也不是,那也不是,很多人做着做着就开始应付完了了事,做是做完了,有用吗?没用!说好夸你的,又想说我自己了。我自己感觉我不仅仅是学会了怎么写实验报告,我觉得我学会了怎么写报告,那些要反映出来,报告要写成让一个陌生人一看就懂的东西,因为报告是要给别人看的,不仅仅是给自己看的等等。这不再是一个无聊的抄书的过程,而且我也最讨厌没有实质内涵的东西,在做报告的时候,我要想怎么改进,怎么表达架构更合理,这就是一种收获。
说的也够多的了,肯定又要花老师好多时间去看我这份又臭又长的报告,但是我决定停笔还是有另外一个原因的,我怎么不可以不给老师留个写评语的地方呢?哈哈!
第二篇:食品中铁的测定(邻菲罗啉比色法)实验报告
食品中铁的测定(邻菲罗啉比色法)
1 目的
熟练掌握直接灰化法的原理,操作及注意事项。以铁的测定为代表,掌握灰化法作为矿物质测定的前处理方法的应用;掌握消化法的原理,操作及注意事项。以铁的测定为代表,掌握消化法作为矿物质测定的前处理方法的应用;掌握邻菲罗啉比色法测铁的原理、操作及注意事项。
2 原理
2.1 灰化
食品经高温灼烧至恒重,残留物称重称为灰分;
2.2 消化
样品与浓硫酸和催化剂一同加热,可使蛋白质分解,其中碳和氢被氧化成二氧化碳和水逸出,食品中的有机氮转化为氨与硫酸结合成硫酸铵;
2.3 比色法测铁
样品经灰化(或消化),用抗坏血酸将三价铁还原为二价铁,二价铁与邻菲罗啉反应生成红色络合物,在520nm下测其光吸收强度A,根据A值在标准曲线上查对应二价铁浓度得C样,再计算样品中铁的含量。
3 试剂
硫酸铜、硫酸钾、浓硫酸、邻菲罗啉、铁标准溶液(C=10ug/mL)。
4 仪器
4.1 灰化:瓷坩埚、灰化炉、干燥器、精密天平;
4.2 消化:定氮瓶、铁架台、电炉;
4.3 比色法测铁:水浴锅、可见光分光光度计、25mL比色管。
5 样品
学生营养奶粉
6 操作方法
6.1 样品的灰化处理及样品中灰分的测定
6.1.1恒重处理
取大小适宜的两个瓷坩埚(标号1、2)置于高温炉中,在600℃下灼烧0.5h, 冷却至200℃以下后,取出,放入干燥器中冷却置室温,精密称量,并重复灼烧至恒重。
6.1.2 样品称量
分别向1、2号瓷坩埚中加入奶粉5.0001g和5.0000g后,精密称量。
6.1.3 预灰化
把两个坩埚置于电炉上,半盖坩埚盖,以小火加热至样品充分炭化无黑烟产生,取下坩埚,各加入两滴HNO3溶液。
6.1.4 正式灰化
炭化后,把两个坩埚放置在600℃高温炉中灼烧至无炭粒,打开炉门,将坩埚移至炉口处冷却至200℃左右,放入干燥器中冷却至室温,称量。重复灼烧至前后两次称量之差不超过0.5mg为恒重。
6.1.5制备灰化液
分别向1、2号坩埚中加入盐酸2mL溶解,并移入100mL容量瓶中,用少量水洗坩埚,洗液并入容量瓶中,再加水至刻度,混匀,制成1、2号灰化液备用。
6.1.6 制备空白液
向100mL容量瓶中加入2mL盐酸,以水定容至刻度。
6.2 样品的消化处理
6.2.1 制备消化液
称取5.1300g奶粉移入干燥的100mL定氮瓶中,加入0.2g硫酸铜,2g硫酸钾及20mL浓硫酸,稍摇匀后于瓶口放一小漏斗,将瓶以45°角斜放于加有石棉网的电炉上,小火加热,待内容物全部炭化,泡沫完全消失后,加强火力,并保持瓶内液体微沸,至液体呈蓝绿色澄清透明后,在继续加热0.5h.取下放冷,慢慢加入20mL水。放冷后,移入100mL容量瓶中,并用少量水洗定氮瓶,洗液并入容量瓶中,再加水至刻度,混匀,制成消化液备用。
6.2.2 制备空白液
向100mL容量瓶中加入20mL蒸馏水,以水定容至刻度。
6.3 比色法测铁
6.3.1 铁标准曲线的绘制
分别吸取铁标准溶液0.00、2.00、4.00、6.00、8.00、10.00ml放入比色管中,加入1ml 抗坏血酸和2ml邻菲罗啉,并定容至25mL,混匀,然后60℃水浴下加热15min后,冷却。
以“0”管溶液为参比溶液,在520nm下测各管A值并绘制曲线。
6.3.2 灰化液中铁含量的测定
分别从1、2号各吸取3个10.00mL灰化液和1个10.00mL空白液于比色管中,加入1mL抗坏血酸和2mL邻菲罗啉,并定容至25mL,混匀,然后60℃水浴下加热15min后,冷却。
参比溶液:吸取10.00mL灰化液于比色管中,加入1mL抗坏血酸,不加邻菲罗啉,并定容至25mL,混匀,然后60℃水浴下加热15min后,冷却。
将比色管中的有色溶液依次注入比色皿中,在520nm下测各管的吸光度。1号记为:A灰1 A灰2 A灰3 A灰空;2号记为A灰1´ A灰2´ A灰3´ A灰空´。
6.3.3 消化液中铁含量的测定
吸取3个10.00mL消化液及1个10.00mL空白液于比色管中,加入1mL抗坏血酸和2mL邻菲罗啉,并定容至25mL,混匀,然后60℃水浴下加热15min后,冷却。
参比溶液:吸取10.00mL消化液于比色管中,加入1mL抗坏血酸,不加邻菲罗啉,并定容至25mL,混匀,然后60℃水浴下加热15min后,冷却。
将各比色管中的有色溶液依次注入比色皿中,在520nm下测各管溶液的吸光度值A消1 A消2 A消3 A消空。
7 数据整理
7.1 样品中灰分的测定
表1-灰化样品及坩埚质量

7.2 比色法测铁
7.2.1 铁标准曲线的绘制
表2-铁标准溶液曲线绘制测定数据表

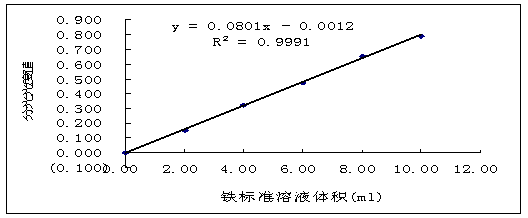
图1-铁标准溶液曲线
7.2.2灰化液中铁含量的测定
表3-灰化液铁的吸光度值

7.2.3 消化液中铁含量的测定
表4-消化液铁的吸光度值

8 计算
8.1 消化计算
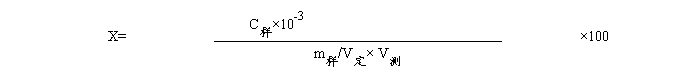
式中:X----样品中铁的含量,mg/100g;
C样----测定用液中铁的浓度(由标准曲线中查出),μg/mL;
m样-----样品的质量,g;
V测-----测定用液的体积,mL。
消除试剂误差得三个吸光度值为0.0233、0.0414、0.0293代入铁的标准曲线方程y=0.0801x-0.0012中,得x1=0.306、x2=0.531、x3=0.381。
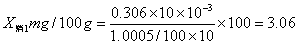
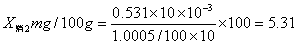
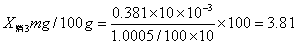
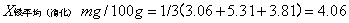
8.2灰分含量计算
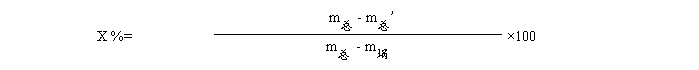
式中:X----样品中灰分的含量,%;
m埚-----坩埚的质量,g;
m总-----坩埚和样品的质量,g;
m总’--坩埚和灰分的质量,g。

8.3中铁含量计算
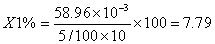
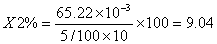
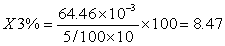
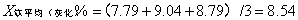
9 结果
样品中铁含量为4.64mg/100g。铁中灰分含量为40.00%,灰化的样品中铁含量为8.54%
10结果可靠性分析
10.1准确度
从营养奶粉包装上查得真值在6-10mg/100g,灰化处理的准确度高,消化处理的准确度低。
10.2精密度
消化的相对标准偏差为28.2%,灰化的相对标准偏差为7.5%。灰化精确度较高,消化精确度过低。
10.2.3 误差分析
灰化处理的样品准确度、精密度高,主要属于随机误差;消化处理的样品误差大,是负误差,也是系统误差。
11结论
样品中铁含量为4.64mg/100g。铁中灰分含量为40.00%,灰化的样品中铁含量为8.54%灰化处理的准确度、精密度较消化处理高。消化处理误差为负的系统误差。
12思考题
12.1灰化的目的?
防止因温度高试样中的水分急剧蒸发,使试样飞扬;防止糖蛋白质等发泡膨胀的物质在高温下膨胀而溢出坩埚,不经碳化而直接灰化,碳粒易被包住灰化不完全。
12.2本试验用于提高灰化速度的方法?除此之外还有那些方法?
本试验中是通过加过氧化剂或强氧化剂的方法,加的是浓硝酸,利用他们的氧化作用来加速碳化。 还可以通过,加去离子水,加硫酸灰化,加入砂分散样品,还可以加入镁盐起固定剂的作用。
12.3如果A值过高或过低即超出正常读数范围时,应如何调整?
如果过高需要稀释一定的倍数重新测量。如果过低就要重新配置样液,提高样液浓度。
12.4比色法定量的依据是什么?
依据朗-伯比尔定律。溶液的吸光度与其溶液的浓度成正比,根据一些列不同浓度的标准溶液所测的相应的吸光度值,绘制成标准曲线,再测定样液的吸光度值代入标准曲线方程,得出结果。
-
空气比热容比的测量实验报告
一实验名称空气比热容比的测量二实验目的测量室温下的空气比热容比学习用绝热膨胀法测定空气的比热容比观测热力学过程中状态变化及基本物理…
-
第四周物理实验报告空气比热容比的测量
华南农业大学实验报告专业班次11农学班一组别20xx30010110题目空气比热容比的测量姓名梁志雄日期实验名称空气比热容比的测量…
-
实验报告空气比热容比的测定
1实验名称空气比热容比的测定2实验目的1了解绝热等容的热力学过程及有关状态方程2测定空气的比热容比3实验原理主要原理公式及简要说明…
-
空气比热容比测定实验报告(实验数据及其处理)
007实验报告评分课程学期指导老师年级专业学号姓名习惯一个人007实验35空气比热容比的测定一实验目的1用绝热膨胀法测定空气的比热…
-
空气比热容比的测定实验报告
学生物理实验报告实验名称气体比热容比的测定学院专业班级报告人学号同组人学号同组人学号同组人学号理论课任课教师实验课指导教师实验日期…
-
苯甲酸熔点的测定有机化学实验报告
苯甲酸熔点的测定一、实验目的:测定苯甲酸晶体的熔点范围。二、实验原理:有机化合物熔点通常用毛细管法来测定,实际上测得的是一个熔点范…
-
熔点的测定预习实验报告
河北北方学院20xx级工业分析与检验一班邢妍萍熔点的测定预习实验报告一、实验目的及要求1.了解熔点测定的意义和应用。2.掌握熔点测…
-
实验四 重结晶及熔点的测定
实验四重结晶及熔点的测定预习内容实验教材P4853P5458一实验目的1学习通过重结晶提纯固体有机物的原理和方法2掌握折叠滤纸热过…
-
实验三:乙酰苯胺的重结晶及熔点的测定
实验二乙酰苯胺的重结晶及熔点的测定一实验目的1学习重结晶的基本原理用途2掌握重结晶提纯固体有机物的操作步骤3学习热过滤和减压过滤的…
- 熔点的测定实验报告