电化学基础实验报告 6.2
华 南 师 范 大 学 实 验 报 告
学 专 业 课程名称√综合 实验时间月日
实验类型 □验证 □设计 □
一、实验目的
1. 了解赫尔槽的结构特点并掌握赫尔槽的使用;
2. 掌握锌酸盐镀锌的工艺流程
二、实验原理
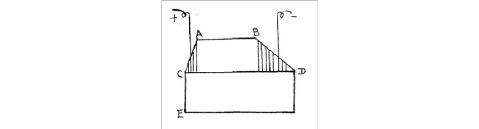
从赫尔槽的结构可以看出,阴极试片上各部位与阳极的距离是不等的,因而阴极上各部位的电流密度也也不同,离阳极距离最近的为近端,它的电流密度最大,随着阴极上的部位与阳极的距离逐渐增大,电流密度逐渐减少,直到离阴极最远的一端,称为远端,它的电流密度最小。根据大量的实验测定了阴极上各点离近端的距离与电流密度之间具有对数关系。
图1 赫尔槽示意图
其关系式为:
Dk=(C1-C2lgL)
对267mL赫尔槽,用下面的公式:
Dk=I(5.10-5.24lgL)
对250mL赫尔槽,用下面的公式:
Dk=250?(5.10?5.24???)=1.028I(5.10-5.24lgL)
另外,用安·时法计算镀锌电流效率,安·时法计算电流密度效率公式如下:
ηk=?1=2257???????×100%
三、实验器材
赫尔槽、直流稳压电源、锌阳极、铜试片、NaOH、ZnO、一些添加剂
四、实验步骤
1. 试片打磨清洗处理,将锌片打磨至光亮。
2. 将铜片和锌片放入赫尔槽中,计算铜片被浸没部分的面积,按照面积算出电解时的电流密度,然后按照计算所得电流密度,恒流电镀10分钟。
五、结果与讨论
1. 将不同条件下制备的电镀试片拍照,并标明实验条件;

图2 电流密度为1A/dm2时的试片正(左)反(右)面照片
图3 电流密度为2A/dm时的试片正(左)反(右)面照片


2
图4 电流密度为3A/dm时的试片正(左)反(右)面照片
2. 根据试片前后的质量变化,计算不同条件下镀锌的电流效率。 2电流密度为1A/dm2时:ηk=
电流密度为2A/dm2时:ηk=
电流密度为3A/dm2时:ηk=
0.09081.22×0.52×0.14641.22×1×6×100%=85.88% ×100%=72% 0.16991.22×1.5××100%=55.7%
第二篇:电化学基础-2
材料电化学
电化学基础
溶液的导电能力与载流子的迁移当离子在电场作用下迁移的路程和通过溶液 的截面积一定时,溶液的导电能力与载流子 的运动速度有关。离子运动速度越快,导电 能力越强。
影响离子运动速度的因素z离子本身的特性:主要是水化半径,半径越 大,运动速度越小;其次是离子价态,价数 越高,运动速度越快。
zz zz溶液的总浓度:浓度增大后,离子间距离减 小,相互作用加强,使离子运动阻力增大。 温度:温度升高,离子运动速度增大。 溶剂粘度:溶剂粘度越大,离子运动阻力越 大,运动速度减小。 离子浓度: 对电解质溶液而言,影响离子浓 度的主要因素是电解质的浓度和电离度。
离子的电迁移率和迁移数设想在两个惰性电极之间有想象 的平面AA和BB,将溶液分为阳 极部、中部及阴极部三个部分。 假定未通电前,各部均含 有正、负离子各5 mol, 分别用+、-号代替。
阳极上将有4 mol 负离子氧化!两电极间正、负离子要 共同承担4 mol电子电量 的运输任务。阴极上将有4 mol 正离子还原!设离子都是一价,通入4 mol电子的电量。
阳极上有4 mol负 离子氧化!正、负离子各承担 2 mol 导电任务!阴极上有4 mol正 离子还原!设正、负离子迁移的速率相等 v+=v-
阳极上有4 mol负 离子氧化!正离子导电任务为3 mol电 量,负离子导电任务为1 mol 电量 !阴极上有4 mol正 离子还原!设正离子迁移速率是负离子的三倍,v+=3v-
电迁移规律:向阴、阳两极迁移的正、负 离子物质的总量等于通入溶液的总电量。Q = Q+ + Q-
电迁移率(离子淌度): 单位电场强度下离子 的运动速率,单位为m2·V-1·s-1。v+ u+ = Ev? u? = Ev+ ,v- :正、负离子的运动速率(单位:m·s-1) E :电场强度(单位:V·m-1) 电迁移率的数值与离子本性、电位梯度、溶剂性质、温度等因素有关。
离子迁移数:电解质溶液中某种离子所传输 的电量在通过溶液的总电量中所占的分数 , 用符号t表示。Q+ t+ = Q+ + Q?t? =Q? Q+ + Q?t+ =v+ u+ = v+ + v? u + + u ?t? =v? u? = v+ + v? u + + u ?
如果溶液中只有一种电解质:t+ + t? = 1如果溶液中有多种电解质:∑t = ∑t + ∑ti +?=1
离子迁移数的测定? 希托夫法(Hittorf) ? 界面移动法 ? 电动势法
? 溶剂不导电 ? 离子不水化?在Hittorf迁移管中装入已知浓度 的电解质溶液,接通稳压直流电 源,此时电极上有反应发生,正、 负离子分别向阴、阳两极迁移。 ?通电一段时间后,电极附近溶液 浓度发生变化,中部基本不变。小 心放出阴极部(或阳极部)溶液, 称重并进行化学分析。 ?根据输入的电量和极区浓度的变 化,计算离子迁移数。希托夫法测定迁移数的装置
?在左侧管中先放入CdCl2溶液至 aa’面,然后小心加入HCl溶液, 使aa’面清晰。 ?通电后,H+ 向上面负极移动, Cd 2+淌度比H+小随其后,使aa’ 界面向上移动。通电一段时间 后,移动到bb’位置,停止通电。 ?根据毛细管的内径、液面移动的 距离、溶液的浓度及通入的电 量,可以计算离子迁移数。界面移动法测定H+迁移数的装置通过测定溶液界面在迁移管中移动的距离求迁移数,界面 移动距离的测定借助溶液的颜色或折射率。
在电动势测定应用中,可通过测量液接电势值计 算离子的迁移数。例如,Pt,H 2 ( p) | HCl(m1 ) | HCl(m2 ) | H 2 , PtRT m1 E j = (t+ ? t? ) ln F m2 RT m1 = (2t+ ? 1) ln F m2已知m1和m2测定Ej,就可得t+和t-的值。
强电解质溶液理论? 电解质的平均活度和活度系数 ? 强电解质的离子相互作用理论
电解质的平均活度和活度系数活度和活度系数是电解质溶液最重要的静 态性质之一。溶液中各种粒子间的相互作 用对电解质溶液静态性质的影响,可以通 过它对活度系数的影响予以讨论。
离子强度和活度系数理想:μA = μAθ + RT ln m 实际:μA = μAθ + RT ln a aA= γA m 当 m → 0 (无限稀),γA → 1,aA = m 通过理想溶液中某组分化学位等温式的推 导,可以得到电解质活度a ,平均活度a± 和平均活度系数γ±之间的关系式。
19xx年,Lewis在研究大量不同离子价态电解 质的实验数据后,总结出一个经验规律:电 解质的平均活度系数与溶液中离子浓度和离 子电荷有关,而与离子本性无关。
将离子电荷和浓度 联系在一起 !离子强度是存在于溶液中的每种离子的浓度乘以该种离子 价数的平方所得之项之和的一半。式中m是离子的真实浓 度,若是弱电解质,应乘上电离度。
离子强度定律:强电解质的稀溶 液、离子可以作 为点电荷处理的 体系!lg γ ± = ? A | z+ z? | IA与温度有关,而与浓度无关的常数。
强电解质的离子相互作用理论 (Debye-Hückel理论) 基本假定 ? 电解质在溶液中完全电离。 ? 正、负离子间的主要作用力为库仑力。 ? 在溶液中形成离子氛。
离子氛模型 ? 中心离子总是被周围随机分布的异号电荷所 包围; ? 异号电荷的分布呈球形对称; ? 异号电荷的总电荷在数值上等于中心离子的 电荷; ? 由于离子的热运动,离子氛是瞬息万变的。
离子氛示意图
Debye-Hückel极限定律:lg γ i = ? AZ2 iI式中:Zi是i种离子的电荷,I是离子强度,A是与温度、溶剂 有关的常数,水溶液的A值有表可查。
对于离子半径较大,不能作为点电荷处理的系统:? A | z+ z? | I lg γ ± = 1 + aB I式中:α为离子的平均有效直径,约为3.5×10-10 m, B是与温度、 溶剂有关的常数。
- 大学化学基础实验报告
-
基础化学实验报告
基础化学实验报告实验名称班组姓名同组人实验日期一实验目的1有助于提高学生的综合实验能力而且可以提高学生对于化学实验的兴趣2掌握制备…
-
基础化学实验报告格式
院系年级专业姓名学号课程名称基础化学实验实验日期年月日实验地点指导老师测定实验例二氧化碳相对分子质量的测定实验报告院系年级专业姓名…
-
基础化学实验II实验报告模板
浙江大学基础化学实验II实验报告姓名班级实验台号实验名称实验时间一实验目的二实验原理三主要试剂及主副产物的物理常数四主要试剂用量及…
-
化学实验报告 实验__化学实验基本操作
实验报告姓名:班级:同组人:自评成绩:项目:化学实验基本操作课程:学号:一、实验目的1.熟悉实验室规则,安全守则及意外事故处理。2…
-
化学实验报告格式
化学实验报告格式例一定量分析实验报告格式(以草酸中h2c2o4含量的测定为例)实验题目:草酸中h2c2o4含量的测定实验目的:学习…
-
生物化学实验报告格式
《生物化学实验》实验报告本专业班级姓名学号目录实验一基本操作实验二血糖测定实验三血清谷丙转氨酶的测定实验四血清蛋白醋酸纤维薄膜电泳…
-
化学实验报告 实验__化学实验基本操作
实验报告姓名:班级:同组人:自评成绩:项目:化学实验基本操作课程:学号:一、实验目的1.熟悉实验室规则,安全守则及意外事故处理。2…
-
基础化学实验报告格式
院系年级专业姓名学号课程名称基础化学实验实验日期年月日实验地点指导老师测定实验例二氧化碳相对分子质量的测定实验报告院系年级专业姓名…
-
(人教版)初中化学实验报告
中学化学实验报告九年级班号姓名实验日期年月日实验名称用实验证明我们吸入的空气和呼出的气体中的氧气含量有什么不同实验目的氧气可以使带…
-
浙大版电工电子学实验报告02单向交流电路
实验报告课程名称电工电子学实验指导老师实验名称单向交流电路一实验目的1学会使用交流仪表电压表电流表功率表2掌握用交流仪表测量交流电…