金相实验报告——结晶与晶体生长形态观察

西安交通大学实验报告
课 程: 金相技术与材料组织显示分析实验 日期:年 月 日
专业班级: 组别 交报告日期: 年 月 日
姓 名: 学号 报 告 退 发: (订正、重做)
同 组 者: 教师审批签字:
实验名称:结晶与晶体生长形态观察
实验目的:
1. 观察盐类结晶的过程,熟悉树枝晶的长大方式;
2. 了解晶体的生长形态和影响结晶的因素。
实验原理概述:
金属及其合金的结晶是在液态冷却的过程中进行的,需要有一定的过冷度,才能开始结晶。而金属和合金的成分、液相中的温度梯度和凝固速度是影响成分过冷的主要因素。晶体的生长形态与成分过冷区的大小密切相关,在成分过冷区较窄时形成胞状晶,而成分过冷区较大时,则形成树枝晶。但是,由于金属是不透明的,一般说来,我们不能观察到它的结晶过程。
将质量分数为25%-30%的氯化铵,即接近饱和状态的水溶液,滴几滴在玻璃板上或倒入少量于玻璃皿中,其结晶过程是靠水分蒸发和降温来驱动结晶的。结晶过程为首先从液体的边缘处开始,慢慢向内扩展,在首批晶核长大的同时,又不断地形成新的晶核并长大。整个过程是不断形核和晶核长大的的过程。最后,各晶粒边界相互接触,相互妨碍生长,直到液体耗尽,各晶粒完全接触,结晶完成。
实验内容:
1. 观察质量分数为25%-30%的氯化铵溶液在玻璃皿空冷的结晶过程。
2. 观察质量分数为25%-30%的氯化铵溶液在玻璃皿空冷时,在其上撒入少量的氯化铵粉末的空冷结晶过程。
材料与设备:氯化铵、玻璃皿、天平、夹子
实验方法:
1.按水的体积多少,计算氯化氨的用量,并用天平称取;
2.在烧杯中配制质量分数为25-30%的氯化氨水溶液;
3.滴几滴在玻璃板上或倒入少量于玻璃皿中;
4.在部分玻璃皿中撒入少量的氯化氨粉末空冷结晶;
5.观察不同条件下氯化铵水溶液结晶过程。
2.比较不同条件下对氯化铵水溶液空冷结晶组织的影响:
氯化钠溶液在玻璃皿中空冷时由于玻璃皿边缘与中心的介质不同,造成氯化钠溶液洁净的不均匀,从而造成晶粒的大小不同;另外撒入少量的氯化铵粉末后粉末在促进结晶的同时也成为氯化铵的成长中心,析出的氯化铵依附在撒入的粉末上成长,即撒入的粉末有引导结晶的作用,实际的形态和撒入的量、分布有关。
第二篇:结晶及晶体生长形态的观察
结晶及晶体生长形态的观察
一、实验目的
1. 认识结晶的基本过程及实验原理。
2. 了解结晶是混合物分离的常用方法。
3. 认识水溶液的溶解度与结晶。
4. 认识晶体形态与所属晶系的关系。
二、实验原理
晶体具有规则的几何外形而固体不一定有。晶体属于固体,而固体不一定是晶体。
溶质以晶体的形式从溶液中析出的过程叫做结晶。只有在那个温度下,溶液已不能继续溶解这些晶体时,晶体才会析出。或者说,析出晶体时的溶液,肯定是该温度下这种晶体的饱和溶液。
定温定压时,饱和溶液中所含溶质的量,称为该溶质在该温度、压力下的溶解度。
在一定量的水中一定的温度下,所能溶解的溶质量是有限的,溶质在水中无法继续溶解时,多余的溶质便沉在杯底,即使经过搅拌也无法令更多的溶质溶解。此时杯中水溶液所能溶解的溶质已达最大量,称之为“饱和溶液”。
 溶剂中所能溶解的溶质未达最大量,此时的溶液称之为“未饱和溶液”,如果再继续加入少许溶质时,固体溶质会继续溶解。
溶剂中所能溶解的溶质未达最大量,此时的溶液称之为“未饱和溶液”,如果再继续加入少许溶质时,固体溶质会继续溶解。
利用较高温度配置溶液达到饱和后,再降低温度,水溶液在高温中溶解度较高,一旦降温后溶解度也降低,但溶质的量不减,因此,水溶液的浓度大于最大溶解度,此时的溶液称为“过饱和溶液”。过饱和溶液是一种不稳定状态,过量的溶质会伺机结晶析出而成为饱和溶液。
图1.几种典型盐的溶解度曲线
利用物质在水溶液中的溶解度对温度变化的差异,将水溶液加热后配置成饱和水溶液,再将温热的饱和水溶液与过剩的溶质经由过滤分离后,当水溶液温度降低时即成为过饱和水溶液,过剩的溶质会结晶析出形成晶体。
由上图可以看出,结晶有两种方法:一为蒸发溶剂结晶(如食盐溶解度受温度影响小的物质),二为冷却热饱和溶液(如硝酸钾溶解度受温度影响大的物质)。①蒸发结晶—温度不变溶剂减少。②降温结晶—溶剂不变温度降低。
利用结晶可以分离部分水溶性物质,①对溶解度受温度变化影响不大的固体溶液,一般用蒸发溶剂的方法得到晶体(即蒸发结晶),达到分离目的。②对溶解度受温度变化影响相当大的固体溶质,一般采用冷却其热饱和溶液的方法得到晶体(即降温结晶),达到分离目的。
从微粒运动的观点看,溶解是溶质微粒离开溶质表面向溶剂里分散的过程;结晶是分散在溶液里的溶质微粒向溶质表面聚集的过程。显然,溶解和结晶是相反的两个过程。
当溶质开始溶解时,单位时间里从固体溶质表面扩散到溶剂里的微粒数目,比回到固体溶质表面的溶质微粒数目多,固体溶质不断减少。随着溶解的进行,溶液中溶质微粒数目逐渐增加,由溶液里回到固体溶质表面的溶质微粒数目也不断增加,溶质溶解的速率逐渐减小,而溶质结晶的速率却逐渐增大。当单位时间里扩散到溶液里的溶质微粒数目,与回到溶质表面的溶质微粒数目相等时,也就是溶质溶解的速率与溶质结晶的速率相等时,溶解过程与结晶过程达到了平衡。这两个同时进行的相反过程是可逆的,通常用“ 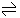 ”表示。
”表示。
固体溶质 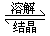 溶液里的溶质
溶液里的溶质
这时,可以看成溶质不再溶解,也不再结晶。但实际上,溶解和结晶都仍在进行。这时的溶液就是我们前面所说的饱和溶液。能溶解在水里的物质,不能无限制地溶解的原因就是因为存在这个平衡。
当外界条件改变(如饱和溶液冷却或蒸发溶剂)时,溶解和结晶的速率也要相应地改变,便会有晶体析出等现象发生。
结晶体种类五花八门,我们之所以要选择硫酸铜作为试验的观察物质,是因为硫酸铜结晶容易、颜色艳丽、晶体形状漂亮有如蓝宝石,所以我们采用硫酸铜和明矾结晶作为试验对象。硫酸铜结晶---宝蓝色菱形晶体。明矾结晶-八面体。


图4. 硫酸铜晶体

图5. 明矾晶体
三、实验用具和药品
实验用具:烧杯,玻璃棒,棉线,酒精灯或电炉
实验药品:明矾,硫酸铜
四、实验内容与步骤
1. 用烧杯装取2杯热水,分别配置明矾(100℃时溶解度约为154克)以及硫酸铜(100℃时溶解度约为77克)的饱和水溶液。
2. 取出上层较清澈水溶液倒入小烧杯中,静置一段时间等结晶成形后,挑选晶体形状较规则的结晶作为晶种。
3. 将剩余的饱和水溶液加热,溶解更多的溶质,配置温热的饱和水溶液。
4. 将晶种用棉线绑好吊入所配置的过饱和水溶液中,静置等待结晶。
五、实验结论
1. 实验过程中发现烧杯的杯壁也有细小晶体的产生,持续观察几天后,杯壁上晶体的面积越来越大,原来是晶体会沿着杯壁往上爬升,这些晶体甚至爬出杯子外侧。杯内的溶液也逐渐减少。由此可以断定,在常温下,硫酸铜水溶液在烧杯内壁产生晶体,水溶液又因毛细作用往上攀爬,渐渐在烧杯壁上形成晶体,此现象是为“攀晶”。
2. 在不同温度下结晶会造成结晶速度不同,晶体大小也有差别。将某种物质溶在水中,使其达到饱和,再将温度降低,由此让溶液达到过饱和,过饱和溶液就会将多余的溶质析出。
3. 温度降低的速度不同时所产生的晶体形状、大小也会不同。
六、实验报告要求
1.画出实验中观察到的明矾和硫酸铜的结晶形态,并作简要分析。
2.物质结晶受哪些因素影响。
-
金相实验报告
实验五铁碳合金平衡组织的显微观察一实验目的12观察铁碳合金在平衡状态下的显微组织特征掌握铁碳合金成分组织性能之间的变化规律二实验器…
-
金相试验实验报告
中北大学材料科学与工程学院实验报告实验报告班级姓名学号中北大学材料科学及工程学院实验中心中北大学材料科学与工程学院实验报告一实验名…
-
金相观察实验报告整理版
金相观察一实验目的1观察铁碳合金在平衡状态下的显微组织特征2掌握铁碳合金成分组织性能之间的变化规律二实验器材1金相显微镜2金相标准…
-
金相显微镜的使用与金相样品的制备实验报告
金相显微摄像一实验目的一了解普通金相显微镜的构造与使用方法二了解金相试样的制备方法三学习使用金相显微镜观察金相组织二实验设备及材料…
-
金相显微镜的使用及金相试样的制备实验报告
实验1金相显微镜的使用及金相试样的制备一实验目的1掌握金相试样制备的基本方法2掌握金相显微镜的使用方法二原理概述一金相显微镜的构造…
-
金相热处理实验实习报告
学生综合实验报告实验类别院别专业班级姓名学号指导教师二0一0年十二月三十一日金相热处理实验实习报告T8广东技术师范学院综合实验报告…
-
金相热处理实验报告
学生综合实验报实验类别院别专业班级姓名学号指导教师二0一二年六月一日告广东技术师范学院综合实验报告班级10机电师实验名称姓名学号成…
-
金相实验报告
实验五铁碳合金平衡组织的显微观察一实验目的12观察铁碳合金在平衡状态下的显微组织特征掌握铁碳合金成分组织性能之间的变化规律二实验器…
-
金相试验实验报告
中北大学材料科学与工程学院实验报告实验报告班级姓名学号中北大学材料科学及工程学院实验中心中北大学材料科学与工程学院实验报告一实验名…
- 金相实验报告2
-
金相实验报告
广州大学机械与电气工程学院课程报告报告题目金相实验报告专业班级机械111姓名邓永明学号110720xx14组别第六组指导老师胡一丹…