药品不良反应报告表(国家)
制表单位:国家食品药品监督管理局
药品不良反应 / 事件报告表
新的□严重□一般□ 医疗卫生机构□ 生产企业经营企业□ 个人□ 编码□□□□□□□□□□□□□□□□□□□
单位名称: 部门: 电话: 报告日期: 年 月 日
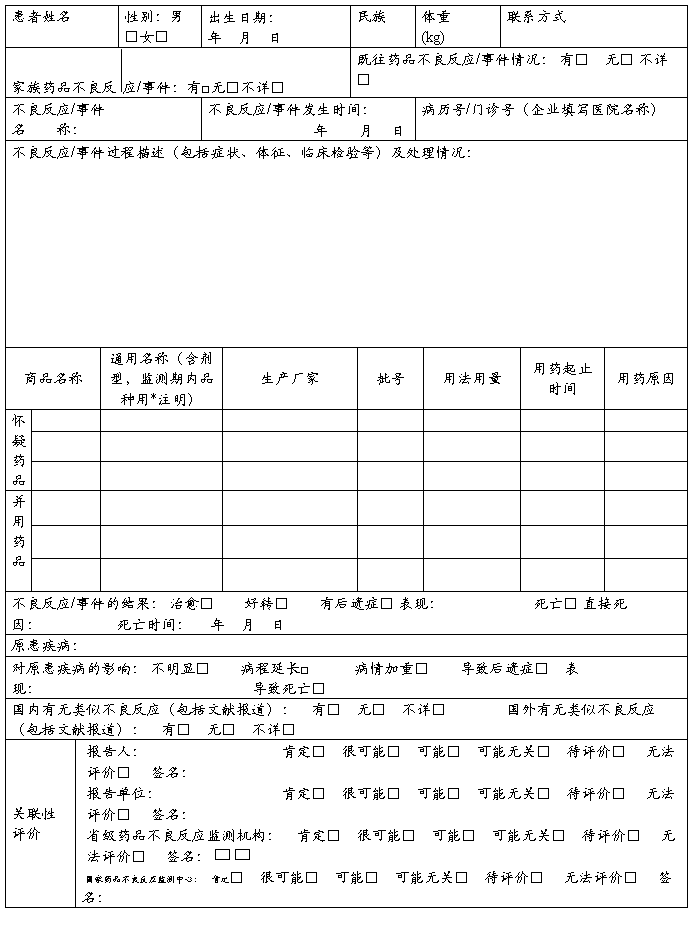
报告人职业(医疗机构):医生□ 药师□ 护士□ 其他□ 报告人职务职称(企业): 报告人签名:
◇不良反应/事件分析

◇严重药品不良反应/事件是指有下列情形之一者:
① 引起死亡 □
② 致畸、致癌或出生缺陷 □
③ 对生命有危险并能够导致人体永久的或显著的伤残 □
④ 对器官功能产生永久损伤 □
⑤ 导致住院或住院时间延长 □
◇编码规则:
省(自治区、直辖市) 市(地区) 县(区) 单位 年代 流水号
□□ □□ □□ □□□□ □□□□ □□□□□
注:省(自治区、直辖市)、市(地区)、县(区)编码按中华人民共和国行政区划代码填写。
单位编码第一位如下填写:医疗机构1、军队医院2、计生机构3、生产企业4、经营企业5。
个人报告单位编码一栏填写6000
◇注:通用名称一栏,首次获准进口5年内的进口品种用*注明
国家药品不良反应监测中心 药品不良反应监测中心
通信地址:北京市崇文区法华南里11号楼二层 通信地址:
邮 编:100061 邮 编:
电 话:(010)67164979 电 话:
传 真:(010)67184951 传 真:
E – mail :report@adr.gov.cn E – mail:
新的、严重的药品不良反应/事件病例报告要求
药品生产企业报告要求
1. 填报《药品不良反应/事件报告表》;
2. 产品质量检验报告;
3. 药品说明书(进口药品还须报送国外药品说明书);
4. 产品注册、再注册时间,是否在监测期内(进口药是否为首次获准进口5年内);
5. 产品状态(是否是国家基本药物、国家非处方药、国家医疗保险药品、中药保护品种);
6. 国内上年度的销售量和销售范围;
7. 境外使用情况(包括注册国家、注册时间);
8. 变更情况(药品成分或处方、质量标准、生产工艺、说明书变更情况);
9. 国内外临床安全性研究及有关文献报道情况;
10. 除第1、2项以外,其他项目一年之内如无变更,可以免报。
第二篇:药品不良反应报告表规范分级标准
药品不良反应/事件报告表”规范分级标准 0级:缺少单位名称(医院名称/企业名称)、患者姓名、不良反应/事件名称(不良反应名称)或不良反应/事件过程描述及处理情况(不良反应表现)、商品名称/通用名称(药品名称)中的任何一项视为无效报告
1级:单位名称(医院名称/企业名称)、患者姓名、不良反应/事件名称(不良反应名称)或不良反应/事件过程描述及处理情况(不良反应表现)、商品名称/通用名称(药品名称)
2级:1级+不良反应/事件发生时间(不良反应发生时间)、用药起止时间 3级:2级+用法用量(日剂量)、用药原因
4级:报表中所有项目填写齐全
注: 一、各级别中所列的项目均为必要条件,缺少任何一项归为下一级。
二、括号中的内容,为19xx年版药品不良反应报告表中的相应项目。
三、单位名称项空白或填写“不详”、“不知道”、“不清楚”、“不清”、“不明”等视为缺项。
四、患者姓名项空白或填写“不详”、“不知道”、“不清楚”、“不清”、“不明”等视为缺项。
五、不良反应/事件名称(不良反应名称)项空白或填写“不详”、“不知道”、“不清楚”、“不清”、“不明”等视为缺项;或者不良反应/事件过程描述及处理情况(不良反应表现)项空白或填写“不详”、“不知道”、“不清楚”、“不清”、“不明”等视为缺项。
六、怀疑引起不良反应的商品名称/通用名称(药品名称)项空白或填写“不详”、“不知道”、“不清楚”、“不清”、“不明”等视为缺项。
七、不良反应/事件发生时间(不良反应发生时间)项空白,视为缺项。录入数据库时填写为上报当年1月1日。
八、用药起止时间项空白,视为缺项。录入时填写为上报当年1月1日。
九、用法用量(日剂量)项空白或填写“不详”、“不知道”、“不清楚”、“不清”、“不明”者视为缺项。
十、用药原因项空白或填写“不详”、“不知道”、“不清楚”、“不清”、“不明”者视为缺项。
十一、关联性评价中省级药品不良反应监测机构项选择未评价(待评价)/无法评价时,视为缺项。
-
新版药品不良反应事件报告表
药品不良反应事件报告表首次报告跟踪报告编码报告类型新的严重一般报告单位类别医疗机构经营企业生产企业个人其他严重药品不良反应是指因使…
-
药品不良反应-事件报告表
例表1药品不良反应/事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个…
-
《药品不良反应_事件报告表》及填写说明
药品不良反应事件报告表填写说明一填写注意事项1药品不良反应事件报告是在特定时间的某个具体的患者使用某个批次的药品而出现的药品不良反…
-
药品不良反应事件报告表模板
附药品不良反应事件报告表模板仅为示例完善填写格式和填写事项首次报告跟踪报告编码报告类型新的严重一般报告单位类别医疗机构经营企业生产…
-
药品不良反应报告表
药品不良反应事件报告表报告类型新的严重一般首次报告跟踪报告报告来源医疗机构药品经营企业药品生产企业其他除非得到允许报告表中的个人信…
-
国家药品不良反应监测年度报告(20xx年)
国家药品不良反应监测年度报告20xx年20xx年05月14日发布为全面反映我国药品不良反应监测情况提高安全用药水平促进临床合理用药…
-
《四川省药品不良反应报告和监测管理办法实施细则》
四川省药品不良反应报告和监测管理办法实施细则第一章总则第一条为加强药品的上市后监管规范药品不良反应报告和监测及时有效控制药品风险保…
-
药品不良反应报告表(国家)
制表单位:国家食品药品监督管理局药品不良反应/事件报告表新的□严重□一般□医疗卫生机构□生产企业经营企业□个人□编码□□□□□□□…
-
20xx国家药品不良反应监测年度报告
国家药品不良反应监测年度报告20xx年20xx年07月17日发布为全面反映20xx年我国药品不良反应监测情况促进临床合理用药保障公…
-
国家药品不良反应监测年度报告(20xx年)
国家药品不良反应监测年度报告20xx年为全面反映20xx年我国药品不良反应监测情况促进临床合理用药保障公众用药安全依据药品不良反应…
-
药品不良反应报告表
附表1药品不良反应事件报告表首次报告跟踪报告编码报告类型新的严重一般报告单位类别医疗机构经营企业生产企业个人其他药品不良反应报告表…