广东省第三类医疗器械产品注册申请资料自查报告
附件1:
广东省第三类医疗器械产品注册申请资料自查报告



注:1.“自查结果”栏中请填写“是”或“否”;2.“备注”栏填写需要说明的事项。如不够,可另加副页说明,但须加盖企业公章。
第二篇:关于实施第三类医疗器械首次注册资料真实性核查
关于实施第三类医疗器械首次注册
资料真实性核查工作的申请须知
一、依据
为做好境内第三类医疗器械首次注册现场核查的申请、资料核查和现场核查,规范企业申报资料和核查行为, 根据国家食品药品监督管理局《关于进一步加强和规范医疗器械注册管理的暂行规定》,特制订本《申请须知》。
二、申请范围
《规定》涉及产品范围为除体外诊断试剂外的境内第三类医疗器械的首次注册。主要对产品临床试验和样品生产过程的真实性进行核查。
三、办理程序
(一)申请和申请资料
企业申请境内第三类医疗器械首次注册产品的质量体系考核的同时,应填写《境内第三类医疗器械首次注册核查申请表》(附一),并按《申报表》的要求报送以下资料:
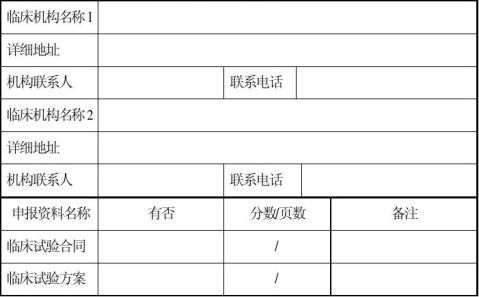
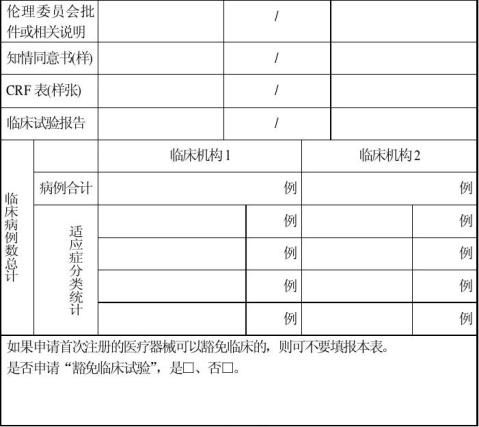
1、注册申请资料中的临床试验资料(临床试验合同、临床试验方案、伦理委员会批件、知情同意书样张、CRF表样张、临床试验报告)复印件。(可以豁免临床的除外)。
2、具有申请注册医疗器械检测资质的医疗器械检测机构出具的产品注册检测报告。
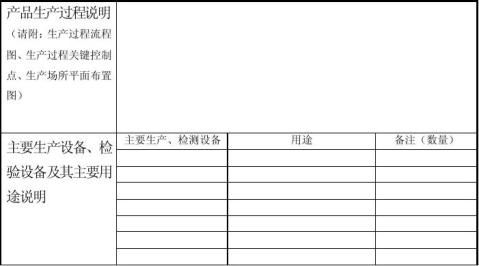
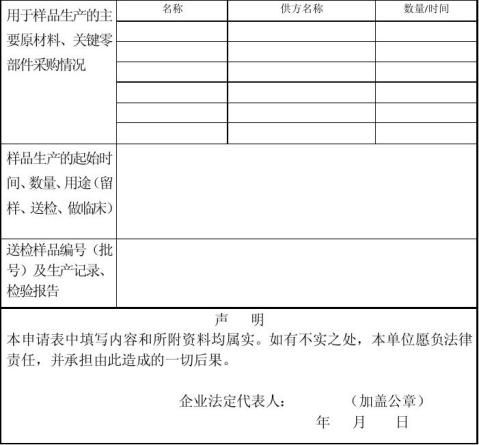
3、样品生产过程的相关资料(产品基本原理或机理、结构形式或形态﹙必要时提供照片)、预期用途等说明、生产过程流程图、生产过程关键控制点、生产场所平面布置图、主要生产设备和检验设备及其主要用途说明)的复印件。
(二)受理和审查
1、市食品药品监督管理局收到企业递交的境内第三类医疗器械首次注册申请资料后,在5个工作日内,经形式审查符合要求的,予以受理并出具“受理通知书”。如不予受理则按规定出具“不予受理告知书”。
2、市食品药品监督管理局自受理之日70个工作日内(含质量体系考核时间),由上海市食品药品监督管理局认证审评中心委派核查人员按照《境内第三类医疗器械首次注册核查标准》(附二)和《境内第三类医疗器械首次注册核查程序》(附三)在实施质量体系考核过程中进行核查。
核查人员在对企业申请资料进行核查中,对存在资料不齐全、表述不清晰、资料不符合要求等问题,可以出具《补正资料通知书》。自《补正资料通知书》发出二个月内,企业应按要求完成资料的补正。发出《补正资料通知书》到企业完成补正日期止,受理核查工作日暂停计算。
临床试验核查的方式有函调核查和现场核查。对承担临床试验医疗机构在本市的一般采用现场核查,对承担临床试验机构不在本市的,主要采用函调核查或委托承担临床试验医疗机构所在地的省食品
药品监督管理部门组织核查。对特殊需要现场核查的产品,将与申请企业沟通解决。
对样品生产过程的核查一般结合质量管理体系核查同步进行,核查组对核查情况进行客观记录并完成《境内第三类医疗器械首次注册核查记录表》(附四)请企业核实签名盖章。
3、企业递交的境内第三类医疗器械首次注册申请资料经核查证实存在虚假等违规问题的,将依据相关法律、法规查处,二年内不受理该类产品注册申请。
4、核查结束后,核查单位将在10天内出具《境内第三类医疗器械首次注册核查报告》(附件五)。一式三份,其中一份由核查部门留档,一份交企业(在申请产品注册时企业应当递交核查报告的复印件),另一份由核查部门连同《核查记录》一并密封后由企业报送相关医疗器械审评部门。
四、办理机构
上海市食品药品监督管理局认证审评中心;
上海市食品药品监督管理局医疗器械安全监管处。
五、受理地点
上海市食品药品监督管理局受理中心,地址:上海市河南南路288号大厅,电话:021-63356003。
六、受理时间:周二、周四上午9:00-11:00,下午1:30-5:00。
本规定自二00九年五月一日起执行。
? 下载表格和附件:
附件一、《境内第三类医疗器械首次注册核查申请表》 附件二、《境内第三类医疗器械首次注册核查标准》 附件三、《境内第三类医疗器械首次注册核查程序》 附件四、《境内第三类医疗器械首次注册核查记录表》 附件五、《境内第三类医疗器械首次注册核查报告》
附件一 上海市第三类医疗器械首次注册核查申请表


附件二
境内第二、三类医疗器械首次注册核查标准
一、临床试验资料核查
对不需要或免于提交临床试验资料的,由申请企业递交“临床试验豁免报告”,本项内容则不作核查。 (一)核查内容
1、临床试验资料的核查。
核查临床试验合同、临床试验方案、伦理委员会批件或相关说明、受试者知情同意书(样张)、CRF表、临床试验报告。
2、临床试验报告的真实性核查。
⑴试验产品的名称、规格型号;
⑵试验机构及科(室)、试验项目负责人;
⑶试验起止时间、试验的适应症及病例数;
⑷原始试验例数及观察时间、临床试验结果;
⑸原始试验记录数据与原始病历内容一致性。
(二) 核查方法
调阅医疗机构存档的原始临床试验资料以及企业拟申报的临床试验资料进行对比核查。查阅原始临床试验资料中试验产品的名称、规格型号是否与临床试验报告上的内容一致;查阅原始试验例数及观察时间是否与临床试验报告上的内容一致;查阅原始试验数据与原始病历所载内容是否一致。
临床试验核查的方式有函调核查和现场核查。对承担临床试验医疗机构在本市的一般采用现场核查。对承担临床试验机构不在本市的的,主要采用函调核查或委托承担临床试验医疗机构所在地的省食品药品监督管理部门组织核查;对需要进行现场核查的特殊情况,一般由企业提出,差旅费用由企业支付。
二、样品生产过程的资料核查
(一)核查内容
⑴产品注册检验报告的样品与样品生产的一致性,包括送检样品编号(批号)及生产记录。
⑵样品生产过程与申请书表述(包括生产过程流程图、生产过程关键控制点、生产过程平面布置图)的一致性。
⑶主要生产设备、检验设备的应用与申请书表述的一致性。生产设备与生产过程相适应,检验设备与产品标准相适应。核查样品生产过程记录、出厂检验记录。
⑷用于样品生产的原材料采购记录、供方名单与产品生产过程一致性。
⑸样品生产的起、止时间、数量、用途(留样、送检、临床)的一致性。
(二)核查方法
结合产品生产质量体系考核核查产品申请材料的真实性,对原材料购入、生产记录、出厂检验、送检样品记录进行核查。如需留样的产品,检查是否有留样;送检样品查阅是否有记录;查阅注册检验报告样品的批号是否和生产记录的批号一致;查阅是否有样品生产过程的检验记录和出厂检验记录;查阅用于样品生产的原材料是否有采购记录。
核查组对企业上报的首次注册申请资料真实性进行核查时,原则上首先核查真实性,如发现与申报资料不一致,则可终止核查。
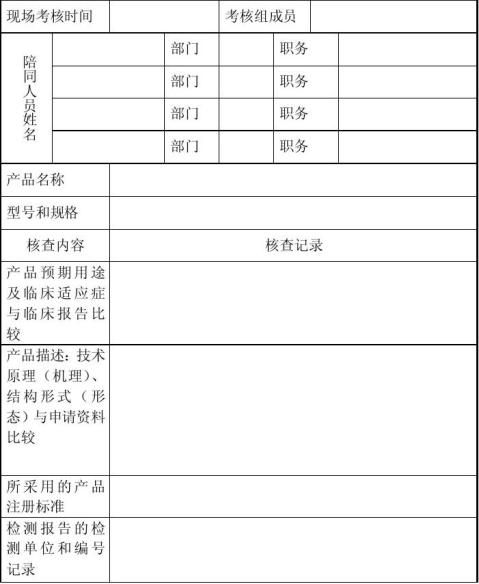
附件四 境内第三类医疗器械首次注册核查记录表

-
医疗器械申请书
附表十一受理编号医疗器械经营企业许可申请表拟办企业名称申请人填报日期年月日受理日期年月日湖南省食品药品监督管理局印填报说明1内容填…
-
关于购置医疗设备的申请报告
关于购置医疗设备的申请报告长岭县卫生局长岭县医院是县内唯一一家二级甲等综合医院为填补县级医院无重症监护室空白所以医院拟成立重症监护…
-
医疗器械申请表
编号医疗器械经营企业许可证审批表企业名称经营地址组织审查部门月陕西省食品药品监督管理局制填表说明1本表中的表一表二及封面内容由检查…
-
20xx 医疗器械开许可证申请报告
申请报告药品监督管理局我单位注册地址拟申请办理医疗器械经营许可证从事药品零售企业允许经营的第二三类医疗器械经营活动并郑重承诺严格执…
-
医疗器械申请书范文
此范本仅供参考请根据公司具体情况修改完善医疗器械有限公司医疗器械经营企业许可证申请材料联系人联系电话目录1申请医疗器械经营企业许可…
-
医药医疗器械质量安全自查报告
医疗器械质量安全自查报告在食品药品监督管理部门的监督指导下,我公司认真履行《质量承诺责任书》中所作的承诺,促使质量管理体系各个环节…
-
医疗器械自查报告
医疗器械自查报告医疗器械gt自查报告一我院遵照X区X食药监发27号29号文件精神组织相关人员重点就全院药品医疗器械进行了全面检查现…
-
申请医疗器械经营许可证自查报告(上报版)
有限公司有限公司申办医疗器械经营企业许可证自查报告有限公司成立于20xx年9月20xx年9月取得药品经营许可证20xx年2月取得药…
-
医疗器械自查报告(20xx最新)
第三类医疗器械批发企业企业名称企业地址企业负责人联系人电话1手机手机盖章电话年度基本情况表23年度自查情况表填报单位填报时间456…
-
医疗器械安全生产自查报告
医疗器械安全生产自查报告市食品药品监督管理局为进一步加强企业的安全生产管理强化日常安全生产的消除各类安全隐患杜绝发生安全生产事故我…
-
医疗器械经营企业年度自查报告
医疗器械经营企业年度自查报告企业名称:河南博强医疗器械有限公司主要经营范围:第三类:注射穿刺器械6815;医用电子仪器设备6821…