大学物理化学实验报告-化学电池温度系数的测定

物理化学实验报告
院系 化学化工学院
班级 化学 061
学号 13
姓名 沈建明
实验名称 化学电池温度系数的测定
日期 2009.4.20 同组者姓名 史黄亮
室温 19.60℃ 气压 102.0 kPa
成绩
一、目的和要求
1、掌握可逆电池电动势的测量原理和电位差计的操作技术;
2、学会几种电极和盐桥的制备方法;
3、通过原电池电动势的测定求算有关 热力学函数。
二、基本原理
(一)、凡是能使化学能转变为电能的装置都称之为电池对定温定压下的可逆电池而言:
 (1)
(1)
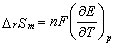 (2)
(2)
 (3)
(3)
式中,F为法拉弟(Farady)常数;n为电极反应式中电子的计量系数;E为电池的电动势。
另,
可逆电池应满足如下条件:
1.电池反应可逆,亦即电池电极反应可逆。
2.电池中不允许存在任何不可逆的液接界。
3.电池必须在可逆的情况下工作,即充放电过程必须在平衡态下进行,亦即允许通过电池的电流为无限小。
因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的测量中,常用正负离子迁移数比较接近的盐类构成“盐桥”来消除液接电位。用电位差计测量电动势也可满足通过电池电流为无限小的条件。
(二)、求电池反应的ΔrGm、ΔrSm、ΔrHm
设计电池如下:
Ag(s) | AgCl(s)|饱和KCl | Hg2Cl2(s) | Hg(l)
分别测定电池在各个温度下的电动势,作E—T图,从曲线斜率可求得任一温度下的 
利用公式(1),(2),(3)即可求得该电池反应的ΔrGm、ΔrSm、ΔrHm
三、仪器、试剂
SDC—Ⅱ数字电位差综合测试仪 1台
精密稳压电源(或蓄电池) 1台
SC—15A超级恒温槽 1台
铜电极 2只
铂电极 1只
饱和甘汞电极 1只
恒温夹套烧杯 2只
HCl(0.1000mol·kg-1)
AgNO3(0.1000mol·kg-1)
镀银溶液 镀铜溶液 KCl饱和溶液
四、实验步骤
一、电极的制备
1.银电极的制备
将欲用的两只Pt电极(一个电极Pt较短,作为阳极,另一个电极作为阴极,用于镀银)浸入稀硝酸溶液片刻,取出用蒸馏水洗净。将洗净的电极分别插入盛有镀银液(AgNO3 3g,浓氨水,KI 60g)中,控制电流为0.3mA,电镀1h,得白色紧密的镀银电极一只。
2.Ag-AgCl电极制备
将上面制成的一支银电极用蒸馏水洗净,作为正极,以Pt电极作负极,在约1mol·dm-3的HCl溶液中电镀。控制电流为2mA左右,30min后,可得呈紫褐色的Ag-AgCl电极。(可以观察到阴极有小气泡出现)
二、电极组合与电动势测量
1、将制备得到的Ag-AgCl电极与Hg-Hg2Cl2电极组成电池:
Ag|AgCl|KCl(饱和)|Hg2Cl2|Hg
2、接好测量电路;
3、分别测定不同温度下的电动势。
五、原始数据

六、数据处理

根据曲线的方程(y=6×10-6x2-0.0036x+0.5798)可求出18℃、25℃、35℃下的E值,并由曲线的斜率(k=1.2×10-5x-0.0036)可得到歌温度下的温度系数 。
。
计算如下:
18℃时(x=291.15K):
E=6×10-6×219.152-0.0036×219.15+0.5798 = 0.04027 V
 =k= -1.06×10-4
=k= -1.06×10-4
25℃时(x=298.15K):
E=6×10-6×298.152-0.0036×298.15+0.5798 = 0.03982 V
 =K= -2.22×10-4
=K= -2.22×10-4
35℃时(x=308.15K):
E=6×10-6×308.152-0.0036×308.15+0.5798 = 0.04020 V
 = k=9.78×10-5
= k=9.78×10-5
2.计算18℃、25℃、35℃下的ΔrGm、ΔrSm、ΔrHm

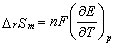

18℃时(T=291.15K):
 = -1×96500×0.04027 = -3886.05 J/mol
= -1×96500×0.04027 = -3886.05 J/mol
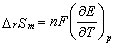 =1×96500×( -1.06×10-4) = -10.25 J/mol
=1×96500×( -1.06×10-4) = -10.25 J/mol
 = -3886.05+(-10.2)×291.15= -6869.84 J/mol 25℃时(T=298.15K):
= -3886.05+(-10.2)×291.15= -6869.84 J/mol 25℃时(T=298.15K):
 = -1×96500×0.03982 = -3842.68 J/mol
= -1×96500×0.03982 = -3842.68 J/mol
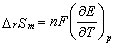 =1×96500×( -1.06×10-4) = -2.14 J/mol
=1×96500×( -1.06×10-4) = -2.14 J/mol
 = -3886.05+(-10.2)×291.15= -4481.41 J/mol 35℃时(T=308.15K):
= -3886.05+(-10.2)×291.15= -4481.41 J/mol 35℃时(T=308.15K):
 = -1×96500×0.04020 = -3879.16 J/mol
= -1×96500×0.04020 = -3879.16 J/mol
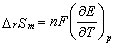 =1×96500×( -1.06×10-4) = 9.44 J/mol
=1×96500×( -1.06×10-4) = 9.44 J/mol
 = -3886.05+(-10.2)×291.15= -970.93 J/mol
= -3886.05+(-10.2)×291.15= -970.93 J/mol
七、思考题
1、本实验中,如果采用0.1或2.0mol/dm3的KCl溶液,对电池电动势测量是否有影响?为什么?
答:本实验中,如果采用0.1或2.0mol/dm3的KCl溶液,对电池电动势测量没有影响。本实验所采用的电极为将制备得到的Ag-AgCl电极与Hg-Hg2Cl2电极组成电池:Ag|AgCl|KCl(饱和)|Hg2Cl2|Hg,它的电极反应为: Ag+ Hg2Cl2→AgCl+Hg,可见该反应与KCl的浓度无关。
Hg2Cl2→AgCl+Hg,可见该反应与KCl的浓度无关。
2、如何用测得的电动势数据来计算电池反应的平衡常数?
答:可以通过公式△rGm = 计算,只要电动势E已知,便可求平衡常数
计算,只要电动势E已知,便可求平衡常数 。
。
第二篇:大学物理化学实验报告-电导法测定水溶性表面活性剂的临界胶束浓度

物理化学实验报告
院系 化学化工学院
班级 化学 061
学号 13
姓名 沈建明
实验名称电导法测定水溶性表面活性剂的临界胶束浓度
日期 2009.5.10 同组者姓名 史黄亮
室温 25℃ 气压 101.1 kPa
成绩
一、目的和要求
1. 了解表面活性剂的特性及胶束形成原理;
2. 掌握电导率仪的使用方法 ;
3. 用电导法测定十二烷基硫酸钠的临界胶束浓度。
二、基本原理
1. 表面活性剂是一类具有“两亲”性质的分子组成的物质,其分子由极性和非极性两部分组成。按离子的类型可分为阴离子型表面活性剂、阳离子型表面活性剂和非离子型表面活性剂三大类;
2. 当表面活性剂溶于水中后,不但定向地吸附在水溶液表面,而且达到一定浓度时还会在溶液中发生定向排列而形成胶束(图1);
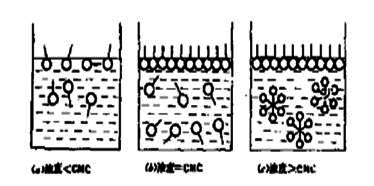
3. 随着表面活性剂在溶液中浓度的增长,球形胶束还可能转变成棒形胶束,以至层状胶束。如图2所示。后者可用来制作液晶,它具有各向异性的性质。
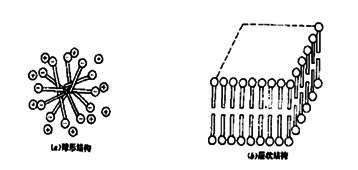
图2 胶束的球形结构和层状结构
4. 表面活性物质在水中形成胶束所需的最低浓度称为临界胶束浓度,以CMC表示。在CMC点上,由于溶液的结构改变导致其物理及化学性质与浓度的关系曲线出现明显转折,如下图所示 。
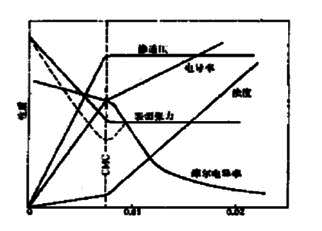
图3 25℃时十二烷基硫酸钠水溶液的物理性质和浓度关系
5. 本实验通过测定不同浓度的十二烷基磺酸钠水溶液的电导值,作电导率-浓度关系图,由图中的转折点即可求出十二烷基磺酸钠水溶液在该温度下的临界胶束浓度。
三、仪器、试剂
DDS-320型电导率仪 1 台
DJS-1C型铂黑电极 1 支
SC-15A数控超级恒温槽 1台
容量瓶(50mL) 3只
移液管(5mL) 1 支
移液管(10mL) 1 支
氯化钾(分析纯)
十二烷基硫酸钠(分析纯)
蒸馏水
四、实验步骤
1. 了解和熟悉DDS-320型电导率仪的构造和使用注意事项;
2. 用电导水或重蒸馏水准确配制0.01mol·L-1的KCl标准溶液(由老师配制);
3. 十二烷基硫酸钠在80℃烘干3小时后,用电导水或重蒸馏水准确配成0.020mol·L-1的溶液(由老师配制);
4. 预热恒温水浴;
5. 将0.020mol·L-1的十二烷基硫酸钠溶液准确稀释成浓度为0.002、0.004、0.006、0.007、0.008、0.009、0.010、0.012、0.014、0.016、0.018和0.020 mol·L-1的溶液各50ml(由于容量瓶有限,以三个浓度的溶液为一组,分四组完成);
6. 用电导仪从稀到浓分别测定上述各溶液的电导率(用后一个溶液荡洗存放过前一个溶液的电极及容器3次以上,各溶液测定前需恒温10min);
7. 每个溶液的电导率读数3次,取平均值;
五、原始数据
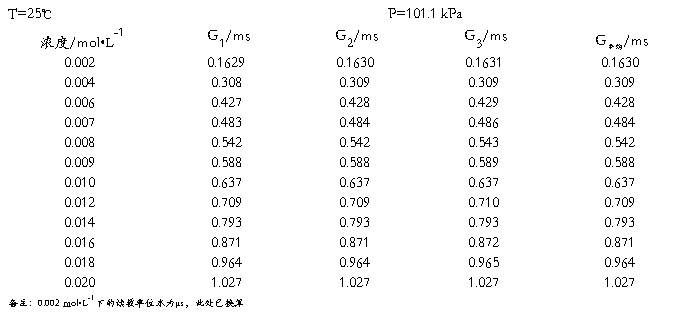
六、数据处理
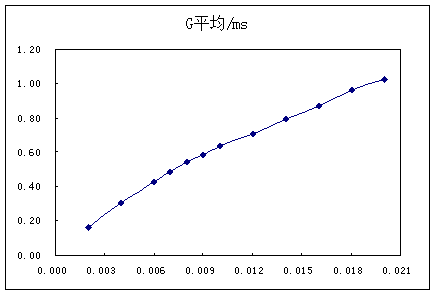
图(一)
因为实验所得结果的转折点不明显,采用如下方法:
先从图(一)粗略估计出转折点在浓度为0.009 mol·L-1处,在用EXCEL以0.009mol·L-1点为转折点画出两条直线,再根据所得方程求解转折点浓度(近似估计)。
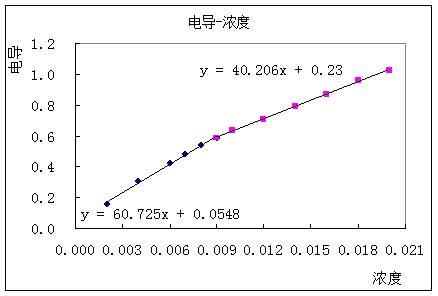
图(二)
解得 CMC[十二烷基硫酸钠,20℃] = 8.538×10-3 mol·L-1
与文献值的CMC[十二烷基硫酸钠,40℃] = 8.7×10-3 mol·L-1相比偏差不是很大。
七、思考题
1. 若要知道所测得的临界胶束是否准确,可用什么实验方法验证之?
答:可以通过其他试验方法测定同温度下的CMC,比较检验该方法测得的CMC是否准确。如表面张力法或紫外光谱法等。
2. 溶解的表面活性剂分子与胶束之间的平衡同温度和浓度有关,其关系式可表示为:
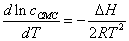
试问如何测出其热效应值?
答:通过测定不同温度下的临界较束浓度,在绘制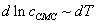 曲线即可求出ΔH。
曲线即可求出ΔH。
3. 非离子型表面活性剂能否用本实验方法测定临界胶束浓度?为什么?若不能,则可用何种方法测定?
答:不能,因为本实验时采用电导法测电导与浓度变化关系的转折点来确定临界胶束浓度,非离子型表面活性剂可导电的离子少,不能用电导法测,可以用表面张力和渗透压法测。
八、实验总结
该实验操作和数据处理较简单,原理部分也较容易理解,因此在试验过程中没有遇到难处。
希望老师以后可以讲解些其他测定物质CMC的方法。
九、注意事项
1. 稀释十二烷基硫酸钠溶液时,应防止振摇猛烈,产生大量气泡影响测定;
2. 测定时, 可用电导电极搅拌溶液的同时测定电导率, 直至电导率不再变化后记录数据;
3. 每次测定后,必须用下一个待测溶液充分荡洗电极和烧杯,以免溶液浓度变化引起测定误差;
4. 作图时应分别对图中转折点前后的数据进行线性拟合,找出两条直线,这两条直线的相交点所对应的浓度才是所求的水溶性表面活性剂的临界胶束浓度。
-
大学物理实验:长度测量(陈涛)
实验一长度测量1实验目的1掌握游标卡尺螺旋测微器移测显微镜的测量原理和使用方法2学习正确读取和记录测量数据3掌握数据处理中有效数字…
-
大学物理实验报告范例(长度和质量的测量)
怀化学院大学物理实验实验报告系别物信系年级20xx专业电信班级09电信1班姓名张三学号09104010组别1实验日期20xx102…
-
大学物理实验报告长度,质量,密度的测量
大学物理实验实验报告实验时间20xx年3月14日第3周XX学院班级学号20xxxxxxxx姓名XX同组者或组号18指导老师XXX得…
-
大学物理实验报告范例长度和质量的测量
实验项目长度和质量的测量实验题目长度和质量的测量实验目的1掌握米尺游标卡尺螺旋测微计等几种常用测长仪器的读数原理和使用方法2学会物…
-
大学物理实验——长度密度的测量2
学生实验报告课程大学物理实验学院机电工程学院专业班级日期20xx年12月20日一实验目的1熟练掌握有效数字的基本概念及其读取和运算…
-
第四版无机化学实验报告实验十三:醋酸解离度和解离常数的测定——pH计的使用
实验名称醋酸解离和解离常数的测定pH计的使用实验日期温度气压一实验目的1测定醋酸的解离度和解离常数2掌握滴定原理滴定操作及正确判断…
-
甲基红电离平衡常数测定实验预习报告
化学实验报告20xx年3月11日第一部分实验预习报告1实验目的要求测定弱电解质电离平衡常数了解指示剂变色反应原理学习使用721型或…
-
华师物化实验报告 液相平衡常数测定
华南师范大学实验报告学生姓名学号专业年级班级课程名称实验项目液相反应平衡常数的测定实验类型验证设计综合实验时间年月日实验指导老师实…
-
6液相反应平衡常数的测定实验报告
华南师范大学实验报告学生姓名学号专业化学师范年级班级课程名称物理化学实验实验项目液相反应平衡常数的测定实验类型验证设计综合实验时间…
-
碘的平衡常数测定实验报告
I3II2平衡常数的测定一实验目的1测定I3II2的平衡常数2加强对化学平衡平衡常数的理解并巩固平衡移动的原理3练习滴定操作二实验…
- 电池电动势及温度系数的测定-实验报告(四川理工学院)