酶工程实验报告
酶工程实验报告
指导老师:
学号: 20070830
姓名:
班级: 生物技术班
**师范大学生命科学学院07级
20##-11-15
生物工程实验指导(酶工程部分)
实验一 木瓜蛋白酶的分离纯化及酶活检测
一、概述
以半胱氨酸内肽酶为主(包括木瓜蛋白酶,简称PAP、木瓜蛋白酶Ω,简称CAR、木瓜凝乳蛋白酶,简称CHP和木瓜凝乳蛋白酶M,简称GEP)的木瓜蛋白酶是从植物番木瓜中分离纯化而得的一种混合酶。这种酶广泛存在于番木瓜的根、茎、叶和果实内,其中以为成熟的果实乳汁中含量最高,约占乳汁干中的40%。其最大的用途是在食品工业方面,防除啤酒冷藏混浊,嫩化肉类,生产调味品,烘烤面包,乳酪制品及谷类和速溶食品的蛋白质强化生产。在动物饲料加工方面,用于鱼蛋白浓缩物和油籽饼处理,能提高氮的可溶性指数和蛋白质的可分散指数。少量在皮革工业作软化剂、纺织工业作丝织品脱胶清洁剂和废胶卷回收报等。在医药方面,主要用于治胃炎、消化不良以及用于肉赘摘除、伤痕处理、脱毛、清洁皮肤和新近的裂腭整形外科及制木瓜凝乳蛋白酶注射剂治疗脊骨盘脱出症等。
木瓜蛋白酶是一种巯基蛋白酶,其专一性较差,能分解比胰脏蛋白酶更多的蛋白质。木瓜蛋白酶是单条链,有211个氨基酸残基组,相对分子量23000。木瓜凝乳蛋白酶,相对分子量36000,约占可溶性蛋白质的45%。溶菌酶,相对分子量2500,约占可溶性蛋白质的20%。
木瓜蛋白酶为白色、淡褐色无定型粉末或颗粒。略溶于水、甘油,不溶于乙醚、乙醇和氯仿。水溶液无色至淡黄色,有时呈乳白色。最适pH为5.0~8.0,微吸湿,有硫化氰臭。最适温度65℃,易变性失活。木瓜蛋白酶等电点pH=9.6。半胱氨酸、硫化物、亚硫酸盐和EDTA是木瓜蛋白酶激活剂,巯基试剂和过氧化氢是木瓜蛋白酶的抑制剂。
二、实验目的
1、学习和掌握木瓜蛋白酶分离纯化的原理、方法和工艺过程,包括盐析、酶活力保护、结晶与重结晶。 2、掌握木瓜蛋白酶活力的测定方法和原理。
三、能力培养目标
1、蛋白质分离纯化的工艺流程,特别是盐析操作技术的熟练掌握;
2、酶活力检测方法的掌握。
四、实验难点
采用盐析分离纯化技术制备酶类产品时如何保证酶活力的同时提高酶产品的得率。
五、实验方式、方法建议
1、集中式训练:学生在老师的讲解和指导下按如下步骤操作训练;
2、启发和探索式:老师提供木瓜蛋白酶的理化、生物学特性、相关分离纯化技术和工艺,让学生查阅资料,然后在下面生产工艺基础上进行一些工艺和操作参数的试验,比如在(NH4)2SO4分级分离后采用层析分离或透析,试验层析或透析操作参数和比较集中工艺的优劣,以培养学生灵活运用分离纯化技术的能力。
六、实验原辅材料和仪器设备
1.原辅材料
(1)木瓜乳汁的采集及采后处理
在清晨或中午下雨后,选择2.5~3月龄已充分长大的青木瓜,用锋利刀片在未成熟的青果表面纵割3~4条线,下刀深度在2mm深以内,环绕茎干装一倒伞型收集盘,接收流下的乳汁。割后30~60s乳汁停止流出,把粘在果上的乳汁赶入收集盘。用浸过硫酸钙或杀菌剂溶液的洁净布擦果,防切口感染。
(2)硅藻土和河沙:硅藻土选用化学纯试剂,河沙经清洗、浮选、烘干后过60~80目筛。
(3)半胱氨酸、(NH4)2SO4和NaCl均选用化学纯试剂。
(4)酶稀释液:半胱氨酸0.03mol/L(0.1537g)、EDTA.2Na0.00603mol/L(0.0935g),两者分开用适量蒸馏水溶解,再将EDTA.2Na溶液倒入半胱氨酸溶液中,使其溶解,调节至pH 4.5,定容至25ml。
(5)酪蛋白溶液(底物):称磷酸氢二钠1.447g加蒸馏水约80ml,溶解后加入0.80g酪蛋白,水浴上加热搅拌溶解,待完全溶解后,冷至室温,调pH至7.0,定容至100ml,摇匀。
(6)TCA溶液(变性剂):称三氯醋酸(TCA)2.247g,乙酸钠1.824g,冰醋酸2g,定容至l00ml。
(7)酪氨酸标准液(50μg/ml):称105℃烘至恒重的酪氨酸5.0㎎,用0.1 mol/L HCl定容至100ml。
2.主要仪器设备:研钵、高速冷冻离心机、紫外分光光度计、恒温水浴锅。
七、训练内容和步骤
1、木瓜蛋白酶的分离纯化(下午组数据)
(1)粗提:木瓜乳汁100g(实验中28.8g)、硅藻土50g(14g)和筛选过的砂子75g(21.8g)混匀,在室温下加100ml-150ml(50ml)半胱氨酸溶液(0.04mol/L,pH5.7),,在研钵中充分磨匀,静置后倾出上清液,再用150ml(50ml)半胱氨酸溶液重复研磨和洗提,然后用半胱氨酸溶液定容到500ml(166ml) (粗体积),用布氏漏斗过滤。以下几步尽量在冰浴上进行。
(2)除不溶物:取50ml滤液于小烧杯中,在搅拌下慢慢加入1mol/LNa0H溶液调pH至9.0,用36个1.5ml离心管盛装,离心(4℃,8000rpm/min,10min),取上清液。
(3)(NH4)2SO4分级分离:取38ml上清液于小烧杯中,加入9.23g(NH4) 2SO4至40%饱和溶液(1L:243g),静置2h。离心(4℃,8000rpm/min,10min),弃上清液,用饱和(NH4) 2SO4溶液洗沉淀一次,剩6管。
(4)NaCl分级沉淀:加半胱氨酸溶液(0.02mol/L,pH7.0)至满管,慢慢加入0.12g固体NaCl,静置lh,离心(4℃,8000rpm/min,20min)弃上清液。
(5)结晶:在沉淀中加半胱氨酸溶液(0.02 mol/L,pH5.7)至满管,立即调pH至6.5,静置30min,置于4℃下过夜,在4℃下离心(8000rpm/min,25min),收集结晶。
(6)重结晶:将上述结晶在室温下溶于少量蒸馏水(蛋白酶浓度约1%)。在搅拌下慢慢加入饱和NaCl溶液(10ml/300ml蛋白溶液),当约75%的溶液加入后。木瓜蛋白酶将开始结晶,置于4℃下过夜,收集结晶。
2、木瓜蛋白酶活性测定
(1)样品处理:在盛装结晶(样重约0.01g)的1.5ml离心管中加入酶稀释液500ul,混匀盖严,将酶激活15min以上(激活时半胱氨酸的浓度要高于0.03mol/L,而且要当天配制,激活的酶最好在2h内测完)备用。
(2)木瓜酶活力测定:将已激活的酶液置于37℃水浴保温10min ,吸取预热37℃酪蛋白液500ul加入此管,在37℃反应10min,立即加入300ul,TCA摇匀;另取已激活的样液500ul,加入300ul TCA,37℃保温10min后立即加入预热37℃酪蛋白液500ul,摇匀。以后管为对照,测前管的OD275值,即A=1.581。另取酪氨酸标准液,以蒸馏水作空白对照,测OD275值,即As=0.318。

As:50ug/ml酪氨酸的光吸收值;
A:1ml激活酶作用于底物所得产物的光吸收值;
50:标准酪氨酸的微克数/毫升;
10:反应时间(min);
500:酶第一次稀释倍数(定容体积);
3:激活时酶液的稀释倍数;
11:测定时酶液的稀释倍数。
八、实验结果与讨论
1、记录木瓜蛋白酶工艺、操作条件、各原辅材料和试剂用量。
盐析沉淀法是许多蛋白酶初步纯化阶段又一经常采用的方法。其原理为中性无机盐离子在较低浓度时会增加蛋白质的溶解度,但当盐浓度增加到一定的程度时盐离子与蛋白质表面具有相反电荷的离子基团结合使排斥力减弱而凝聚,同时,蛋白质表面的水化膜被破坏而引起蛋白质的沉淀。本实验盐析使用的中是性盐有硫酸铵和NaCl。
2、记录产品的形态及产品的重量。
它的外观为白色至浅黄色的粉末,微有吸湿性。约重0.01g
3、计算木瓜蛋白酶的产量、酶活力和实际得率。
A=1.581。As=0.318。酶活力=41016509(u/g)
4、对上述分离纯化方法进行评价。
木瓜蛋白酶的活力是41016509(U/g)。
A的吸光值大于1,可能不会特别准确。会出现误差,看能否通过稀释来解决该问题。
酶稀释液又不容物存在,可能的原因有:pH不合适;药品本身的原因;药品混合的顺序不对;溶解时需要加热或者超声波处理等。
提高溶液浓度可能更加有利于结晶和重结晶,以及沉淀等。
实验二 尼龙固定化木瓜蛋白酶及其应用研究
实验目的:
1、掌握尼龙为载体戊二醛为交联剂对木瓜蛋白酶进行固定化的方法。
2、了解检验固定化酶活力的方法。
一、材料与主要试剂
尼龙(6)或(66),市售140目。木瓜蛋白酶,本室制备,比活力205 U/mg蛋白。啤酒。酪蛋白(进口分装),戊二醛(E . Meyck),考马斯亮蓝G-250(sigma)等均为生化试剂或分析纯试剂。
二、方法
1、固定化木瓜蛋白酶制备
将尼龙布剪成约2g左右的小方块,置于干净培养皿中,用含18.6% CaCl2和18.6%水的甲醇溶液处理10min,洗净吸干。再用3.65mo1/L HCl水解45min,洗至pH中性,吸干。用5%戊二醛(25%水的戊二醛溶液和硼酸缓冲液配制)20℃交联20min,用0.1 mol/L pH7.8磷酸缓冲液洗除多余戊二醛。将2g(一小块)处理尼龙布剪成小块放入1.5ml离心管中,立即加入1mg/mL酶液(0.1g木瓜蛋白酶溶于0.1 mol/L pH 7.2磷酸缓冲液并定容至100mL,活力44.7U/mL,比活力205 U/mg蛋白)至满管,置于4-15℃冰箱中固定3h。用0.1 mol/L pH7.5磷酸缓冲液(含0.5mo1/L NaCl)洗至洗脱液在280nm波长处无光吸收,木瓜蛋白酶即固定在尼龙布上。
2、酶活力及蛋白质含量测定
取O.1mL酶液加入0.9mL激活剂(上述缓冲液内含20 mmol/L Cys, 1 mmol/L EDTA)37℃保温恒定,加人同样预热的1 %(W/V)酪蛋白溶液(上述缓冲液配制))1 mL,37℃反应10min,加人3mL10%三氛乙酸((TCA)溶液终止反应(对照管先加TCA,后加底物)。275nm波长下比色。在上述条件下每增加1个光吸收单位的酶量为1个酶活力单位(U)。取0.1g固定化酶加入1mL激活剂其余同溶液酶活力测定。蛋白质含量测定,按考马斯亮蓝G-250法。
3、考马斯亮蓝G-250法
称取100mg考马斯亮蓝G-250,溶解于50mL95%乙醇中,再加入100 mL85%(W/V)的磷酸,混匀,配成原液。临用前取原液15mL,加蒸馏水稀释至100mL,双层滤纸过滤,即为缓冲液A,4℃保存。
0.5mg/mL标准牛血清白蛋白溶液的配制:准确称取5mg牛血清白蛋白,溶解于适量的蒸馏水后,用缓冲液A定容至10mL。
(1)牛血清白蛋白标准曲线的测定
取6支试管,按下表加入标准蛋白溶液和缓冲液A。

在各管中分别加入5mL缓冲液A,混匀,室温放置2min。以0号管为空白对照,用1cm光程比色杯测量各样品在波长595nm下的吸光度A595。以A595为纵坐标,标准蛋白质含量为横坐标,在坐标纸上标准曲线。
(2)样品蛋白质含量的测量
取样品溶液500uL,再加入5mL缓冲液,混匀,室温放置2min,测量其在波长595nm下的吸光度A595。再根据标准曲线查出相当于标准蛋白的量,从而计算样品的蛋白质浓度(mg/mL)。
三、结果与讨论
1、固定化条件
溶液酶浓度对固定化的影响;温度,pH和固定时间对酶固定化的影响。
2、固定化酶的性质(Km值双倒数作图法)
3、固定化酶的效率
酶活实验结果是如表一:

表一
0.001为一个酶活单位。1.048-1.004=0.044。固定化酶的活力为44U。
吸光值有些大,结果可能应该小于44U。
吸光值与蛋白质的含量如表二,ABS标准曲线如图一。

表二
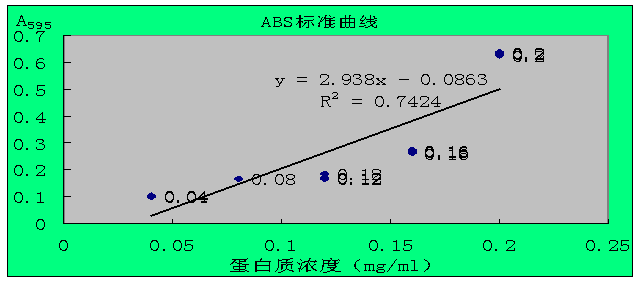
图一:ABS标准曲线

将A595吸光值0.11代入图一中公式,算出待测蛋白质的浓度为0.066814(mg/mL)。
R2<0.99,所以结果有可能可够准确,但是蛋白质含量0.066814(mg/mL)左右,有蛋白质被分解,进一步说明酶被固定。蛋白质减少量约为1-0.66814=0.33184mg。
固定化酶的优点:
①固定化酶可以多次使用,且在多数情况下,酶的稳定性提高,因而单位酶催化的底物量大增,用酶量大减,即单位酶的生产力提高。②固定化酶极易与底物、产物分开,因而产物溶液中没有酶的残留,使产物提纯工艺简化,产率提高,产品质量较好。③固定化酶催化的反应条件易于控制,可以装柱连续反应,进行自动化生产,节省劳动力,减少反应器占地面积。④与溶液酶相比,固定化酶更适合实现多酶反应。 ⑤辅酶固定化和辅酶再生技术的应用,可使固定化酶和能量再生系统或氧化还原系统合
3、本实验戊二醛做为交联剂,能在线型分子间起架桥作用从而使多个线型分子相互键合交联成网络结构,固定在尼龙上
三. 实验分析
1、酶在水溶液中以自由的游离状态存在,但是固定后酶分子便从游离的状态变为牢固地结合于载体的状态,其结果往往引起酶的性质的改变。为此,在固定化酶的应用过程中,必须了解固定化酶的性质与游离酶之间的差别,并对操作条件加以适当调整。
2、由于固定化的方法不同,固定化酶的活力和性质也有所不同.上述实验用的是交联法。我们还可以用物理吸附法、结合法、包埋法等来使酶固定
酶工程实验所需仪器和材料
材料:1.木瓜青果;2.尼龙(6)或(66),市售140目3.浸过硫酸钙或杀菌剂溶液的洁净抹布4.啤酒
药品:1.焦亚硫酸钠 2.硅藻土和河沙3.半胱氨酸、4.(NH4)2SO4 5.NaCl 6.EDTA.2Na 7.磷酸氢二钠 8.酪蛋白(进口分装) 9.三氯醋酸(TCA) 10.乙酸钠 11.冰醋酸 12.酪氨酸 13.氢氧化钠 14.石英砂 15.磷酸氢二钠 16.酪蛋白 17.戊二醛(E . Meyck),18.考马斯亮蓝G-250(sigma) 19.CaCl2 10.甲醇 21. HCl 22.磷酸缓冲液 23.95%乙醇 24.磷酸 25牛血清白蛋白等均为生化试剂或分析纯试剂。
仪器:1.刀片 2.伞型收集盘 3. 60~80目筛 4.ph计 5. 25ml,100ml容量瓶 6.研钵 7.高速冷冻离心机 8.紫外分光光度计 9.恒温水浴锅 10.布氏漏斗
20##-11-15
第二篇:elisa酶联免疫吸附实验报告
elisa酶联免疫吸附实验报告
一.实验目的
酶联免疫吸附测定(enzyme-linked immunosorbent assay 简称ELISA)是在免疫酶技术(immunoenzymatic techniques)的基础上发展起来的一种新型的免疫测定技术,ELISA过程包括抗原(抗体)吸附在固相载体上称为包被,加待测抗体(抗原), 再加相应酶标记抗体(抗原),生成抗原(抗体)--待测抗体(抗原)--酶标记抗体的复合物,再与该酶的底物反应生成有色产物。借助分光光度计的光吸收计算抗体(抗原)的量。待测抗体(抗原)的定量与有色产生成正比。
二.实验原理
用于免疫酶技术的酶有很多,如过氧化物酶,碱性磷酸酯酶,β-D-半乳糖苷酶,葡萄糖氧化酶,碳酸酐酶,乙酰胆碱酯酶,6-磷酸葡萄糖脱氧酶等。常用于ELISA法的酶有辣根过氧化物酶,碱性磷酸酯酶等,其中尤以辣根过氧化物酶为多。由于酶摧化的是氧化还原反应,在呈色后须立刻测定,否则空气中的氧化作用使颜色加深,无法准确地定量。
辣根过氧化物酶(HRP)是一种糖蛋白,每个分子含有一个氯化血红素(protonhemin)区作辅基。酶的浓度和纯度常以辅基的含量表示。氯化血红素辅基的最大吸收峰是403nm,HRP酶蛋白的最大吸收峰是275nm,所以酶的浓度和纯度计算式是(已知HRP的A(1cm 403nm 1%)=25,式中1%指HRP百分浓度为100ml含酶蛋白1g,即10mg/ml,所以,酶浓度以 mg/ml 计算是HRP的A(1cm 403nm mg/ml=2.5)HRP纯度(RZ)=A403nm/A275nm纯度RZ(Reinheit Zahl)值越大说明酶内所含杂质越少。高纯度HRP的RZ值在3.0左右,最高可达3.4。用于ELISA检测的HRP的RZ值要求在3.0以上。
ELISA的基本原理有三条:
(1)抗原或抗体能以物理性地吸附于固相载体表面,可能是蛋白和聚苯乙烯表面间的疏水性部分相互吸附,并保持其免疫学活性;
(2)抗原或抗体可通过共价键与酶连接形成酶结合物,而此种酶结合物仍能保持其免疫学和酶学活性;
(3)酶结合物与相应抗原或抗体结合后,可根据加入底物的颜色反应来判定是否有免疫反应的存在,而且颜色反应的深浅是与标本中相应抗原或抗体的量成正比例的,因此,可以按底物显色的程度显示试验结果。
ELISA法是免疫诊断中的一项新技术,现已成功地应用于多种病原微生物所引起的传染病、寄生虫病及非传染病等方面的免疫诊断。也已应用于大分子抗原和小分子抗原的定量测定,根据已经使用的结果,认为ELISA法具有灵敏、特异、简单、快速、稳定及易于自动化操作等特点。不仅适用于临床标本的检查,而且由于一天之内可以检查几百甚至上千份标本,因此,也适合于血清流行病学调查。本法不仅可以用来测定抗体,而且也可用于测定体液中的循环抗原,所以也是一种早期诊断的良好方法。因此ELISA法在生物医学各领域的应用范围日益扩大,可概括四个方面: 1、免疫酶染色各种细胞内成份的定位。 2、研究抗酶抗体的合成。 3、显现微量的免疫沉淀反应。 4、定量检测体液中抗原或抗体成份。
基本方法一 用于检测未知抗原的双抗体夹心法:
1. 包被:用0.05M PH9.牰碳酸盐包被缓冲液将抗体稀释至蛋白质含量为1~10μg/ml。在每个聚苯乙烯板的反应孔中加0.1ml,4℃过夜。次日,弃去孔内溶液,用洗涤缓冲液洗3次,每次3分钟。(简称洗涤,下同)。
2. 加样:加一定稀释的待检样品0.1ml于上述已包被之反应孔中,置37℃孵育1小时。然后洗涤。(同时做空白孔,阴性对照孔及阳性对照孔)。
3. 加酶标抗体:于各反应孔中,加入新鲜稀释的酶标抗体(经滴定后的稀释度)0.1ml。37℃孵育0.5~1小时,洗涤。
4. 加底物液显色:于各反应孔中加入临时配制的TMB底物溶液0.1ml,37℃10~30分钟。
5. 终止反应:于各反应孔中加入2M硫酸0.05ml。
6. 结果判定:可于白色背景上,直接用肉眼观察结果:反应孔内颜色越深,阳性程度越强,阴性反应为无色或极浅,依据所呈颜色的深浅,以“+”、“-”号表示。也可测O•D值:在ELISA检测仪上,于450nm(若以ABTS显色,则410nm)处,以空白对照孔调零后测各孔O•D值,若大于规定的阴性对照OD值的2.1倍,即为阳性。
基本方法二 用于检测未知抗体的间接法:
用包被缓冲液将已知抗原稀释至1~10μg/ml, 每孔加0.1ml,4℃过夜。次日洗涤3次。
↓
加一定稀释的待检样品(未知抗体)0.1ml于上述已包被之反应孔中,置37℃孵育1小时,洗涤。(同时做空白、阴性及阳性孔对照)
↓
于反应孔中,加入新鲜稀释的酶标第二抗体(抗抗体)0.1ml,37℃孵育30-60分钟,洗涤,最后一遍用DDW洗涤。
↓
其余步骤同“双抗体夹心法”的4、5、6。
(二) 酶与底物
酶结合物是酶与抗体或抗原, 半抗原在交联剂作用下联结的产物。是ELISA成败的关键试剂,它不仅具有抗体抗原特异的免疫反应,还具有酶促反应,显示出生物放大作用,但不同的酶选用不同的底物。
免疫技术常用的酶及其底物
酶 底物 显色反应 测定波长
辣根过氧化物酶 邻苯二胺 橘红色 492*
四甲替联苯胺 黄色 460**
氨基水杨酸 棕色 449
邻联苯甲胺 兰色 425
2,2'-连胺基-2(3-乙基-并噻唑啉磺酸-6)铵盐 蓝绿色 642
碱性磷酸酯酶 4-硝基酚磷酸盐(PNP) 黄色 400
萘酚-AS-Mx磷酸盐+重氮盐 红色 500
葡萄糖氧化酶 ABTS+HRP+葡萄糖 黄色 405,420
葡萄糖+甲硫酚嗪+噻唑兰 深蓝色
β-D-半乳糖苷酶 甲基伞酮基半乳糖苷(4MuG) 荧光 360,450
硝基酚半乳糖苷(ONPG) 黄色 420
* 终止剂为2mol/L H2SO4
** 终止剂为2 mol/L柠檬酸, 不同的底物有不同的终止剂。
可催化下列反应: HRP+H2O2→复合物 复合物+AH2→过氧化物酶+H2O+A AH2 ——为无色底物, 供氢体; A—— 为有色产物。
(三) ELISA常用的四种方法
1.直接法测定抗原
将抗原吸附在载体表面;
加酶标抗体,形成抗原—抗体复合物;
加底物。底物的降解量=抗原量。
2.间接法测定抗体
将抗原吸附于固相载体表面;
加抗体, 形成抗原-抗体复合物;
加酶标抗体;
加底物。 测定底物的降解量=抗体量。
3.双抗体夹心法测定抗原
将抗原免疫第一种动物获得的抗体吸附于固相表面;
加抗原,形成抗原-抗体复合物;
加抗原免疫第二种动物获得的抗体,形成抗体抗原抗体复合物;
加酶标抗抗体(第二种动物抗体的抗体);
加底物。底物的降解量=抗原量。
4. 竞争法测定抗原
将抗体吸附在固相载体表面;
(1) 加入酶标抗原;
(2),(3)加入酶标抗原和待测抗原;
加底物。对照孔与样品孔底物降解量的差=未知抗原量。
三.仪器和材料
1. 聚苯乙烯微量细胞培养板(平板, 40, 96孔)。
2. 酶联免疫检测仪
3. 辣根过氧化物酶羊抗兔IgG, 工作稀释度1:1000。
4. 包被液::0.05mol/L pH9.6碳酸缓冲液,4℃,保存, Na2CO3 0.15克, NaHCO3 0.293克,蒸馏水稀释至100 ml。
5. 稀释液:0.01mol/LpH7.4 PBS--Tween--20, 4℃,保存. NaCl 8g, KH2PO4 0.2g, Na2HPO4.12H2O 2.9g, Tween—20,0.5ml. 蒸馏水加至1000ml。
6. 洗涤液:同稀释液
7. 封闭液:0.5%鸡卵清蛋白,pH7.4 PBS。
8. 邻苯二胺溶液(底物):临用前配制 0.1M 柠檬酸(2.1g/100ml), 6.1ml 0.2M Na2HPO4.12H2O (7.163g/100ml) 6.4ml, 蒸馏水12.5ml, 邻苯二胺10mg, 溶解后, 临用前加30%H2O2 40 微升。
9. 终止液:2mol/LH2SO4。
四. 操作步骤
1. 包被抗原:用包被液将抗原作适当稀释, 一般为1~10微克/孔,每孔加200微升,37℃温育1小时后,4℃冰箱放置16~18小时。
2. 洗涤:倒尽板孔中液体,加满洗涤液,静放三分钟,反复三次,最后将反应板倒置在吸水纸上,使孔中洗涤液流尽。
3. 加封闭液200微升,37℃放置一小时。
4. 洗涤同2。
5. 加被检血清:用稀释液将被检血清作几种稀释,,每孔200微升。同时作稀释液对照。37℃放置2小时。
6. 洗涤同2。
7. 加辣根过氧化物酶羊抗兔IgG, 每孔200微升, 放置37℃ 1小时。
8. 洗涤同2。
9. 加底物:邻苯二胺溶液加200ml,室温暗处10--15分钟。
10. 加终止液:每孔50微升。
11. 观察结果:用酶联免疫检测仪记录490nm读数。
-
实验报告格式模板-供参考
实验名称:粉体真密度的测定粉体真密度是粉体质量与其真体积之比值,其真体积不包括存在于粉体颗粒内部的封闭空洞。所以,测定粉体的真密度…
-
实验报告 范本
研究生实验报告范本实验课程实验名称实验地点学生姓名学号指导教师范本实验时间年月日一实验目的熟悉电阻型气体传感器结构及工作原理进行基…
-
实验报告格式
实验报告课程名称物证技术学实验项目名称捺印手印样本指纹显现提取班级与班级代码074213070853实验室名称或课室法学实验教学中…
-
实验报告要求及范文
滁州市政府组织退耕还林(黑体,小二,1.5倍行距,段前段后0.5行)——5060451007范雪花(学号,TimesNewRoma…
-
实验报告单
科学实验报告单1科学实验报告单2科学实验报告单3科学实验报告单4九完小科学实验报告单10九完小科学实验报告单11九完小科学实验报告…
-
外科手术实验报告
实验一外科手术器械及其使用【学习目的和要求】1.认识常用的手术器械。2.掌握外科常用器械的结构特点和基本性能。3.掌握常用手术器械…
-
马路大医学实验报告
资料信息●此次人体冻伤实验时间为19xx年x月x日到2月x日,地点为“蒙自治联合政府”锡林郭勒蒙西苏尼特西方盆地(现为内蒙古自治区…
-
动物生理学实验指导实验报告
动物生理学实验指导教案动物生理学研究性实验的程序与基本要求动物生理学不仅是一门理论性很强的基础性学科而且是实验性很强的学科它的许多…
-
大学物理光学演示实验报告
反射光学显微镜的原理及应用这一次我们的物理演示实验的内容是光学刚一踏进光学演示实验室我就一下子被各种各样的实验仪器以及那些奇妙的实…
-
教科版三年级上册科学实验报告单
科学实验报告单许口小学科学实验报告单许口小学科学实验报告单许口小学科学实验报告单许口小学科学实验报告单许口小学科学实验报告单许口小…