分析化学实验报告本(1)
《分 析 化 学》
实 验 报 告 本
专业:
班级:
教师:
学生:
学号:
四川化工职业技术学院
制药与环境工程系工业分析教研室
分析化学实验报告
实验 1 实验名称:天平称量练习(一)、(二)
完成日期
一、目的要求
二、仪器与试剂
三、实验步骤
1. 天平使用规则
2. 直接法称量练习
3. 减量法称量练习
四、实验数据记录与处理
1. 直接法称量

2. 减量法称量(称量范围:0.3~0.5 g)

五、思考题及实验误差分析
六、心得、体会、建议和意见
分析化学实验报告
实验 2 实验名称:移液管、容量瓶、滴定管的基本操作练习;
酸碱标准溶液的配制和浓度的比较
完成日期
一、目的要求
二、仪器与试剂
三、实验步骤
1. 移液管、容量瓶和滴定管的基本操作方法
2. 0.1mol·L-1 的HCl标准溶液的配制
3.0.1mol·L-1 的NaOH标准溶液的配制
4. 酸碱标准溶液浓度的比较
四、实验数据记录与处理
1. NaOH滴定HCl
指示剂: ;终点颜色变化:由 色变为 色。

2. HCl滴定NaOH
指示剂: ;终点颜色变化:由 色变为 色。

五、思考题及实验误差分析
六、心得、体会、建议和意见
分析化学实验报告
实验 3 实验名称:盐酸标准溶液浓度的标定;
混合碱液中Na2CO3、NaHCO3含量测定
完成日期
一、目的要求
二、实验原理
1. 盐酸标准溶液的配制和标定
配制方法: ;标定方式: ;基准物质: ;
标定反应式:
指示剂: ;终点颜色变化:由 色变为 色。
2. 混合碱液中Na2CO3、NaHCO3含量测定
测定方法: ;标准滴定溶液: ;
滴定反应式:
指示剂: 和 ;
终点颜色变化:第一滴定终点,溶液由 色变为 色;第二滴定终点,溶液由 色变为 色。
三、仪器与试剂
四、实验步骤
1.0.1mol·L-1 HCl标准溶液浓度的标定
2.混合碱液中Na2CO3、NaHCO3含量的测定
五、实验数据记录与处理
1. 盐酸标准溶液浓度的标定

计算公式:c(HCl)/ mol·L-1 =
式中各符号的意义:
2. 混合碱液中Na2CO3、NaHCO3含量测定

计算公式:ρ(Na2CO3)/g· mL-1 =
ρ(NaHCO3)/g· mL-1 =
式中各符号的意义:
六、思考题及实验误差分析
七、心得、体会、建议和意见
分析化学实验报告
实验 4 实验名称:氢氧化钠标准溶液浓度的标定;食用醋质量检验
完成日期
一、目的要求
二、实验原理
1. 氢氧化钠标准溶液的配制和标定
配制方法: ;标定方式: ;基准物质: ;
标定反应式:
指示剂: ;终点颜色变化:由 色变为 色。
2. 实用醋中乙酸含量的测定
测定方法: ;标准滴定溶液: ;
滴定反应式:
指示剂: ;终点颜色变化:由 色变为 色。
三、仪器与试剂
四、实验步骤
1.0.1mol·L-1 NaOH标准溶液浓度的标定
2.食用醋中乙酸含量的测定
五、实验数据记录与处理
1. 氢氧化钠标准溶液浓度的标定

计算公式:c(NaOH )/ mol·L-1 =
式中各符号的意义:
2. 食用醋中乙酸含量的测定

计算公式:ρ(HAc)/g· mL-1 =
式中各符号的意义:
六、思考题及实验误差分析
七、心得、体会、建议和意见
分析化学实验报告
实验 5 实验名称:EDTA标准溶液的配制和标定;Ca、Mg含量的测定
完成日期
一、目的要求
二、实验原理
1. EDTA标准溶液的配制和标定
配制方法: ;标定方式: ;基准物质: ;
标定反应式:
指示剂: ;终点颜色变化:由 色变为 色。
2. 水的总硬度(钙镁含量)测定
测定方法: ;标准滴定溶液: ;
滴定反应式:
指示剂: ;终点颜色变化:由 色变为 色。
三、仪器与试剂
四、实验步骤
1.0.02mol·L-1EDTA标准溶液的配制和标定
2.水的总硬度测定
五、实验数据记录与处理
1. EDTA标准溶液浓度的标定

计算公式:c(EDTA)/mol·L-1 =
式中各符号的意义:
2. 自来水总硬度的测定

计算公式:总硬度/度 =
式中各符号的意义:
六、思考题及实验误差分析
七、心得、体会、建议和意见
分析化学实验报告
实验 6 实验名称:KMnO4标准溶液的配制和标定;H2O2含量的测定
完成日期
一、目的要求
二、实验原理
1. KMnO4标准溶液的配制和标定
配制方法: ;标定方式: ;基准物质: ;
标定反应式及反应条件:
指示剂: ;终点颜色变化:由 色变为 色。
2. H2O2含量测定
测定方法: ;标准滴定溶液: ;
滴定反应式:
指示剂: ;终点颜色变化:由 色变为 色。
三、仪器与试剂
四、实验步骤
1. c( KMnO4)= 0.1mol·L-1 KMnO4标准溶液的配制和标定
KMnO4)= 0.1mol·L-1 KMnO4标准溶液的配制和标定
2.H2O2含量的测定
五、实验数据记录与处理
1. KMnO4标准溶液的标定

计算公式:c( KMnO4)/ mol·L-1 =
KMnO4)/ mol·L-1 =
式中各符号的意义:
2. H2O2含量的测定

计算公式: (H2O2)/(g·mL-1)=
(H2O2)/(g·mL-1)=
式中各符号的意义:
六、思考题及实验误差分析
七、心得、体会、建议和意见
分析化学实验报告
实验 实验名称:
完成日期
一、目的要求
二、实验原理
三、仪器与试剂
四、实验步骤
五、分析仪器操作要点
六、实验数据记录与处理
七、思考题及实验误差分析
八、心得、体会、建议和意见
分析化学实验报告
实验 实验名称:
完成日期
一、目的要求
二、实验原理
三、仪器与试剂
四、实验步骤
五、分析仪器操作要点
六、实验数据记录与处理
七、思考题及实验误差分析
八、心得、体会、建议和意见
第二篇:分析化学实验报告本模版
实验一 电子分析天平的操作及称量练习
学院/专业/班级:______________________________ 姓名:
学号:________________ 实验日期______年__月__日 教师评定:______________
【实验目的】
①掌握电子分析天平的基本操作和粉末状样品的称量方法;
②开始培养准确、简明地记录原始数据的习惯,不得涂改数据,不得将测量数据记录在实验报告以外的任何地方。
【实验原理】
电子天平有顶部承载式(吊挂单盘)和底部承载式(上皿式)两种,根据电磁力补偿工作原理,使物体在重力场中实现力的平衡或通过电磁矩的调节,使物体在重力场中实现力矩平衡,整个过程均由微处理器进行计算和调控。秤盘加载后,即接通了补偿线圈的电流,计算器就开始计算冲击脉冲,达到平衡后,显示屏上即自动显示出天平所承载的质量值。
电子天平具有自动调零、自动校准、自动“除皮”和自动显示称量结果等功能,因此操作简便,称量快速,还能与计算机、打印机等联用,可在数秒内将所称量的质量显示并打印出来。
【仪器及试剂】
仪器:电子分析天平(型号:________________);保干器;称量瓶;称量纸;试剂勺;小烧杯等
试剂:练习使用试剂(干燥处理后,装入称量瓶中,保存于保干器内)
【实验步骤】
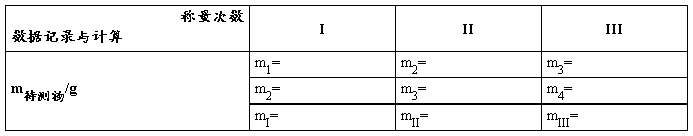
【数据记录及处理】
1. 直接法:小纸铲质量m=____________g
2. 增重法:目标质量m=0.2034 g;实际称量m1=___________g;m2=___________g;m3=___________g
3.减重法:目标质量范围m=0.2~0.3g
【思考与讨论】
实验二 食醋中总酸度的测定
学院/专业/班级:______________________________ 姓名:
学号:________________ 实验日期______年__月__日 教师评定:______________
【实验目的】
①学习、掌握滴定分析常用仪器的洗涤方法;
②练习滴定分析基本操作和正确判断终点;
③学习NaOH标准溶液的配制和标定方法;
④学习食醋中总酸度的测定方法。
【实验原理】
食醋的主要成分是醋酸(HAc,其含量约为3% ~ 5%),另外还有少量的其它有机弱酸,例如乳酸等。用NaOH标准溶液进行滴定时,试样中离解常数Kθ³10-7的弱酸都可以被滴定,其滴定反应为: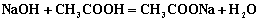 ;
; 。因此,测定的为食醋中的总酸量,分析结果通常用含量最多的 HAc表示。
。因此,测定的为食醋中的总酸量,分析结果通常用含量最多的 HAc表示。
本实验滴定类型属强碱滴定弱酸,滴定突跃在碱性范围,其理论终点的 pH在8.7左右,可选用酚酞作为指示剂。
【实验试剂】
KHC8H4O4 (基准物,105°C烘至恒重于干燥器内保存备用)
NaOH溶液:500 g×L-1
酚酞指示剂:2 g×L-1(乙醇溶液)
食醋试样(待测)
【实验步骤】
(1)0.1 mol×L-1 NaOH标准溶液的配制与标定
①用10 mL量筒量取500 g×L-1 NaOH溶液_____mL,倾入_____mL的聚乙烯试剂瓶中,用水洗涤量筒数次,洗涤液并入试剂瓶中,稀释至_____mL,摇匀后备用。
②用减重法称取_____ ~ _____ g的KHC8H4O4置于三个编好号*的锥形瓶中,分别加入20~30 mL蒸馏水,小心摇动,使其溶解(慎用玻棒!*),然后加入2滴酚酞指示剂,用所配制NaOH溶液滴定至溶液呈微红色且30 s内不褪色为终点,记下所消耗NaOH的体积,计算所配制NaOH溶液的浓度。
(2)食醋试液总酸度的测定
①用移液管移取待测试液_____mL至_____mL容量瓶中,用煮沸并冷却后的水定容。
②用25 mL移液管移取上述试液至250 mL锥形瓶中,滴加2~3滴酚酞指示剂,用NaOH标准溶液滴定至溶液呈微红色并保持30 s内不褪色即为终点,记下所消耗NaOH的体积。根据NaOH标准溶液的浓度和滴定时消耗的体积,求算食醋中的总酸量ρHAC(单位为g·L-1 )。
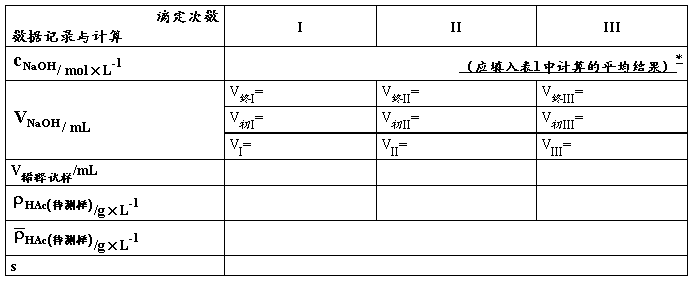
【数据记录及处理】
表1. NaOH溶液的标定(PP为指示剂)
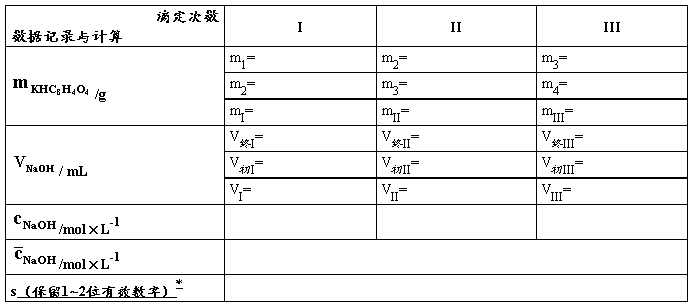
*表格后应附主要计算公式(平均值、标准差的公式不必列出),用表格中的符号表示即可,此处给出实例,以后请同学自行列出公式。
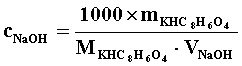 (例)
(例)
表2. 食醋试液总酸度的测定
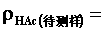
【思考与讨论】
实验三 水的总硬度的测定
学院/专业/班级:______________________________ 姓名:
学号:________________ 实验日期______年__月__日 教师评定:______________
【实验目的】
①掌握EDTA标准溶液的配制与标定;
②掌握 EDTA法测定水的硬度的原理和方法,了解金属指示剂的特点;
③了解水硬度的测定意义和常用硬度的表示方法。
【实验原理】
【实验试剂】
ZnO(基准试剂,900~1000 °C下灼烧至衡重保存于保干器)
EDTA二钠盐(分析纯)
络黑T(EBT):EBT与NaCl的固体混和物
HCl溶液:6 mol×L-1
氨水溶液:1:1(浓氨水与水等体积混合)
氨性缓冲溶液:pH=10
自来水样
【实验步骤】
(1)0.01 mol×L-1 Zn2+标准溶液的配制
准确称取0.2034 g(偏差可在±10%以内)*于小烧杯,加入 6 mol×L-1 HCl 2~3 mL*,用玻棒搅拌至完全溶解*,转移至250 mL 容量瓶中,用水定容后摇匀。
(2)0.01 mol×L-1 EDTA标准溶液的配制与标定
①称取_____g EDTA二钠盐固体于小烧杯中,加入适量水溶解(可适当加温、搅拌),冷却后转移至试剂瓶中稀释至_____mL,摇匀。
②移取25.00 mL Zn2+标准溶液于250 mL锥形瓶中,加入20~30 mL水,不断摇动下,逐滴*加入1:1的氨水直至白色沉淀产生,继续滴加至白色沉淀恰好完全溶解。加入_____mL pH=10的氨性缓冲溶液和适量EBT指示剂(此时溶液为酒红色),用所配制的EDTA溶液滴定至溶液由酒红色变为纯蓝色为终点,平行滴定三次,计算所配制EDTA溶液的准确浓度。
(3)水样总硬度的测定
移取澄清水样_____mL于锥形瓶中,加入_____mL氨性缓冲溶液及适量铬黑T指示剂,立即用0.01 mol·L -1 EDTA标准溶液滴定,近终点要慢滴多摇,颜色由紫红色变为纯蓝色即为终点。平行滴定三份,所耗EDTA标准溶液体积应不大于0.05 mL。根据EDTA标准溶液的浓度及用量等计算水的总硬度,实验结果以“mg·L-1”表示。
【数据记录及处理】
表1. Zn2+标准溶液的配制

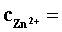
表2. EDTA溶液的配制与标定(EBT为指示剂)
称取EDTA g溶于 水中
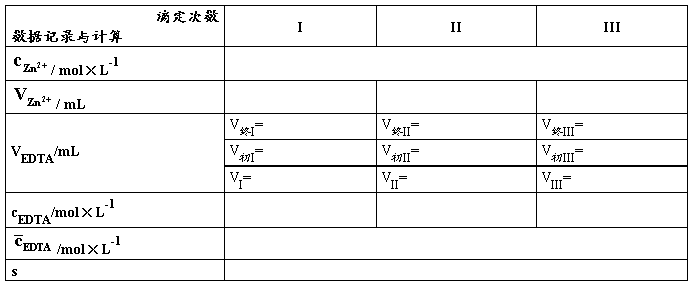
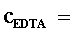
表3. 自来水样的总硬度测定(EBT为指示剂)
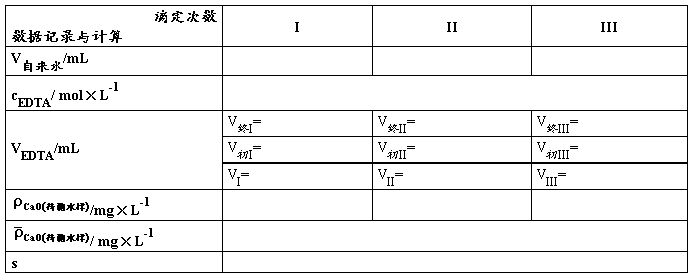
 /mg×L-1=
/mg×L-1=
【思考与讨论】
实验四 双氧水中过氧化氢含量的测定
学院/专业/班级:______________________________ 姓名:
学号:________________ 实验日期______年__月__日 教师评定:______________
【实验目的】
①掌握高锰酸钾标准溶液的配制及标定方法;
②学习高锰酸钾法测定过氧化氢的原理和方法。
【实验原理】
【实验试剂】
Na2C2O4 (基准物,105°C下干燥2小时存于保干器中备用)
KMnO4溶液:_____mol×L-1
H2SO4溶液:3 mol×L-1
市售双氧水(待测样品)
【实验步骤】
(1)0.02 mol×L-1 KMnO4标准溶液的配制与标定
①量取_____mL_____mol×L-1的KMnO4溶液于_____mL烧杯中,稀释至_____mL,摇匀备用。
②准确称取_____ ~ _____g Na2C2O4至于250 mL锥形瓶中,加入30 mL水及15 mL 3 mol×L-1 H2SO4溶液,溶解后加热至70~80°C(刚好冒出蒸气),趁热用KMnO4溶液进行滴定,开始滴定时要慢而摇动均匀,一定等前一滴KMnO4的红色完全褪去后再滴入下一滴,随着滴定过程的进行,滴定速度可适当加快,直至滴定的溶液呈微红色色并保持半分钟中不褪色即为终点。注意整个过程中温度应该保持在60°C以上。平行滴定三份,计算所配制的KMnO4溶液的准确浓度。
(2)市售双氧水中H2O2含量的测定
①用吸量管吸取1.00 mL 市售双氧水(30 %)于250 mL容量瓶中,加水定容后充分摇匀。
②用移液管移取25.00 mL上述稀释过后的双氧水溶液,置于250 mL锥形瓶中,加入20 mL 3 mol·L-1 H2SO4 ,用KMnO4 标准溶液滴定到溶液呈微红色并保持30秒不褪色即为终点。平行测定3次,计算市售双氧水中H2O2的含量。
【数据记录及处理】
表1. KMnO4标准溶液的配制与标定
量取_____mL_____mol×L-1KMnO4溶液稀释至_____mL
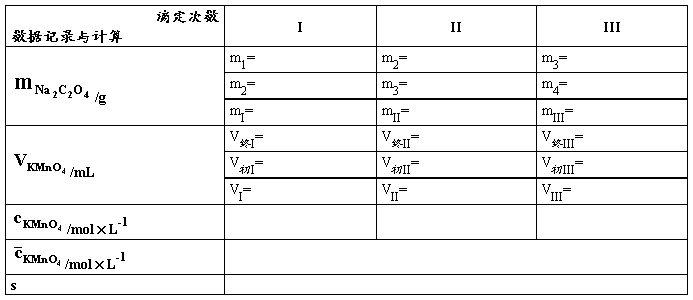
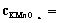
表2. 市售双氧水中H2O2含量的测定
移取 mL的双氧水试样至 mL的容量瓶中,用水稀释至刻度。(稀释倍数n= )

【思考与讨论】
-
分析化学实验报告
分析化学实验报告20xx0218200858分类理工类标签字号大中小订阅盐酸和氢氧化钠标准溶液的配制和标定时间12月15号指导老师…
-
分析化学实验报告(武汉大学第五版)
分析化学实验报告陈峻贵州大学矿业学院贵州花溪550025摘要熟悉电子天平的原理和使用规则同时可以学习电子天平的基本操作和常用称量方…
-
分析化学实验报告
级名分析化学实验报吉林农业大学告班姓同组人实验酸碱标准溶液的配制和比较滴定实验目的实验原理实验步骤1酸碱标准溶液的配制101mol…
-
分析化学实验报告样本
实验名称游标卡尺的使用实验目的1掌握游标卡尺的使用方法2了解游标卡尺的结构原理3学习数据处理的相关内容4养成良好的写实验报告的习惯…
-
分析化学实验报告
HarbinEngineeringUniversityHarbinEngineeringUniversity实验题目姓名班级学号同…
-
分析化学实验报告七
硫酸铜中铜含量的测定摘要:利用间接碘量法测定铜离子的含量。旨在掌握硫代硫酸钠溶液的配制和保存,并掌标定握硫代硫酸钠溶液浓度的原理和…
-
分析化学实验报告
四川农业大学实验报告课程名称:分析化学实验实验名称:班级学号学生姓名指导教师硫酸铜中铜含量的测定作者:李豪杨蕊摘要:利用间接碘量法…
-
分析化学实验报告3. CAT-20xx-0924-ST
血红蛋白过氧化物酶特性的测定一.目的了解血红蛋白的特殊性质,学习利用时间扫描法测定酶活力的方法,并加深理解过氧化物酶的催化作用。二…
-
《分析化学实验》总结
定量分析是一门实验性课程,通过分析化学实验可以是我们对分析学化学基本理论进一步加深理解,并能够熟练地掌握定量分析的基本操作技能,为…
-
分析化学实验心得
分析化学实验心得体会分析化学是人们获得物质化学组成和结构信息的科学,它所要解决的问题是物质中含有哪些组分,各个组分的含量多少,以及…
-
工商管理模拟实验实验报告范本
宁波广播电视大学工商管理专业(本科)模拟实验实验报告学院:北仑电大系:专业:工商管理年级:姓名:学号:成绩:实验的目的和要求工商管…