双报告基因测试技术
双荧光素酶报告基因测试∶ 结合萤火虫和海洋腔肠荧光素酶先进的共报告基因测试技术
在用萤火虫荧光素酶定量基因表达时 ,通常采用第二个报告基因来减少实验的变化因素。但传统的共报告基因(比如CAT,β-Gal,GUS)不够便利,因为各自的测试化学,处理要求,检测特点存在差异。Promega提供一种先进的双报告基因技术,结合了萤火虫荧光素酶测试和海洋腔肠荧光素酶测试。双荧光素酶报告基因测试系统,结合pRL载体系统,表达第二个报告基因海洋腔肠荧光素酶,在单管中进行双荧光素酶报告基因测试,快速,灵敏,简便。系统还提供PLB裂解液,用来裂解在多孔板中培养的哺乳细胞,不需操作单个样品。对于正在使用萤火虫荧光素酶报告基因载体的研究人员。双荧光素酶报告基因测试系统将使他们立即体会到该系统的便利。
介 绍
双报告基因用于实验系统中作相关的或成比例的检测, 通常一个报告基因作为内对照, 使另一个报告基因的检测均一化。检测基因表达时双报告基因通常用来瞬时转染培养细胞,带有实验报告基因的载体共转染带有不同的报告基因作为对照的第二个载体。通常实验报告基因偶联到调控的启动子, 研究调控基因的结构和生理基础。报告基因表达活力的相对改变与偶联调控启动子转录活力的改变相关,偶
联到组成型启动子的第二个报告基因,提供转录活力的内对照, 使测试不被实验条件变化所干扰。
通过这种方法, 可减少内在的变化因素所削弱的实验准确性, 比如, 培养细胞的数目和活力的差别, 细胞转染和裂解的效率。 使用萤火虫荧光素酶,结合氯霉素乙酰转移酶(CAT), β-半乳糖苷酶(β-Gal), 或葡萄醛酸糖苷酶(GUS)的双报告基因,近几年已普遍使用。但这些双报告基因组合削弱了荧光 素酶操作的优势 , 比如荧光素酶测试和定量可在几秒钟内进行, 但CAT, β-Gal和GUS测试法, 则在定量前需要长时间的保温。另外,这些报告基因受限于它们的灵敏度和线性应答范围, 必须注意不要超过这些范围, 内源性细胞活力也会干扰这类报告基因的使用。许多类型的细胞有内源β-Gal或GUS表达, 不利于准确定量报告基因表达, 胞内去乙酰酶活力干扰CAT活力测试。尽管在高温下预处理细胞裂解液(1,2), 会降低内源性β-Gal和CAT测试的干扰,但这些处理也会快速失活荧光素酶。因此,在此类双报告基因检测中, 必须以不同的步骤分别处理共转染的细胞裂解液。
理想的双报告基因方法应该使用户能够以萤火虫荧光素酶所具有的速度,灵敏和线性范围对同一样品中的两个报告基因同时测定。这在传统的报告基因, 如CAT, β-Gal和GUS是不可能的, 由于它们测试化学,处理要求所固 有的局限。相反 , 结合萤火虫 ( Photinus pyralis ) 和海洋腔肠 ( Renilla reniformis ) 双荧光素酶,
Promega 的双荧光素酶报告基因测试 (DLR) 系统可满足这些要求,在单管中完成这些测试。
双荧光素酶报告基因测试化学
荧火虫和海洋腔肠荧光素酶都具有生物发光报告基因的卓越的测试特点 , 但它们在进化上的起源不同 , 因此 , 具有不同的酶学结构和底物要求。这些差别用来发展了 DLR 测试化学 , 选择性地区别这两种发光报告基因的活力。萤火虫荧光素酶是一个 61kDa 单亚基蛋白质 , 酶活力不需翻译后修饰 (3,4), 在翻译后即可作为遗传报告基因。在 ATP,Mg 2+ 和 O 2 存在下,通过甲虫荧光素的氧化反应发光 ( 图 1) 。在常规反应条件下 , 荧光素的氧化发生时 , 以荧光素 -AMP 作为中间体 , 转换非常缓慢。结果 , 在底物和酶混合后 , 测试化学产生"闪烁"的光 , 并迅速衰减。专利化的测试试剂 , 定量萤火虫荧光素酶活力 , 掺入了辅酶 A(CoA), 增强快速酶转换来提高反应动力学 (5), 导致持续的"闪烁"发光信号 ( 图 2) 。
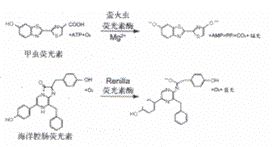
图 1由萤火虫和Renilla荧光素酶催化的生物发光
海洋腔肠荧光素酶,一个 36 kDa单亚基蛋白质,纯化自天然来源的 Renilla reniformis (6),含有3%的碳水化合物,但是和萤火虫荧光素酶一样,酶活力不需翻译后修饰,在翻译后即可作为遗传报告基因。海洋腔肠荧光素酶所催化的发光反应,利用O 2 和海样腔肠荧光素(coelenterazine) (图1)。当用DLR测试化学作实验时,海洋腔肠荧光素酶反应的动力学产生闪烁型发光信号,在检测过程中缓慢地衰减(图2)。
在 DLR测试系统中,用单个裂解液分步测定萤火虫和海洋腔肠荧光素酶活力。在完成萤火虫荧光素酶活力("实验"报告基因)的测定后,萤火虫发光被快速湮灭,并同时激活海洋腔肠荧光素酶的发光反应("对照" 报告基因)。因此,DLR测试系统整合了两个测试化学,对共表达的两个报告基因作快速地定量,酶来自转染细胞裂解液,或无细胞转录/翻译反应。
萤火虫荧光素酶测试的线性范围延伸达酶浓度的8个数量级,可测定≤1fg (大约10 -20 摩尔)的实验报告基因酶(图3A)。用双荧光素酶报告基因测试系统, 海洋腔肠荧光素酶的线性范围达酶浓度的7个数量级,较低的底限是≤ 10fg (大约3×10 -19 摩尔)的对照报告基因酶(图3B),并且这两个酶的特异活力相似。

图 2 用双荧光素酶报告基因测试由萤火虫和Renilla荧光素酶产生的发光。CHO细胞(1×10 6 /60mm培养板)共转染pGL3
Control和pRL SV40载体DNA。细胞用PBS洗涤后,加入400μl PLB制成裂解液。将20μl小量细胞裂解液和100μl荧光素酶测试试剂II(LARII)混合,萤火虫荧光素酶的活力立即用荧光照度仪检测(细线示踪)。100μl Stop &Glo TM 试剂加入到荧光照度仪管中,湮灭萤火虫荧光素酶反应,同时激活Renilla荧光素酶反应,并立即检测Renilla荧光素酶的活力(粗线示踪)。Turner Designs 型号20/20荧光照度仪配有计算机用来示踪荧光发射,12秒内完成两次测试。 双荧光素酶报告基因测试系统的方式
定量两个报告基因荧光素酶的发光信号,可在制备裂解液后立刻进行, 不需将样品分成小组分或作额外的处理。因海洋腔肠和萤火虫荧光素酶均呈现闪烁型反应动力学,作双荧光素酶报告基因测试不需要有试剂注射器的荧光照度仪。
通常DLR测试,大约需要30秒钟完成,如图4所说明。起始萤火虫荧光素酶报告基因测试时,将一份裂解产物和荧光素酶测试试剂II (LAR II)混合。在完成萤火虫荧光素酶测试时,此时萤火虫发光被湮灭,同时激活海洋腔肠荧光素酶的发光,加入Stop & Glo TM 试剂到样品管。在1秒钟内,Stop & Glo TM 试剂湮灭大于10 5 滴度萤火虫反应的发光信号(图5),并同时激活海洋腔肠荧光素酶。
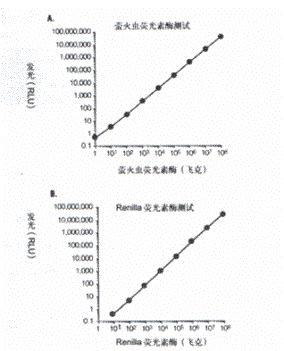
图 3 萤火虫荧光素酶和Renilla荧光素酶发光反应的线性范围。纯化的萤火虫和Renilla荧光素酶连续地用含1mg/ml BSA的1×PLB稀释,配有计算机的Turner Designs荧光照度仪用来检测10秒钟的总荧光,在最初2秒的预读延迟后。直接检测高浓度的两种荧光素酶的发光反应时,在荧光照度仪的样品室中加入中性密度滤光片。在含10fg和100fg的Renilla荧光素酶反应中测试发光,需减去来自海
洋腔肠荧光素自发光的背景信号。两种荧光素酶的发光活力对各自的测试变化浓度作图。
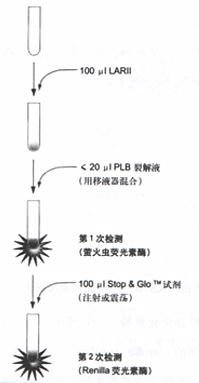
图 4 用手工荧光照度仪或配有试剂加样器的荧光照度仪的双荧光素酶测试方式。如荧光照度仪配有两个加样器,将裂解液预先分装到荧光照度仪的管子中,随后按序自动加入Luciferase Assay Reagent II (LAR II) , Stop & GloTM 试剂。
PLB裂解液
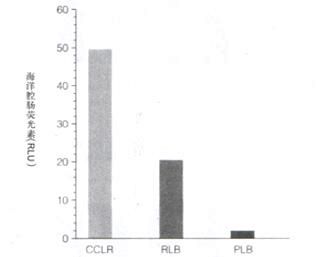
PLB裂解液 (Passive Lysis Buffer),经特别设计可有效裂解培养的哺乳细胞,而不必刮下贴壁细胞或作冻融循环。尽管PLB设计应用于被动裂解过程中,但它可靠的裂解效果同样有益于使用常规处理方法制作的裂解液。无论使用何种裂解方法,对培养的哺乳细胞而言,
释放到PLB裂解液中的萤火虫和海洋腔肠荧光素酶报告基因酶是定量和可靠的 (图6)。被动裂解液的一个明显优点,是可以抑制低水平的非酶促发光 (自发光),这是海洋腔肠荧光素在水溶液中的固有特点。通常用来制备细胞裂解液的试剂可增强海洋腔肠荧光素自发光,包括Triton? X-100, Promega的细胞培养裂解试?(CCLR) 和报告基因裂解试剂(RLB),这些试剂还会显著抑制海洋腔肠荧光素酶的发光反应。PLB经特别设计用来最大地增强荧光素酶活力,使自发光减弱到最低,可提供最优的测试灵敏度,定量很低水平的海洋腔肠荧光素酶。另外,PLB抑制发泡,非常适合高通量应用,可用于自动化系统中将培养在多孔板中的细胞组制备成裂解液并测试。
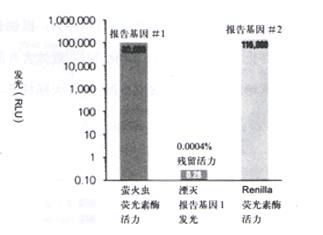
图 5双荧光素酶报告基因测试系统湮灭萤火虫荧光素酶发光和激活Renilla荧光素酶发光。CHO细胞裂解液有共转染pGL3 -Control和pRL SV40载体DNA,按图2描述的方法制备。萤火虫荧光素酶(报告基因1) 和Renilla荧光素酶 (报告基因2) 活力检测在10秒内完成,最初有2秒的预读延迟。为了显示Stop & Glo TM 试剂湮灭报
告基因1的高效率,加入等体积的Stop & Glo TM 试剂 (缺少海洋腔肠荧光素无法激活Renilla荧光素酶反应),萤火虫荧光素酶发光被湮灭而又不激活Renilla荧光素酶发光。在这一实验中,湮灭萤火虫荧光素酶反应的残留发光,小于未湮灭反应值的
0.0004%
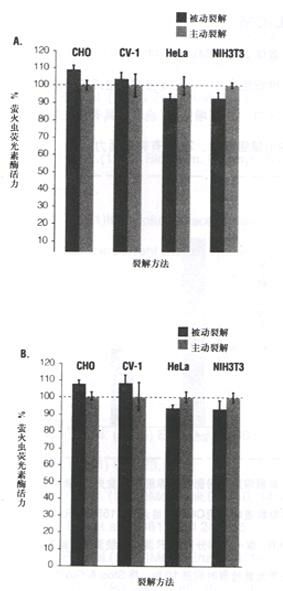
图 6 用PLB裂解哺乳细胞的高效率和被动或主动裂解方法。用
pGL3-Control 和pRL-SV40载体DNA共转染图示的培养哺乳细胞,制备裂解液时,向贴壁细胞加入PLB,温和摇动培养液达15分钟 (被
动细胞裂解),或从培养板中刮下贴壁细胞,在-80℃进行 1次冻/融循环(主动细胞裂解)。萤火虫和Renilla荧光素酶活力用DLR方法确定,如图4所示。为了便于比较,报告基因活力用主动裂解方法对每种细胞进行归一化。图A:萤火虫荧光素酶报告基因活力。图B:Renilla荧光素酶报告基因活力。
海洋腔肠荧光素酶对照载体 pRL系列
设计的 pRL载体系列可在哺乳动物细胞中,组成型 地 表达海洋腔肠荧光素酶。这些载体含有克隆自 Renilla reniformis (7)海洋腔肠荧光素酶的cDNA (R luc ),在R luc 基因中导入了3个碱基替换, 消除了内 Bgl II, Bam H I和 Nar I 酶切位点,这些突变不造成海洋腔肠荧光素酶表达的氨基酸序列的改变。提供的pRL载体有几种启动子构型,可同萤火虫荧光素酶载体组合, 作为报告基因活力的内对照。
pRL-TK
载体 pRL-TK (图9),在Rluc上游含有单纯疱疹病毒胸腺嘧啶激酶 (HSV-TK) 的启动子区域。HSV-TK启动子在胚胎和成熟的哺乳组织细胞中,可低水平和组成型地表达(8, 9)。
pRL-SV40
载体pRL- SV40含SV40早期增强子/启动子区域,在多种细胞中,
可高强度、组成型表达Rluc。载体pRL- 40还含有SV40的复制起始区,在诸如COS-1或COS-7细胞中(10),可瞬时、附加体式地复制,表达SV40大抗原。
pRL-CMV
载体pRL-CMV含CMV早早期增强子/启动子区域, 在多种细胞类型中,可高强度、组成型表达Rluc。在转基因小鼠中,CMV增强子/启动子具有泛主特点,在检测的 28种小鼠组织中, 24种有转录活力。
pRL-Null
载体 pRL-null无真核启动子和增强子序列,在Rluc上游有一些单一酶切位点,可提供最大灵活性来克隆所需的启动子序列,启动海洋腔肠荧光素酶的表达。
图9所显示的pRL-TK载体代表了pRL载体所共有的特点,在每个pRL载体的指定启动子的紧下游是一个嵌合的内含子,可提供海洋
腔肠荧光素酶的增强表达。内含子由人β-珠蛋白质内含子1的5′-供体剪切位点和免疫球蛋白基因重链可变区域的分枝点和3′-受体剪切位点组成(12)。供体和受体剪切位点、分枝点的序列均作了改变以匹配最适剪切位点的共有序列(3)。在Rluc的紧上游是T7 启动子序列,可在体外合成海洋腔肠荧光素酶的转录物。Rluc的下游是SV40晚期poly (A)序列, 提供有效的转录终止和mRNA多腺苷酸化(14)。载体含有原核的复制起始区和β-内酰胺酶基因,可在大肠杆菌中选择质粒的扩增。

图 8 用Passive Lysis Buffer 制备细胞裂解物中萤火虫和Renilla荧光素酶的稳定性。用pGL3-Control 和pRL-SV40载体DNA共转染培养在标准6孔板中的CHO细胞 (2.5 ×10 5 细胞/孔) 。培养30小时后,将培养液吸干,每孔中的附着细胞用PBS洗涤一次。制备裂解液时加入500μl Passive Lysis Buffer到每一个培养板中,在室温温和地震荡15分钟。立即测试小组份的每一种裂解物中萤火虫和
Renilla荧光素酶活力,然后分装,保存在 22℃(室温)、4℃,或-20℃。保存的样品在指示的时间间隔内重新测试。测试按图5所描述的方法进行,每一个方框代表3个重复的细胞裂解物,作2次重复测试的均值。
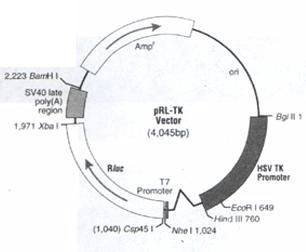
图 9 pRL-TK载体的环形图。附加描述:内含子的位置,Rluc ,编码Renilla荧光素酶的cDNA,Ampr, 在E.coli中编码氨苄抗性,ori, 在E.coli中质粒复制起始区。Rluc和Amp r基因中的箭头表示转录的方向。
小 结
在双遗传报告基因的应用中,一个报告基因活力的改变,与基因表达的特定实验条件相关,而第二个报告基因的组成性活力提供了内对照,使实验值可以规一化。 Promega的新的双报告基因测试系统,在单管中测试两个荧光素酶报告基因,此两个荧光素酶报告基因具有兼容的化学特性、操作条件、速度、灵敏度、线性范围、和仪器需要。
荧火虫和海洋腔肠荧光素酶测试的组合,匹配pRL载体,提供了双遗传报告基因应用的理想测试系统。使用标准的手工荧光照度仪可在30秒内完成测试。特别设计的新的被动裂解液,可快速、高效地将培养在多孔板中的细胞裂解,并使萤火虫和海洋腔肠荧光素酶具有最适测试灵敏度和稳定性。双报告基因测试系统在体内报告基因应用的优势,也同样体现在无细胞系统的应用,比如体外转录/翻译反应。 参考文献
1. Ginot, F. et al. (1989) Eur. J. Biochem . 180, 289.
2. Young, D. C. et al .(1993) Anal. Biochem . 215, 24.
3. de Wet, J. R. et al .(1985) Proc. Natl. Acad. Sci. USA 82, 7870.
4. Wood, K. V.et al .(1984) Biochem. Biophys. Res. Comm . 124, 592.
5. Wood, K. V (1991)In : Bioluminescence and
chemiluminecence:Current Status, eds. P. Stanley and L. Kricka,
John Wiley and Sons, Chichester, 11.
6. Matthews, J.C. et al. (1997) Biochemistry 16,85.
7. Lorenz, W. W et al .(1991) Proc. Natl. Acad. Sci. USA 88, 4438.
8. Stewart C. L. et al . (1987) EMBO J. 6, 383.
9. Wagner, E. F. et al. (1985) EMBO J. 4, 663.
10. Gluzman, Y. (1981) Cell 23, 175.
11. Schmidt, E.V.et al. (1990) Mol. Cell.Biol. 10, 4406.
12. Bothwell, A. L.M.et al. (1981) Cell 24, 625.
13. Senapathy, P. et al.(1990) Meth. Enzymol . 183, 252.
14. Carswell, S et al. (1989) Mol. Cell . Biol.9, 4148.
第二篇:测试技术报告考核标准
《材料工程测试技术》课程专题报告考核和评分办法
《材料工程测试技术》课程考核和评分办法采用书面专题报告审阅和抽查口头答辩相结合的形式来进行。具体评分标准如下:
1. 报告题目选择的意义: 20分
A.无意义: <10分
B.意义一般: 15分
C.有意义: 20分
2. 报告的形式: 20分
A.课程专题报告的形式: 10分
a. 安要求切完整: 10分
b. 不完整: 5分
B. 文字图表的表达: 10分
文字语言组织流畅,图表清晰: 10分
文字语言不连贯,图表不清晰: 5分
3. 内容考核: 60分
A. 独立完成程度: 20分
同一题目设计分析方法不同者不扣分,否者视雷同程度扣分
B. 内容按大纲要求的完整性: 20分
视内容情况给分
C. 内容的创新性: 20分
创新性包括:选题的新颖性;设计特色;分析问题的独到之处等。 视内容情况给分
最终成绩按以上分数折算成优、良、中、及格和不及各。
-
专业技术工作报告范文
专业技术工作报告范文:本人19xx年x月毕业于福州市市政建设学校工民建专业,中专学历,学制四年。毕业后分配到福州市公路局工作。xx…
-
专业技术工作报告范文
专业技术工作报告XXX科技有限公司本人20xx年毕业于XXX大学XXX专业,随后一直从事XXX产品的设计和开发工作。从事本专业工作…
-
技术研究报告(格式)
海信空调研发中心技术研究报告项目编号课题名称课题组长完成时间仅限内部使用严禁外传第1页共6页海信空调研发中心1课题概述背景目的等说…
-
产品技术报告(格式1)
产品技术报告单位名称:产品名称:日期:(公章)目录一、涉及项目的提出...............................…
-
技术人员20xx年个人述职报告范文
技术人员20xx年个人述职报告范文二年多来,在上级组织和大家的共同支持帮助下,本人为有线电视网络的管理和发展作出了一点微薄的努力。…
-
学生会秘书处工作总结
20xx-20xx上学期秘书处工作总结时光荏苒,光阴似箭。一学期的时光转眼即逝。在感慨流年飞逝的同时,学生会工作翻过了又一篇章。伴…
-
20xx年秋季学期三年级数学教学工作总结2
小学三年级数学上册教学工作总结时光如梭,匆匆忙忙一学期由结束了。这个学期里我自始至终以认真严谨的治学态度,勤勤恳恳、兢兢业业地从事…
-
工作总结
一、善于学习大学给了我们一些基本的理论知识,但是与实践却又有很大的一段距离。我本不是学习电力专业的,因此从事电力行业后,一切对于我…
-
秘书处工作总结
不知不觉在秘书处从当初的小干事到现在和我的搭档一起管理秘书处这个大家庭已经半年了,在此期间,我们都在学习中成长。从刚开学的时候,我…
-
工程施工技术总结 Word 文档
装饰工程施工技术总结编制单位:建筑装饰有限公司编制日期:二0一二年十月三十一日装饰工程施工技术总结今天我代表装饰有限责任公司向参加…