实验十六 己二酸的制备
实验十六 己二酸的制备
一、实验目的
1、学习环己醇氧化制备己二酸的原理和方法;
2、掌握重结晶、搅拌等基本操作。
二、实验原理
己二酸是合成尼龙-66的主要原料之一,可以用硝酸氧化环己醇制得。
反应方程式如下:
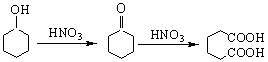
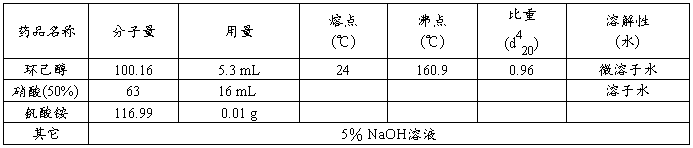
三、实验药品及其物理常数
四、主要仪器和材料
水浴锅 三口烧瓶(100 mL、19#×3) 恒压滴液漏斗 空心塞(14#) 球形冷凝管(19#) 螺帽接头(19#,2只) 温度计(100℃) 布氏漏斗 吸滤瓶 烧杯 冰 滤纸 水泵等.
五、实验装置
滴加、回流、尾气吸收装置
六、操作步骤
【操作要点及注意事项】
⑴搭装置:仪器的选用,搭配顺序,各仪器高度位置的控制要合理。
⑵检验气密性:实验产生的二氧化氮气体有毒,所以装置要求严密不漏气。注意尾气吸收装置中三角漏斗的高度。
⑶加料:环己醇和硝酸切不可用同一量筒量取。钒酸铵不可多加,否则产品发黄。
⑷滴加:本实验为强烈放热反应,所以滴加环己醇的速度不宜过快,以免反应过剧,引起爆炸。一般可在环己醇中加1mL水,一是减少环己醇因粘稠带来的损失,二是避免反应过剧。
⑸加热:可选择水浴加热,滴加完后继续用80-90 ℃水浴加热约15 min, 同时要摇动反应瓶,至几乎无棕色二氧化氮气体放出为止。
七、实验结果
1、产品性状: ; 2、理论产量: ;
3、实际产量: ; 4、产率: .
八、实验讨论
1、在该反应中为何要检查装置气密性?
2、为什么反应必须严格控制环己醇的滴加速度?
3、为什么有些实验在加入最后一个反应物前应预先加热?
九、实验体会
谈谈实验的成败、得失。
第二篇:实验六、己二酸的制备
实验六 己二酸的制备(4学时)
一.实验目的
1、学习环己醇氧化制备己二酸的原理和方法。
2、巩固浓缩、过滤、重结晶等操作技能。
二、实验原理
己二酸是合成尼龙-66的主要原料之一,它可以用硝酸或高锰酸钾氧化环己醇制得。其中用硝酸为氧化剂反应非常剧烈,伴有大量二氧化氮毒气放出,既危险又污染环境。因而本实验采用环己醇在高锰酸钾的酸性条件发生氧化反应,然后酸化得到已二酸。 3OH +8KMnO4+H23HO2CH42H+8MnO+8KOH
三、试剂
2g(2.1ml, 0.02mol)环己醇、6g (0.038mol) 高锰酸钾、10%氢氧化钠、亚硫酸氢钠、浓盐酸、 石蕊试纸
四、步骤
在250ml烧杯中安装电磁搅拌。烧杯中加入5ml 10%氢氧化钠溶液和50ml 水,搅拌下加入6g高锰酸钾。待高锰酸钾溶解后,用滴管慢慢加入2.1ml环己醇,控制滴加速度,维持反应温度在450C左右。滴加完毕反应温度开始下降时,在沸水浴中将混合物加热5min,使氧化反应完全并使二氧化锰沉淀凝结。用玻棒蘸一滴反应混合物点到滤纸上做点滴试验。 趁热抽滤混合物,滤渣二氧化锰用少量热水洗涤3次。合并滤液和洗涤液,用4ml浓盐酸酸化,使溶液呈强酸性(如何检验?)。在石棉网上加热浓缩使溶液体积减少至约10ml左右,加少量活性炭脱色后放置结晶,得白色己二酸晶体,
纯己二酸为白色棱状结晶,m.p. 152℃,d4241.366,b.p. 330.5℃(分解)。
五、思考题
1、本实验中为什么必须控制反应温度和环己醇的滴加速度?
2、为什么有些实验在加入最后一个反应物前应先预热?为什么一些反应剧烈的实验,开始时的加料速度放得较慢,等反应开始反而可以适当加快加料速度?
3、粗产物为什么必须干燥后称重?并最好进行熔点测定?
1
-
己二酸的制备实验报告
实验八己二酸的制备一实验目的1学习环己醇氧化制备己二酸的原理和方法2掌握浓缩过滤及重结晶等操作技能二实验原理三实验药品及其物理常数…
-
己二酸的制备实验报告1
实验八己二酸的制备一实验目的1学习环己醇氧化制备己二酸的原理和方法2掌握浓缩过滤及重结晶等操作技能二实验原理叔醇一般不易被氧化仲醇…
-
己二酸的制备实验报告
己二酸的制备一实验目的1学习环己醇氧化制备己二酸的原理和方法2掌握浓缩过滤及重结晶等操作技能二实验原理三实验药品及其物理常数环己醇…
-
己二酸的制备实验报告
实验八己二酸的制备一实验目的1学习环己醇氧化制备己二酸的原理和方法2掌握浓缩过滤及重结晶等操作技能二实验原理三实验药品及其物理常数…
-
实验十八己二酸的制备
实验十八己二酸的制备一实验目的1学习环己醇氧化制备己二酸的原理和方法2掌握重结晶搅拌等基本操作二实验原理己二酸是合成尼龙66的主要…
-
己二酸的制备实验报告
己二酸的制备一实验目的1学习环己醇氧化制备己二酸的原理和方法2掌握浓缩过滤及重结晶等操作技能二实验原理三实验药品及其物理常数环己醇…
-
己二酸的制备实验报告
实验八己二酸的制备一实验目的1学习环己醇氧化制备己二酸的原理和方法2掌握浓缩过滤及重结晶等操作技能二实验原理三实验药品及其物理常数…
-
己二酸的制备实验报告
实验八己二酸的制备一实验目的1学习环己醇氧化制备己二酸的原理和方法2掌握浓缩过滤及重结晶等操作技能二实验原理三实验药品及其物理常数…
-
己二酸的制备实验报告1
实验八己二酸的制备一实验目的1学习环己醇氧化制备己二酸的原理和方法2掌握浓缩过滤及重结晶等操作技能二实验原理叔醇一般不易被氧化仲醇…
-
实验十八己二酸的制备
实验十八己二酸的制备一实验目的1学习环己醇氧化制备己二酸的原理和方法2掌握重结晶搅拌等基本操作二实验原理己二酸是合成尼龙66的主要…