己二酸的制备
己二酸的制备
一、实验目的
1.掌握用环己醇氧化制备己二酸的基本原理和方法。
2.掌握电动搅拌器的安装及使用方法
3.巩固浓缩、过滤、重结晶等基本操作。
二、实验原理
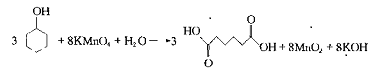
制备羧酸最常用的方法是烯、醇、醛等的氧化法。常用的氧化剂有硝酸、重铬酸钾(钠)的硫酸溶液、高锰酸钾、过氧化氢及过氧乙酸等。本实验采用环己醇在高锰酸钾的酸性条件发生氧化反应,然后酸化得到已二酸。
三、实验仪器及药品
仪器:三口烧瓶(250ml)烧杯(1000ml)、温度计(0-150℃)、电动搅拌器、球形冷凝管、抽滤瓶、布氏漏斗、循环水多用真空泵、滴管、滤纸等。
药品:环己醇、高锰酸钾、NaOH;亚硫酸氢钠、浓盐酸、活性炭等。
四、实验步骤
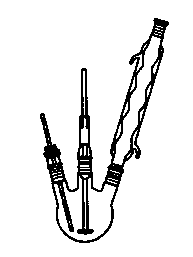
1. 在250mL三口烧瓶上安装电动搅拌器。
在安装电动搅拌装置时应做到:
①.搅拌器的轴与搅拌棒在同一直线上。
②.先用手试验搅拌棒转动是否灵活,再以低转速开动搅拌器,试验运转情况。
③.搅拌棒下端位于液面以下,以离烧杯底部3~5mm为宜。
④.温度计应与搅拌棒平行且伸入液面以下。
2. 往三口烧瓶中加入1.0gNaOH和50mL水。搅拌下加入6.0g高锰酸钾。搅拌加热至35℃使之溶解,然后停止加热;
3. 用滴管慢慢加入3mL的环己醇,控制滴加速度,维持温度在45℃左右。
4. 滴加完毕后若温度下降至43℃以下。,可在50℃的水浴中继续加热,直到高锰酸钾溶液颜色褪去。在沸水浴中将混合物加热5分钟,使氧化反应完全,可观察到有大量二氧化锰的沉淀凝结。
5. 用玻璃棒蘸一滴反应物到滤纸上做点滴实验。如有高锰酸盐存在,则在棕色二氧化锰点的周围出现紫色的环,可加入少量固体亚硫酸氢钠直到点滴试验呈阴性为止。
6. 趁热抽滤混合物,用少量热水洗涤滤渣3次。
7. 将洗涤液与滤液合并置于烧杯中,加少量活性炭脱色,趁热抽滤。
8. 将滤液转移至干净烧杯中,并在石棉网上加热浓缩至8ml左右,放置,冷却,冷却后再用浓盐酸酸化至pH值为2~4止。结晶,抽滤,干燥。
9. 称量计算产率。
五、实验装置图

六、实验操作要点
1.KMnO4要研细,以利于KMnO4充分反应。
2.环己醇要逐滴加入。滴加速度不可太快。否则,因反应强烈放热,使温度急剧升高而难以控制。
3.严格控制反应温度,稳定在43~49℃之间。
4.反应终点的判断:
(1)反应温度降至43℃以下。
(2)用玻璃棒蘸一滴混合物点在平铺的滤纸上,若无紫色存在表明已没有KMnO4。
5.用热水洗涤MnO2滤饼时,每次加水量约5~10 ml,不可太多。
6.用浓盐酸酸化时,要慢慢滴加,酸化至pH=2~4。
7.浓缩蒸发时,加热不要过猛,以防液体外溅。浓缩至10 ml左右后停止加热,让其自然冷却、结晶。
七、注意事项
[1]此反应属强烈放热反应,要控制好滴加速度和搅拌速度,以免反应过剧,引起飞溅或爆炸。同时,不要在烧杯上口观察反应情况。
[2]反应温度不可过高,否则反应就难于控制,易引起混合物冲出反应器。
[3]二氧化锰胶体受热后产生胶凝作用而沉淀下来,便于过滤分离。
八、实验数据分析
九、思考题
1.制备已二酸时,为什么必须严格控制滴加环已醇的速度和反应的温度?
2.物料较少,为何用250mL三颈瓶?
3. 为什么本实验在加入环己醇之前应预先加热反应液?
4. 反应完后如果反应混合物呈淡紫红色,为什么要加入亚硫酸氢钠?写出其反应方程式。
5. 本实验得到的溶液为什么要用盐酸酸化?除用盐酸酸化外,是否还可用其他酸酸化?为什么?
第二篇:聚己二酸乙二酯的制备
实验07 聚己二酸乙二酯的制备
一.二.三.四.五.
一.实验目的
1.
2.本实验将通过改变己二酸乙二酯制备的反应条件,了解其对反应程度的影响;分析副产物的析出情况,进一步了解聚酯
类型的缩聚反应的特点。
二.实验原理
线性缩聚反应的特点是单体的双官能团间相互反应,同时析出副产物,在反应初期,由于参加反应的官能团数目较多,反应速度较快,转化率较高,单体间相互形成二聚体、三聚体、最终生成高聚物。
aAa+ bBb→aABb+ ab
aABb+ aAa→aABAa+ ab或
aABb+bBb→bBABb+ ab
a(AB)mb+ a(AB)nb→a(AB)m+nb+ ab
二.实验原理
整个线性缩聚是可逆平衡反应,缩聚物
的分子量必然受到平衡常数的影响。当反应条件改变时,例如副产物ab从反应体系中蒸除出去,平衡即被破坏。除了单体结构和端基活性的影响外,影响聚酯反应的主要因素有:配料比,反应温度,催化剂,反应程度、反应时间、去除水的程度等。
二.实验原理
配料比对反应程度和聚酯的分子量大小的影响很大,体系中任何一种单体过量,都会降低聚合程度;采用催化剂可大大加快反应速度;提高反应温度一般也能加快反应速度,提高反应程度,同时促使反应生成的低分子产物尽快离开反应体系,但反应温度的选择是与单体的沸点、热稳定性有关。反应中低分子副产物将使逆反应进行,阻碍高分子产物的形成,因此去除副产物越彻底,反应进行的程度越大。
为了去除水分,本实验可采取提高反应温度,降低系统压力,提高搅拌速度和通入惰性气体等方法。此外,在反应没有达到平衡,链两端未被封锁的情况下,反应时间的增加也可提高反应程度和分子量。
二.实验原理
在配料比严格控制在1:1时,产物的平均聚合度Xn与反应程度(P)具有如下关系:Xn=1/(1-P),假如要求Xn= 100,则需使P=99%,因此,要获得较高分子量的产品,必须提高反应程度,反应程度可通过析出的副产物的量计算:P=n/n0,其中n为收集到的副产物的量,n0为反应理论产生的副产物的量。
三.主要仪器和试剂1.
2.实验仪器装置如图7-1、图7-2,其中包括250ml三口瓶x1、搅拌器x1、分水器x1,温度计x1、球形冷凝管x1,100ml和250ml量筒各x1,培养皿。实验试剂
己二酸,乙二醇,对甲苯磺酸,十氢萘
三.主要仪器和试剂
1.图7-1 聚己二酸乙二醇酯制备装置图7-2 聚酯减压装置250ml三口烧瓶;2. 温度计;3. 搅拌器;4. 分水器;5. 球形





冷凝管
四.实验步骤
1.
2.
3.实验仪器装置如图7-1、图7-2所示:在三ml加,口瓶少量中对先后甲苯磺加入酸己二酸及15ml36.5 十氢萘克和乙二,分水醇器14 15min入15ml时,系每隔内升十氢萘15温分至。用电热锅加热,在搅拌下内钟记录160°C一并保持次析出(160水量±。2) ℃1.5小时升每隔温至15(200分钟记录±2) 一℃再保持次析出水量此温。度1.5然小后时,同将体将反应在装置改成减压系统(放出分水器中的
应(2000.5小±时,同时2) ℃,13.3KPa(100mmHg)记录在此条件下的析水量压力水
。反下,反
应状固停止体,,趁称重热倒。出聚合物,冷却后,得白色蜡
五.问题与讨论1.
2.
3.本实验起始条件的选择原则是什么?说明采取实验步骤和装置的原因。根据实验结果画出累积分水量与反应时间的关系图,并讨论反应特点,讨论分水量与反应程度、聚合度的关系。如何保证投料配比的等摩尔数?
-
己二酸的制备实验报告
实验八己二酸的制备一实验目的1学习环己醇氧化制备己二酸的原理和方法2掌握浓缩过滤及重结晶等操作技能二实验原理三实验药品及其物理常数…
-
己二酸的制备实验报告1
实验八己二酸的制备一实验目的1学习环己醇氧化制备己二酸的原理和方法2掌握浓缩过滤及重结晶等操作技能二实验原理叔醇一般不易被氧化仲醇…
-
己二酸的制备实验报告
己二酸的制备一实验目的1学习环己醇氧化制备己二酸的原理和方法2掌握浓缩过滤及重结晶等操作技能二实验原理三实验药品及其物理常数环己醇…
-
己二酸的制备实验报告
实验八己二酸的制备一实验目的1学习环己醇氧化制备己二酸的原理和方法2掌握浓缩过滤及重结晶等操作技能二实验原理三实验药品及其物理常数…
-
实验十八己二酸的制备
实验十八己二酸的制备一实验目的1学习环己醇氧化制备己二酸的原理和方法2掌握重结晶搅拌等基本操作二实验原理己二酸是合成尼龙66的主要…
-
20xx年风险合规部工作总结
XX村镇银行风险合规部20xx年工作总结20xx年,风险合规部在行领导的正确带领下,全面贯彻年初全行工作会议的讲话精神,自觉践行依…
-
治安队20xx年工作总结
今年上半年,我队按照森林公安局的整体部署,以党的十七大精神为指导,深入贯彻落实科学发展观,全面落实赤峰市林业局,全市森林公安队伍建…
-
美术教师工作总结
20xx-20xx学年第一学期工作总结日子过得真快,转眼间,一个学期就要过去了。在学校辛勤劳作的情况下,我顺利的完成了本学期的工作…
-
20xx年度社会治安综合工作总结
二○一○年度社会治安综合工作总结20xx年,我大队社会治安综合治理工作在省厅、省局(总队)、支队领导的正确领导下,在支队相关科室的…
-
银行保安20xx年个人工作总结
银行保安XX年个人工作总结我,转眼已在招行度过两个春秋。我虽是一名普通的保安员,但在我心中,支行就是我的家,领导是我的家长,行里的…