物理实验
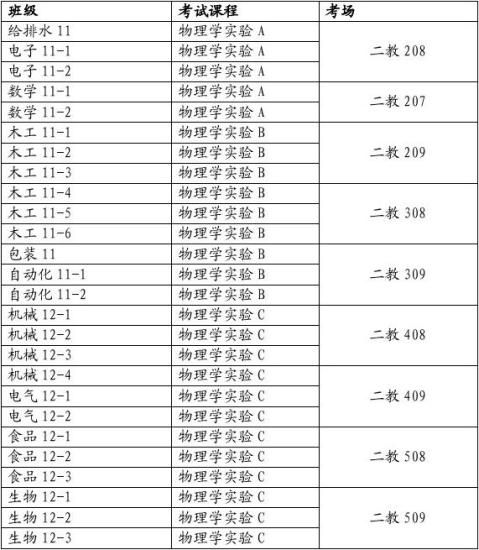
2012-2013学年第一学期物理学实验A、物理学实验B、物理学实验C考试安排
考试时间:1月4日晚6:30-7:00
第二篇:基因分子生物学实验报告第一次实验报告



基 因 分 子 生 物 学
实 验 报 告
实验名称: RNA的制备、鉴定及RT-PCR
实验类型: 验证型□ 综合型√ 设计型□
实验室名称: 分子细胞遗传实验室
指导教师:____________王欣______________________
班级: 周二 组别: 3
姓名: 姜仁涛
学号: S2011008044
成绩:
实验起始日期: 20##-2-28
一.仪器设备型号
SIGMA高速冷冻离心机2K15
SANYO制冰机SIM-T-124
高压消毒锅YX-280
Biometra PCR仪T-1
恒温水浴箱
通达涡旋振荡仪TDX-1
Tanno凝胶成像仪Gis-2010
一恒恒温干燥箱DHG-9070A
DYY-6C型电泳仪
Eppendorf生物分光光度计AG22331
二. 实验材料
HEK293细胞
Trizol试剂
氯仿
异丙醇
无Rnase水
75%乙醇(无水乙醇75ml,DEPC水或高压灭菌双蒸水25ml)
10*上样缓冲液(聚蔗糖2.5g或40%聚蔗糖:5ml,溴酚蓝25mg,二甲苯青25mg,0.5M EDTA 20ul,DEPC水10ml)
10mg/ml EB(EB 0.1g,DEPC水10ml)
琼脂糖
1*TAE
GAPDH上下游引物
TRANSTM第一链cDNA合成试剂盒(EasyScriptRT/RI Enzyme Mix,2*ES Reaction Mix,Random Primer,Anchored Oligo(dT)18 Primer,Rnase-free water)
三.实验方法
RNA提取
1)观察培养细胞,10cm平板内约80%密度,生长良好;吸尽培养液后,立即将Trizol直接加入培养板中裂解细胞,不断摇动。每10cm2面积加入1mlTrizol。用一次性针管,吹吸几次,转移到一EP管中,室温静置5分钟。
2)加0.2ml氯仿,剧烈震荡15秒,室温静置3分钟。12 000rpm 4℃离心15分钟。
3)将上层水相转移到另一EP管中,加入500ul异丙醇,混匀,室温静置20-30分钟;10 000rpm 4℃离心10分钟,弃上清。
4)加入1ml75%乙醇(DEPC处理的水配制),剧烈涡旋洗涤沉淀(将沉淀击碎),6000rpm 4℃离心5分钟,弃上清,室温晾干沉淀(大约5分钟左右)。
5)RNA的溶解:用100ul无Rnase水溶解沉淀。55-60℃孵育10分钟,分装样品,(30,30,40ul),其中一管30ul做RNA电泳。另两管待用。
6)取1ulRNA溶液,稀释至100ul。测RNA浓度、260nm/280nm、260nm/230nm。
RNA琼脂糖电泳
1)配胶:琼脂糖1g,1*TAE 100ml 微波加热融化,冷却至60℃,灌胶。
2)电泳,向水平电泳槽中加入1*TAE至恰好浸没凝胶1mm左右,每孔加入10~20ul样品,100V电泳15分钟,紫外灯下观察RNA分离情况,比较28S rRNA和18S rRNA的含量。
RT-PCR
1)反转录合成cDNA:
取一支0.2ml EP管加入

 Components Volume(ul)
Components Volume(ul)
Total RNA 2(50ng~5ug)
Random Primer(N9)(0.1ug/ul) 1
2*ES Reaction Mix 10
EasyScriptRT/RI Enzyme Mix 1
Rnase-free Water to 20

轻轻混匀
25℃孵育10分钟,42℃孵育50分钟
70℃加热15分钟失活EasyScriptRT。
2)RT-PCR
取1/10~1/5(2~4ul)的反转录产物作为PCR模板;
 条件(以25ul反应体系为例):
条件(以25ul反应体系为例):
 Components Volume (ul)
Components Volume (ul)
cDNA 2
Forword Primer(10pmol/L) 1
Reverse Primer(10pmol/L) 1
10*Buffer 2.5
2.5mMdNTPs 1
Taq(2U/ul) 0.5
ddH2O to final volume 25

PCR循环:
94℃变性 3分钟
94℃变性 40秒
55℃退火 40秒
72℃延伸 1分钟
共40个循环
72℃延伸 10分钟
DNA琼脂糖凝胶电泳
以Total RNA及ddH2O为对照,对新合成的DNA 进行电泳,100V 15~20分钟,Marker 5ul每孔,其它孔4ul样品加1ul Loading Buffer。
电泳之后,将凝胶浸入0.5ug/ml的EB水溶液中10分钟进行染色,在凝胶成像系统中观察,是否合成了DNA以及Total RNA 中是否有基因组DNA的污染。
四. 实验结果

图1. Total RNA 琼脂糖凝胶电泳图
1)RNA琼脂糖凝胶电泳结果见图1.
完整的RNA 电泳,其28S与18S的显色强度比约为2:1,在图1中,条带形状不规则,条带之间未明显分开,电泳结果不好,不能用于分析;但可见28S明显比18S处强。可能是在提取RNA过程中,未保证低温环境,以及操作环境中引入Rnase,导致RNA结构不完整。
2)Total RNA 分光光度计测定结果为:
浓度 4242. 9 ug/mL
260nm/280nm 1.77
260nm/230nm 1.72
260nm及280nm为核酸分子的吸收峰,230nm为酚类化合物(在Trizol中引入)的吸收峰。 260nm/280nm可反映RNA 的纯度,纯RNA 一般在2.0~2.2之间,260nm/230nm可反映酚类化合物等杂质的污染程度,一般大于2.0。本次试验提取的RNA不纯,且应含有酚类杂质,实验中可适当增加氯仿及异丙醇的提取次数。
3)

图2.DNA(RNA)凝胶电泳图
DNA 琼脂糖凝胶电泳结果见图2,从图中可见,ddH2O孔中没有DNA条带,阴性对照明显,DNA及Total RNA 孔中相同位置出现一明显条带,即所提取的RNA 经RT-PCR所得DNA的条带,Total RNA也存在这一条带,说明所提起的RNA中含有基因组DNA。这与260nm/280nm比值偏低存在一定关联。
五.实验结论
本次实验提取了RNA,紫外分光光度计测定结果显示RNA不纯(260nm/280nm=1.77<2.0,260nm/230nm =1.72<2.0),浓度为4242. 9 ug/mL;RNA琼脂糖凝胶电泳条带未良好分离,可能在操作过程中引入了RNase,导致了RNA不完整;DNA 凝胶电泳分析,显示提取的RNA 中有基因组DNA,与260nm/280nm=1.77<2.0相符合。
六.实验中出现的问题
RNA的提取及处理过程中应尽量在低温环境中进行,但实验中在转移及加取试剂及转移过程时常将RNA置于室温,这课能对RNA 的完整性产生影响,同时也会影响其纯度。
七.体会及思考
1)RNA的提取和鉴定应尽量保持洁净环境,同时在处理过程中有很多微小的操作错误都会引入Rnase及其他污染,对RNA的纯度、完整性等产生影响,因此实验操作要严格规范。
2)凝胶电泳要跑出好的条带,与适当的实验条件以及所需电泳的物质的性质密切相关,比如本次实验中RNA的纯度及完整性都会影响最终的条带,影响定性和定量。
3)实验中要养成良好的操作习惯,保护好个人安全。本次实验中用到EB,为毒性物质,因此要小心操作,戴手套,但接触仪器时应摘除,方便自己和他人。同时,诸如移液枪的正确使用等也应注意。
-
初中物理实验报告范文
“浮力消失”了做下面的小试验器材找一个底面很平的容器,让一个蜡烛头紧贴在容器底部,再往容器里倒水,蜡烛头并不会浮起来;轻轻地把蜡烛…
-
物理实验报告格式
桂林理工大学实验报告四、实验内容班级学号姓名同组实验者简要的实验步骤、测量的物理量名称、数据表实验名称日期一、实验目的1、2、3、…
- 大学物理实验报告范本
-
大学物理实验报告模板.
学院物理系大学物理学生实验报告实验项目实验地点班级姓名座号实验时间月物理系编制实验预习部分一实验目的二实验仪器设备三实验原理2实验…
- 物理实验报告模板
-
实验4 传热实验
江苏大学实验报告系别食品科学与工程班级1002班姓名侯倩学号3100901034教师评定实验五传热试验一实验目的1了解换热器的结构…
-
相约东大主持人稿
男各位来自兄弟院校南航南理工南中医河海南工业的朋友们帅哥美女宅男宅女及其各位的拉拉队亲友团好事围观者们大家晚上好我是东大研会外联的…
-
主持词
男亲爱的的同学们女人爱人爱花见花开车见车载的学姐学长们合大家晚上好男欢迎大家参加本次的送部长晚会男我是主持人祖广晨女我是主持人孙蕊…
-
实验三 过滤实验
江苏大学实验报告系别食品科学与工程班级1002班姓名侯倩学号3100901034教师评定实验三过滤实验一实验目的1熟悉板框压滤机的…
-
yy主持生日词
男二十岁的天空闪着五彩斑斓的星星绚丽而又多彩女二十岁的天空蓝天衬托着白云白云衬托着梦想和点燃星星点燃天空点燃梦想一起在二十岁的天空…
-
李演珍精细化报告
安全生产精细化管理讲座中煤政研会秘书长李演珍尊敬的各位领导这是我第一次来咱们彬长公司来原计划集中讲几个问题所以要准备一个课件昨天到…