乙酸乙酯皂化反应速率常数的测定

物 理 化 学 实 验 报 告

实 验 名 称:乙酸乙酯皂化反应速率常数的测定
学 院: 化学工程学院
专 业: 化学工程与工艺
班 级: 化工09-1
姓 名:
学 号:
指 导 教 师: 胡敏杰 陈斌
日 期: 20##年5月26日
一、实验目的
1、了解用电导法测定乙酸乙酯皂化反应的速率系数和活化能。
2、了解二级反应的特点,学会用图解法求二级反应的速率系数。
3、掌握电导率仪的使用方法。
二、实验原理
1、二级反应的动力学方程
A + B→产物
t=0 a a
t=t a-x a-x
-dcA/dt = -d(a-x)/dt = dx/dt = k(a-x) 2
定积分得: k=x/[ta(a-x)] ①
以x/(a-x)~t作图若所得为直线,证明是二级反应,并从直线的斜率求k。
如果知道不同温度下的速率常数k(T1)和k(T2),按阿仑乌斯方程计算出该反应的活化能Ea
Ea=ln k(T1)/ k(T2)*R[T1 T2 / (T2 -T1 )] ②
2、乙酸乙酯皂化反应是二级反应,反应式:
CH3COOC2H5+NaOH→CH3COONa+C2H5OH
t=0 a a 0 0
t=t a-x a-x x x
t=∞ 0 0 a a
反应前后CH3COOC2H5和C2H5OH对电导率的影响不大,可忽略,故反应前只考虑NaOH的电大率κ,反应后只考虑CH3COONa的电导率κ。对稀溶液而言,强电解质的电导率κ与其浓度成正比,而且溶液的总电导率就等于组成该溶液的电解质电导率之和。
有一下关系:
κ0=A1*a κ∞=A2*a κt= A1*(a-x)+ A2*x
有三式得:x=[(κ0-κt)/(κ0-κ∞)]*a,将其代入①中
得 k=[(κ0-κt)/(κ0-κ∞)ta]
重新排列得: κt =(κ0-κt)/kta+κ∞
因此,以κt ~(κ0-κt)/t作图为一直线即为二级反应,并从直线的斜率求出κ。
三、实验仪器、试剂
仪器:数学电导率仪(附电极)1台,恒温水槽1套,秒表1只。叉形电导管2只,移液管(10ml,胖肚)3根
试剂:乙酸乙酯标准溶液(0.02120mol/dm3),NaOH标准溶液(0.02120mol/dm3)
四、实验步骤
1、调节恒温槽
调节恒温槽温度25℃。同时电导率仪提前打开预热。
2、κ0的测定:
分别取10ml蒸馏水和10ml NaOH标准溶液加到洁净。干燥的叉形管仲裁充分混匀,置于恒温槽中恒温5min。用数学电导率仪测定已恒温好的NaOH标准溶液的电导率κ0
3、κt的测定:叉形管10ml CH3COOC2H5标准溶液,侧支管中加10mlNaOH标准溶导率一次,记录电导率κt及时间t。
4、调节恒温槽温度35℃,重复上述步骤测定其κ0和κt,但在测定κt时是按反应进行4min,6 min,8min,10 min,12min,15 min,18min,21 min,24 min,27 min,30 min时测其电导率。
五、数据记录与处理
室温: 27.1 ℃ 大气压: 100.40 Kpa
初始浓度:C CH3COOC2H5= 0.0212 mol/dm3 C NaOH= 0.0212 mol/dm3
⑴ 25℃时,电导率随时间的变化μS·cm-1·min-1
电导率随时间的变化 (25℃,κ0= 2391.20 μS·cm-1)
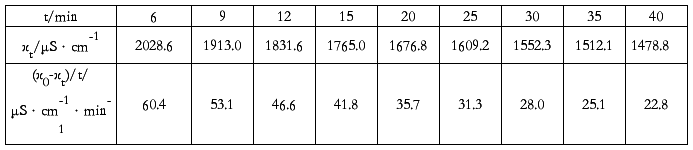
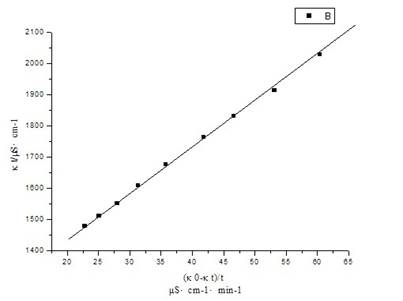
图1
由图1得:该直线斜率k=14.97
则κ(T1)=k/a=14.97/(0.0212/2)=1412.0 mol /( min·dm3)
⑵ 35℃时,电导率随时间的变化 电导率随时间的变化 (35℃,κ0= 2646 μS/cm)
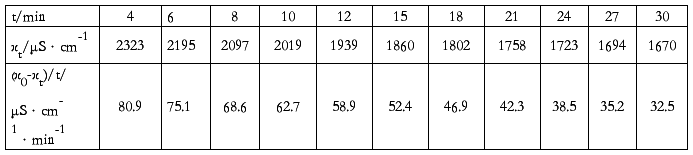
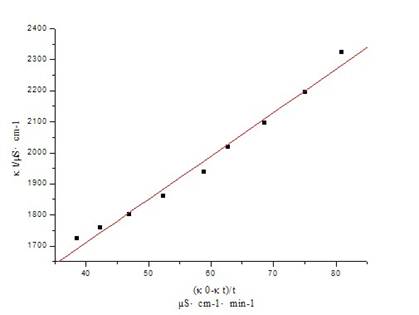
由图得:该直线斜率k=13.9,则κ(T2)=k/a=13.9/0.0212=655.66mol /( min·dm3)
(3)活化能的计算
Ea=ln k(T1)/ k(T2)·R[T1 T2 / (T2 -T1 )]
=ln(1412 /655.66)×8.314×[298.15×308.15 / (308.15-298.15) ]
=58.56KJ/mol
六、结果讨论
1.乙酸乙酯皂化反应系吸热反应,混合后体系温度降低,所以在混合后的起始几分钟内所测溶液的电导率偏低,因此最好在反应4min~6min后开始,否则,由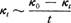 作图得到的是一抛物线,而不是直线。
作图得到的是一抛物线,而不是直线。
2.求反应速率的方法很多,归纳起来有化学分析法及物理化学分析法两类。化学分析法是在一定时间取出一部分试样,使用骤冷或取去催化剂等方法使反应停止,然后进行分析,直接求出浓度。这种方法虽设备简单,但是时间长,比较麻烦。物理化学分析法有旋光、折光、电导、分光光度等方法,根据不同情况可用不同仪器。这些方法的优点是实验时间短,速度快,可不中断反应,而且还可采用自动化的装置。但是需一定的仪器设备,并只能得出间接的数据,有时往往会因某些杂质的存在而产生较大的误差。
第二篇:乙酸乙酯皂化反应速率常数的测定1
乙酸乙酯皂化反应速率常数的测定
电导率的物理意义是表示物质导电的性能。电导率越大则导电性能越强,反之越小。
一、预习提问
1.为什么可用电导法测定乙酸乙酯皂化反应的速率常数?
2.二级反应有什么特点?
3.怎样使用DDS-307型电导率仪?
4.
 各代表什么?如何测定?
各代表什么?如何测定?
二、实验目的及要求
1.了解测定化学反应速率常数的一种物理方法----电导法。
2.了解二级反应的特点,学会用图解法求二级反应的速率常数。
3.掌握DDS-307 型数字电导率仪和控温仪使用方法。
三、实验原理
1.二级反应的动力学方程
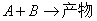
t=0 a a
t=t a-x a-x
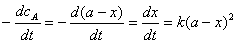 (1)
(1)
定积分得: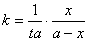 (2)
(2)
以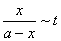 作图若所得为直线,证明是二级反应,并从直线的斜率求出
作图若所得为直线,证明是二级反应,并从直线的斜率求出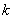 。
。
如果知道不同温度下的速率常数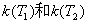 ,按阿仑尼乌斯方程计算出该反应的活化能
,按阿仑尼乌斯方程计算出该反应的活化能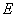 。
。
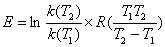 (3)
(3)
2.乙酸乙酯皂化反应是二级反应,反应式为:
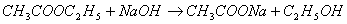
t=0 a a 0 0
t=t a-x a-x x x
t=∞ 0 0 a a
反应前后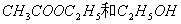 对电导率的影响不大,可忽略。故反应前只考虑
对电导率的影响不大,可忽略。故反应前只考虑 的电导率
的电导率 ,反应后只考虑
,反应后只考虑 的电导率
的电导率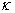 。对稀溶液而言,强电解质的电导率
。对稀溶液而言,强电解质的电导率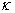 与其浓度成正比,而且溶液的总电导率就等于组成该溶液的电解质电导率之和。
与其浓度成正比,而且溶液的总电导率就等于组成该溶液的电解质电导率之和。
故存在如下关系式:
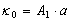
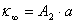
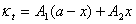
由上三式得: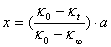 ,代入(2)式得
,代入(2)式得 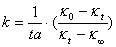
重新排列得: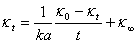
因此,以 作图为一直线即为二级反应,并从直线的斜率求出
作图为一直线即为二级反应,并从直线的斜率求出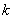 。
。
四、仪器与药品
DDS-307型数字电导率仪(附铂黑电极)1台,恒温水槽1套,停表1只,
叉形电导管2只,直试管1只,移液管(10ml,胖肚)2根,吸液管(5ml 1根,10ml 2根),
烧杯(50ml)1只,容量瓶(100ml)2个,称量瓶(25mmΧ23mm)1只。
乙酸乙酯(分析纯),氢氧化钠(教师预先配制的大浓度0.2mol/l)
五、实验步骤
1.恒温槽调节及溶液的配制
调节恒温槽温度为298.2K(25℃)。同时电导率仪提前打开预热。
先用称量法配制乙酸乙酯溶液100ml,浓度在0.02mol/l左右。
再据所配乙酸乙酯溶液的浓度,配同等浓度的氢氧化钠溶液(由所给大浓度稀释即可)。
2.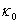 的测定
的测定
分别取10ml蒸馏水和10ml所配 溶液,加到洁净、干燥的叉形管中充分混匀,置于恒温槽中恒温5min。用DDS-307型数字电导率仪测定已恒温好的
溶液,加到洁净、干燥的叉形管中充分混匀,置于恒温槽中恒温5min。用DDS-307型数字电导率仪测定已恒温好的 溶液的电导率
溶液的电导率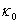 。
。
3.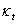 的测定
的测定
在另一只叉形管的直支管中加10ml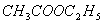 溶液,侧支管中加10ml
溶液,侧支管中加10ml 溶液。恒温后,混合两溶液,同时开启停表,记录反应时间,并把电导电极插入直支管中。当反应进行6min,9min,12min,15min,,20min,25min,30min,35min,40min时各测电导率一次,记录电导率
溶液。恒温后,混合两溶液,同时开启停表,记录反应时间,并把电导电极插入直支管中。当反应进行6min,9min,12min,15min,,20min,25min,30min,35min,40min时各测电导率一次,记录电导率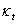 及时间t。
及时间t。
4.调节恒温槽温度为308.2K(35℃),重复上述步骤测定其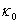 和
和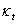 ,但在测定
,但在测定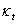 时是按反应进行4min,6min,8min,10min,,12min,15min,18min,21min,24min,27min,30min时测其电导率。
时是按反应进行4min,6min,8min,10min,,12min,15min,18min,21min,24min,27min,30min时测其电导率。
六、结果要求
1. 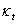 ~
~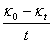 作图应为一线性较好的直线。
作图应为一线性较好的直线。
2. 25℃(24.3℃ )时乙酸乙酯皂化反应速率常数的标准值(摘自I.C.T Vol Ⅶ p.129)为:

其平均活化能为11 kcal.mol-1(摘自“化学便览”基础篇(修订二版)p.1075)。
实验要求k为6±1 (mol/l)-1.min-1,E为11±3 kcal.mol-1。
七、影响结果的一些因素
1.乙酸乙酯皂化反应系吸热反应,混合后体系温度降低,故在混合后的开始几分钟内所测溶液电导偏低。因此最好在反应6分钟后开始测定,否则所得结果呈抛物线形。
2.如NaOH溶液和CH3COOC2H5溶液浓度不等,而所得结果仍用两者浓度相等的公式计算,则作图所得直线也将缺乏线性。
3.温度对速率常数影响较大,需在恒温条件下测定。在水浴温度达到所要的温度后,不急于马上进行测定,须待欲测体系恒温10分钟,否则会因起始时温度的不恒定而使电导偏低或偏高,以致所得直线线性不佳。
4. 测定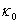 时,所用的蒸馏水最好先煮沸,否则蒸馏水溶有CO2,降低了NaOH的浓度,而使
时,所用的蒸馏水最好先煮沸,否则蒸馏水溶有CO2,降低了NaOH的浓度,而使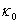 偏低。
偏低。
5.测35℃的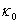 时,如仍用25℃的溶液而不调换,由于放置时间过长,溶液会吸收空气中的CO2,而降低NaOH的浓度,使
时,如仍用25℃的溶液而不调换,由于放置时间过长,溶液会吸收空气中的CO2,而降低NaOH的浓度,使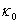 偏低,结果导致k值偏低。
偏低,结果导致k值偏低。
八、实验数据及处理

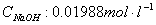
恒温温度:25℃ 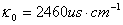 (微西门子每厘米)
(微西门子每厘米)
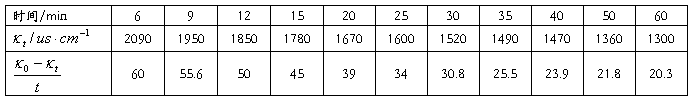
恒温温度:35℃ 

分别以25℃、35℃所测结果作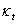 ~
~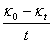 图的二条直线
图的二条直线
25℃直线斜率: ,
,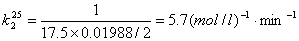
35℃直线斜率: ,
,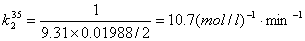
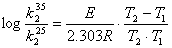

九、思考题
1.为何本实验要在恒温条件下进行,而且NaOH溶液和CH3COOC2H5溶液混合前还要预先恒温?
答:因反应速度与温度有关,温度每升高10℃,反应速度约增加2~4倍,同时电导率也与温度有关,所以实验过程中须恒温。且NaOH溶液和CH3COOC2H5溶液混合前要预先恒温,以保证反应在实验温度下进行。
2.如果NaOH溶液和CH3COOC2H5溶液的起始浓度不相等,试问应怎样计算?
答:要按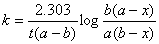 ,
,
式中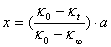 (a为两溶液中浓度较低的一个溶液浓度)
(a为两溶液中浓度较低的一个溶液浓度)
以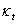 ~t作图,可得到
~t作图,可得到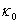 和
和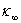 的值,解出不同t时的x值,然后,就可求出k。
的值,解出不同t时的x值,然后,就可求出k。
3.如果NaOH溶液和CH3COOC2H5溶液为浓溶液,能否用此法求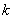 值?为什么?
值?为什么?
答:不能。因为只有对稀溶液,强电解质的电导率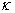 与其浓度成正比,才会推倒得到
与其浓度成正比,才会推倒得到
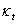 ~
~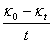 作图为一直线,进而求得
作图为一直线,进而求得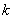 值。
值。
十、实验注意事项:
1.用书中的公式计算速率常数(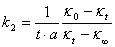 )时,要求所用的NaOH溶液和CH3COOC2H5溶液两者的浓度要相同。
)时,要求所用的NaOH溶液和CH3COOC2H5溶液两者的浓度要相同。
2.由于CH3COOC2H5易挥发,故称量时应在称量瓶中准确称取,并需动作迅速。
3. 由于CH3COOC2H5在稀溶液中能缓慢水解,会影响CH3COOC2H5的浓度,且水解产物CH3COOH又会消耗NaOH。所以CH3COOC2H5水溶液应在使用时临时配制。
4.在测定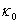 时,所用的蒸馏水最好先煮沸,以除去CO2;25℃和35℃的
时,所用的蒸馏水最好先煮沸,以除去CO2;25℃和35℃的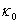 测定中,溶液须更换。
测定中,溶液须更换。
5.测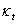 时,叉型管中的NaOH溶液和CH3COOC2H5溶液必须在叉型管中的侧、直支管间多次来回反复混合,以确保混合均匀。
时,叉型管中的NaOH溶液和CH3COOC2H5溶液必须在叉型管中的侧、直支管间多次来回反复混合,以确保混合均匀。
6.注意不可用纸擦电导电极上的铂黑。
-
乙酸乙酯皂化反应实验报告
乙酸乙酯皂化反应速度常相数的测定一、实验目的1.通过电导法测定乙酸乙酯皂化反应速度常数。2.求反应的活化能。3.进一步理解二级反应…
-
物理化学实验报告 乙酸乙酯皂化反应
物理化学实验报告乙酸乙酯皂化反应动力学1目的1了解二级反应的特点2用电导法测定乙酸乙酯皂化反应的速率常数3用不同温度下的反应速率常…
-
物化实验报告_乙酸乙酯皂化反应速率
实验9乙酸乙酯皂化反应速率系数测定丛乐20xx011007生51实验日期20xx年12月8日星期六提交报告日期20xx年12月22…
-
乙酸乙酯皂化反应速率常数的测定实验报告
学号20xx14120xx2基础物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定应用化学二班班级03组号实验人姓名xx同组人…
-
乙酸乙酯皂化反应速率常数的测定的实验报告
实验七乙酸乙酯皂化反应速率常数的测定日期20xx0618来源作者字体大中小乙酸乙酯皂化反应速率常数的测定一目的及要求1测定皂化反应…
-
乙酸乙酯皂化反应速率常数的测定实验报告
学号20xx14120xx2基础物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定应用化学二班班级03组号实验人姓名xx同组人…
-
物化实验报告_乙酸乙酯皂化反应速率
实验9乙酸乙酯皂化反应速率系数测定丛乐20xx011007生51实验日期20xx年12月8日星期六提交报告日期20xx年12月22…
-
乙酸乙酯皂化反应实验报告
乙酸乙酯皂化反应速度常相数的测定一、实验目的1.通过电导法测定乙酸乙酯皂化反应速度常数。2.求反应的活化能。3.进一步理解二级反应…
-
物理化学实验报告 乙酸乙酯皂化反应
物理化学实验报告乙酸乙酯皂化反应动力学1目的1了解二级反应的特点2用电导法测定乙酸乙酯皂化反应的速率常数3用不同温度下的反应速率常…
-
,乙酸乙酯皂化反应速率常数的测定
学号20xx14370135基础物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定应用化学师范班班级03组号实验人姓名xxx同…