实验一:一定物质量浓度溶液的配制实验报告
【实验目的】
1.熟练掌握配制一定物质的量浓度的溶液及容量瓶的使用方法;
2.加深对物质的量浓度概念的理解。
【实验内容】
配制0.1mol/L硫酸铜溶液
1. 实验原理
溶液稀释前后溶质的物质的量不变。
2.实验装置图
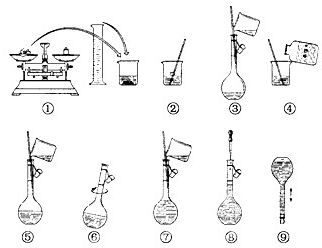
3.实验所需仪器及药品
托盘天平、小烧杯、药匙、容量瓶(250ml)、胶头滴管、玻璃棒、量筒、蒸馏水、CuSO4.5H2O固体
4.实验步骤
(1) 计算:所需固体粉CuSO4.5H2O 固体的质量为:
m(CuSO4.5H2O)=250×10-3×0.1mol/L×250g·mol-1=6.25g
(2)溶解:将固体置于250ml烧杯中,加入约所配溶液体积一半的水溶解,搅拌并冷却到室温。
(3) 转移液体: 将冷却后的溶液沿玻璃棒转移到容量瓶中。
(4)洗涤: 用少量蒸馏水洗涤烧杯2-3次,并将洗涤液也全部转移到容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
(5)定容: 向容量瓶中加水至离刻度1-2cm处,改用胶头滴管加水至刻度线。定容时,溶液凹液面恰好与刻度线相切。
(6)摇匀。
5.注意事项
(1) 在溶解过程中,不能用玻璃棒剧烈搅拌,否则溶液易溅出;
(2) 定容时滴加液体不能超过刻度线,否则实验失败,应倒掉重新配制;
(3)定容时,平视溶液凹液面恰好与刻度线相切。
【参考文献】
人教版化学必修一第一章
第二篇:一定物质量浓度溶液的配制实验报告
配制一定物质的量浓度的溶液
考试内容:配制100ml0.1mol/LNa2CO3溶液
实验名称:配制100ml0.1mol/LNa2CO3溶液
实验目的:练习配制一定物质的量浓度的溶液;加深对物质的量浓度概念的理解;练习容量瓶的使用方法。
实验原理:溶液稀释前后溶质的物质的量不变。
实验用品:托盘天平、小烧杯、药匙、容量瓶(100ml)、胶头滴管、玻璃棒、量筒、蒸馏水、Na2CO3固体粉末
实验步骤与装置图:
1.计算 所需 Na2CO3固体粉末的质量为:
m(Na2CO3)=100×10-3×0.1mol/L×106g·mol-1=1.06g 因为托盘天平的精确度只能达到0.1,所以应称量1.1g 。
2.称量 称量固体一般应在托盘天平两端各垫一张大小相同的纸。
3.溶解 先将固体置于烧杯中,加入约所配溶液体积一半的水溶解,搅拌并冷却到室温。
4.转移液体 将冷却后的溶液沿玻璃棒转移到容量瓶中。
5.洗涤 用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
6.定容 向容量瓶中加水至离刻度1~2cm处,改用胶头滴管加水至刻度线。定容时,溶液凹液面恰好与刻度线相切。
7.摇匀
①计算;②称量;③溶解;④冷却转移;⑤振荡;⑥定容;⑦摇匀;⑧倒瓶贴签。

实验现象及误差分析:
1.在溶解过程中用玻璃棒搅拌过于剧烈,不慎溅出几滴溶液,会时配成的溶液浓度比标准值偏低。解释:因溅出几滴溶液会使溶液中溶质的物质的量减少,而溶液的体积不变,所以浓度偏低。
2.定容后的溶液从容量瓶导入试剂瓶时,不慎倒在外面少许,不会造成误差。解释:往试剂瓶倒入时不慎倒出少许,影响的仅是所配之溶液的体积,对所配溶液的物质的量浓度无任何影响。
3.定容时不慎滴加液体超过刻度线,则改实验失败,应倒掉重新配制。解释,容量瓶只能配制固定体积的溶液,定容超过刻度线,就意味着实验失败。
4.定容时观察液面俯视读数,将会使实验结果偏高。解释:俯视读数将会使实际所配制的溶液体积偏小,而使实验结果偏高。
- 配制溶液实验报告
-
配制一定物质的量浓度的溶液实验报告
配制一定物质的量浓度的溶液实验报告实验目的1练习配制一定物质的量浓度的溶液2加深对物质的量浓度概念的理解3练习容量瓶胶头滴管的使用…
-
一定物质的量浓度溶液的配制实验报告
一定物质的量浓度溶液的配制实验报告班级姓名座号评分实验目的123实验仪器实验药品NaCl实验4配制100mL100molL的NaC…
-
无机化学实验第四版实验三:溶液的配制实验报告
实验名称溶液的配制实验日期温度气压一实验目的1学习比重计移液管容量瓶的使用方法2掌握溶液的质量分数质量摩尔浓度物质的量浓度等一般配…
-
一定物质的量浓度溶液的配制实验报告[1]
一定物质的量浓度溶液的配制实验报告班级姓名实验组别实验时间实验目的1练习配制一定物质的量浓度的溶液2加深对物质的量浓度概念的理解3…
-
一定物质量浓度溶液的配制实验报告
配制一定物质的量浓度的溶液考试内容配制100ml01molLNa2CO3溶液实验名称配制100ml01molLNa2CO3溶液实验…
-
配制一定物质的量浓度的溶液实验报告
配制一定物质的量浓度的溶液实验报告实验目的1练习配制一定物质的量浓度的溶液2加深对物质的量浓度概念的理解3练习容量瓶胶头滴管的使用…
-
一定物质的量浓度溶液的配制实验报告
一定物质的量浓度溶液的配制实验报告班级姓名座号评分实验目的123实验仪器实验药品NaCl实验4配制100mL100molL的NaC…
-
实验活动5_一定溶质质量分数的氯化钠溶液的配制实验报告
班级授课教师日期实验报告一实验目的二实验仪器与药品三实验步骤1配制质量分数为6的氯化钠溶液1计算配制50g质量分数为6的氯化钠溶液…
-
一定物质的量浓度溶液的配制实验报告
一定物质的量浓度溶液的配制实验报告班级姓名座号实验名称配制100mL100molL的NaCl溶液实验目的1练习配制一定物质的量浓度…
- 一定溶质质量分数的氯化钠溶液的配制实验报告单